-
1、短周期主族元素、、、、在元素周期表中的位置如图所示,其中为能壳中含量最高的金属元素。

请用化学用语回答下列问题:
(1)、元素在周期表中的位置: , 的空间结构为形,上述非金属元素形成的简单氢化物中沸点最高的为(用化学式表示)。(2)、、、对应的最高价含氧酸酸性由强到弱的顺序是(用化学式表示)。(3)、与同主族且相邻,、、可形成一个三原子分子,且每个原子均达到8电子稳定结构,则该分子的结构式为;元素氢与元素、元素氢与元素均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,请写出该反应的化学方程式:。(4)、由元素、形成的物质与由元素和元素氢形成的化合物可发生以下反应:
①写出的电子式 , 含有的化学键类型为。
②写出溶液与溶液反应的离子方程式。
-
2、一块的铁铝合金,加入一定量的稀硫酸后合金完全溶解,然后加至溶液中无存在,加热除去多余的。当加入溶液至沉淀量最多时,所得沉淀质量为。则该合金中铁的质量为( )A、 B、 C、 D、
-
3、下列实验目的、方案设计和现象、结论都正确的是( )
选项
实验目的
方案设计和现象
结论
A
验证浓硫酸的性质
将浓硫酸滴入蔗糖中并搅拌,得到黑色蓬松的固体,并产生刺激性气味的气体
浓硫酸具有强氧化性和脱水性
B
探究钠在空气中久置后所得固体成分
取少量固体,加入蒸馏水,有气体产生
固体中一定含
C
检验某溶液中是否含有
取少量待检液于试管中,滴加新制氯水后滴加溶液,溶液变为红色
该溶液含有
D
检验和浓盐酸反应后是否有酸剩余
取少量反应后的溶液于试管中,依次加入稀硝酸、溶液
产生大量白色沉淀,则盐酸有剩余
A、A B、B C、C D、D -
4、气体与足量溶液完全反应后,再加入溶液,发生如下反应:①;②。下列说法正确的是( )A、氧化性: B、若有6.72L完全反应,最终消耗0.2mol C、反应①中被还原的物质是 D、反应②中,1mol参加反应,转移电子的数目为
-
5、下列离子方程式书写正确的是( )A、与溶液的反应: B、将粉溶解于过量稀硫酸中: C、向溶液中通入少量: D、向中滴加溶液至恰好沉淀完全:
-
6、某小组同学探究和的性质及相互转化,实验如下(夹持装置已略去,气密性已检验)。以下说法错误的是( )
实验Ⅰ
实验Ⅱ

 A、实验Ⅰ,A中澄清石灰水无明显变化,B中澄清石灰水变浑浊 B、实验Ⅱ,方框中的试剂a为饱和碳酸氢钠溶液 C、实验Ⅱ中,一段时间之后,可观察到烧杯中有细小晶体析出 D、等物质的量的、分别与足量盐酸反应,生成的更多
A、实验Ⅰ,A中澄清石灰水无明显变化,B中澄清石灰水变浑浊 B、实验Ⅱ,方框中的试剂a为饱和碳酸氢钠溶液 C、实验Ⅱ中,一段时间之后,可观察到烧杯中有细小晶体析出 D、等物质的量的、分别与足量盐酸反应,生成的更多 -
7、部分含氯物质的分类与相应氯元素的化合价关系如图所示。下列说法不正确的是( )
 A、b→a一定需要加还原剂才能进行 B、c可作为一种新型自来水消毒剂 C、f→d可以通过加稀硫酸实现转化 D、一定条件下a和f可能发生反应得到b
A、b→a一定需要加还原剂才能进行 B、c可作为一种新型自来水消毒剂 C、f→d可以通过加稀硫酸实现转化 D、一定条件下a和f可能发生反应得到b -
8、用表示阿伏加德罗常数的值,下列叙述正确的是( )A、溶于足量水中,转移的电子数为 B、与的混合物中所含中子数为 C、溶液中含有分子的数目为 D、与的混合气体含有原子的数目为
-
9、在某澄清透明溶液中,能大量共存的一组离子是( )A、、、、 B、、、、 C、、、、 D、、、、
-
10、下列物质的性质与用途具有对应关系的是( )A、二氧化硫具有氧化性,可用来漂白织物 B、易液化,汽化时吸收大量的热,液氨可用作制冷剂 C、氧化铝耐高温,制作的坩埚可用来加热熔化碱性物质 D、碳酸氢钠能与碱反应,因此可用作食品膨松剂
-
11、在下列物质中,所含化学键类型相同的一组是( )A、Na2O2、H2O2 B、Na2S、SO2 C、CCl4、CH4 D、NH4Cl、HCl
-
12、日本福岛核废水排海引起舆论风波,核废水中不只含有放射性氚,真正具有伤害性的,还有6种放射性元素,分别是碘、铯和铯、碳、钴和锶。下列叙述正确的是( )A、原子所含中子数与质子数之差为25 B、和互称为同素异形体 C、铯的核外电子数为65 D、和的核外电子数之差为4
-
13、下列化学用语正确的是( )A、的电子式
 B、次氯酸的结构式:
C、的电子式
B、次氯酸的结构式:
C、的电子式 D、的结构示意图
D、的结构示意图
-
14、中华文化源远流长、博大精深。下列说法不正确的是( )A、先秦文献《考工记》记录了六类青铜器物的合金成分配比,合金的熔点一般比纯金属的低 B、《本草经集注》中记载了区分硝石()和朴硝()的方法:“以火烧之,紫青烟起,乃真硝石也”,二者可以利用“焰色试验”区分 C、《神农本草经》中提到“白青[]得铁化为铜”,其中白青属于碱 D、“蜡炬成灰泪始干”、“爆竹声中一岁除”中均涉及氧化还原反应
-
15、规范、科学处置废旧锂离子电池具有重要的环保意义和经济价值。废旧锂离子电池的正极材料主要含有及少量Al、Fe等,处理该废料的一种工艺流程如图所示。

已知:①难溶于水。
②相关金属离子形成氢氧化物沉淀的pH如下表所示。
开始沉淀的pH
2.7
7.6
7.0
完全沉淀的pH
3.7
9.6
9.0
③的溶解度(S)随温度(T)的变化曲线如下图所示。
 (1)、化合物中钴元素的化合价为价。(2)、“放电处理”有助于锂元素在正极的回收,电池放电时的总反应为 , 则此时正极的电极反应式为。(3)、“碱溶”过程主要发生的离子方程式为。(4)、为提高“酸溶”的速率,可采取的措施有(任写一条)。(5)、“调pH”时,用氨水调节pH的范围为。(6)、“沉钴”过程中对产生的沉淀洗涤的实验操作为。(7)、“沉锂”后,洗涤所得沉淀要使用(填“热水”或“冷水”)。
(1)、化合物中钴元素的化合价为价。(2)、“放电处理”有助于锂元素在正极的回收,电池放电时的总反应为 , 则此时正极的电极反应式为。(3)、“碱溶”过程主要发生的离子方程式为。(4)、为提高“酸溶”的速率,可采取的措施有(任写一条)。(5)、“调pH”时,用氨水调节pH的范围为。(6)、“沉钴”过程中对产生的沉淀洗涤的实验操作为。(7)、“沉锂”后,洗涤所得沉淀要使用(填“热水”或“冷水”)。 -
16、甲烷在日常生活及有机合成中用途广泛,某实验小组研究甲烷在高温下气相裂解反应的原理及其应用。
已知:①
②
(1)、裂解反应的。(2)、在某密闭容器中投入 , 在不同条件下发生反应:。实验测得平衡时的物质的量随温度、压强的变化如图所示。
①M点时,的转化率为;温度:(填“>”、“<”或“=”)。
②M、N、Q三点的平衡常数由大到小的顺序为。
③M点对应的压强平衡常数(以分压表示,分压=总压×物质的量分数,整理出含的最简表达式)。
④若向M点对应平衡体系中再充入、和 , 此时平衡向(填“正反应”或“逆反应”)方向移动。
(3)、在恒温恒容条件下,充入一定量 , 发生反应。下列能判断该反应达到平衡状态的是(填字母)。a.
b.的体积分数不再改变
c.混合气体的密度不再改变
d.同一时间内,消耗 , 生成
-
17、是高中化学中常见铵盐,试运用所学相关的化学知识解答下列问题。
已知:ⅰ.25℃时,的
ⅱ.氯化铵的抗碱容量是指用溶液滴定溶液至时,单位质量的所消耗的物质的量,即
(1)、的电子式。(2)、溶液呈性(填“酸”或“碱”),现有溶液,则该溶液在25℃时的pH为。(3)、某化学小组测定固体抗碱容量 , 实验步骤如下:a.配置溶液;
b.称取固体,溶于水中,用上述溶液滴定至。
①步骤a需要称量固体为g。
②步骤b需要用到下图所示仪器中的(填名称)。
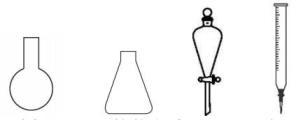
③步骤b消耗的体积为ymL,则。
(4)、混合溶液具有抗碱能力。向该溶液中加入少量 , 溶液的pH变化不大。现有混合溶液(物质的量之比为),对于该混合溶液的下列叙述中正确的是____。A、常温下,该混合溶液呈酸性 B、溶液中离子浓度大小关系为: C、溶液中离子浓度存在恒等式: D、溶液中微粒间满足: -
18、滴定实验是化学学科中最重要的定量实验之一。常见的滴定实验有酸碱中和滴定、氧化还原反应滴定、沉淀滴定等等。
Ⅰ.用的NaOH溶液分别滴定的盐酸和醋酸溶液各。滴定过程中溶液pH随溶液体积变化的两条滴定曲线如图所示:
 (1)、滴定醋酸的曲线是(填“Ⅰ”或“Ⅱ”)。(2)、和的关系:(填“>”、“=”或“<”)。(3)、Ⅱ.获取安全的饮用水一直以来都是人们关注的重要问题,自来水厂经常用氯气进行杀菌,某化学兴趣小组利用氧化还原反应滴定,测定了某工厂废水中游离态氯的含量,实验步骤如下:
(1)、滴定醋酸的曲线是(填“Ⅰ”或“Ⅱ”)。(2)、和的关系:(填“>”、“=”或“<”)。(3)、Ⅱ.获取安全的饮用水一直以来都是人们关注的重要问题,自来水厂经常用氯气进行杀菌,某化学兴趣小组利用氧化还原反应滴定,测定了某工厂废水中游离态氯的含量,实验步骤如下:①取水样于锥形瓶中,加入溶液(足量),滴入2~3滴淀粉溶液。
②将自己配制的标准溶液(显碱性)装入滴定管中,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:
试回答下列问题:
①滴定前装有标准液的滴定管排气泡时,应选择下图中的(填标号,下同)。
A.
 B.
B. C.
C. D.
D.
②若用滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积。
A. B. C. D.
(4)、步骤①发生反应的离子方程式为。(5)、达到滴定终点的现象是。(6)、实验测得游离态氯的浓度比实际浓度偏大,造成误差的原因可能是____。A、锥形瓶水洗后直接装待测水样 B、配制标准溶液定容时,加水超过刻度线 C、装标准溶液的滴定管水洗后没有润洗 D、滴定到达终点时,俯视读出滴定管读数 -
19、下列实验操作能达到实验目的的是( )。
选项
实验目的
实验操作
A
比较和溶度积大小
向的硝酸银溶液中先滴加2~3滴浓度为的溶液,再滴加2~3滴相同浓度的KI溶液,观察生成沉淀的颜色
B
探究化学反应是否可逆
向的KI溶液中滴加2滴的溶液,充分反应后,滴入2滴的溶液,观察现象
C
探究浓度对盐类水解平衡的影响
向滴有酚酞的碳酸钠溶液中加入等体积蒸馏水,观察现象
D
比较和酸性强弱
用pH试纸测定溶液和溶液的pH
A、A B、B C、C D、D -
20、对于下列反应,其反应过程的能量变化如图所示:

编号
反应
平衡常数
反应热
反应①
反应②
反应③
下列说法不正确的是( )。
A、 B、 C、增大压强,反应①②③的反应速率均加快 D、升高温度,增大,减小、不变