2025年上海市等级考化学试题【网络回忆版】
试卷更新日期:2025-06-11 类型:高考真卷
一、碳酸丙烯酯 PC的合成
-
1.
已知反应1
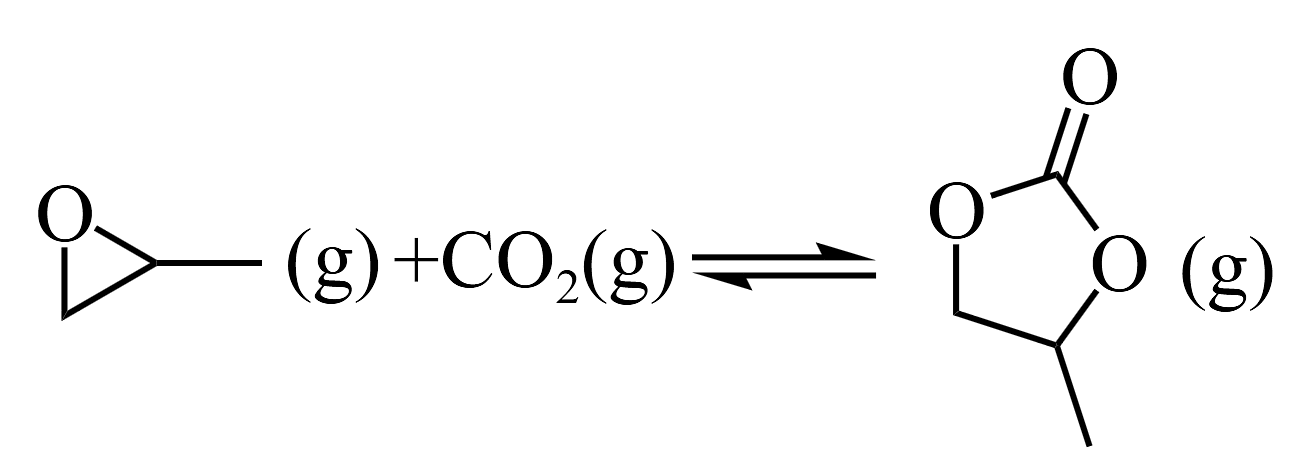 的
的反应2的
反应3的
反应4的
物质
环氧丙烷
(1)计算出_______。
A. B. 613.2 C. 395.2 D. (2)随温度T的变化趋势________。
(3)
 中电负性最大的是________。
中电负性最大的是________。A.C B.H C.O
(4)
 分了中键的数目为_______。
分了中键的数目为_______。A. 7 B. 12 C. 13 D. 14 已知:环氧丙烷生成
 会发生副反应
会发生副反应选择性=转化生成A的环氧丙烷/消耗环氧丙烷
M(环氧丙烷) ρ(环氧丙烷)
容器容积的高压反应釜反应后体积缩小为 , 选择性为95%,反应。
(5)求环氧丙烷的化学反应速率________(精确到小数点后2位)
(6)下列哪种操作可以使得活化分子的百分数变大_______。
A. 升高温度 B. 增大浓度 C. 压缩容器 D. 充入惰性气体 (7)碳酸丙烯酯相同时间内随温度变化如图所示,请解释产率随温度先升后下降的原因________。
(8)达到平衡的判据_______。
A. v正=v逆 B. 体系总质量不变 C. 气体体积不再变化 D. 混合气体密度(可能是摩尔质量)不变 (9)制备
 还有一种光气法,用
还有一种光气法,用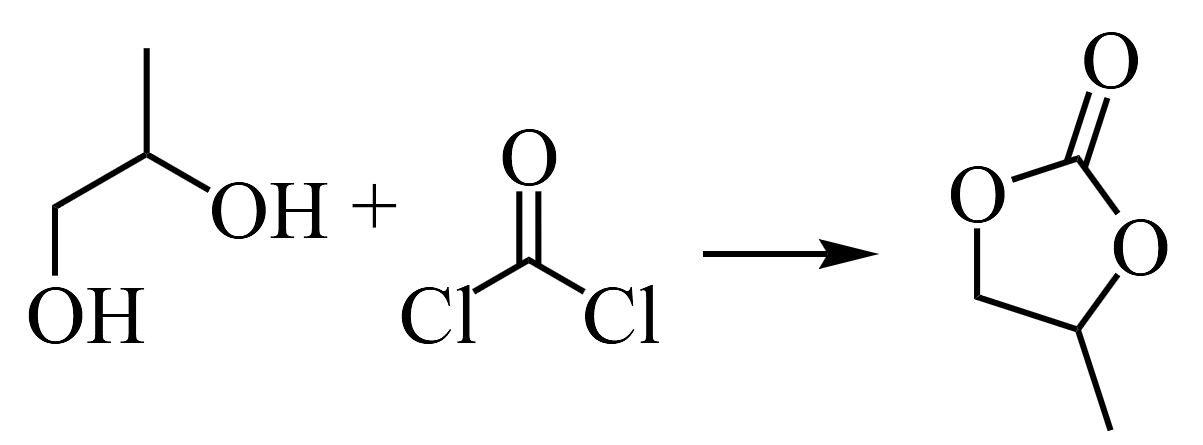 。请从绿色化学的角度解释,写出3点与光气-二醇法相比,法合成的优势________。
。请从绿色化学的角度解释,写出3点与光气-二醇法相比,法合成的优势________。二、“重石头”元素——钨
-
2.
(以下题目中的图片根据回忆所得信息结合文献资料重新整合所得,仅供参考)
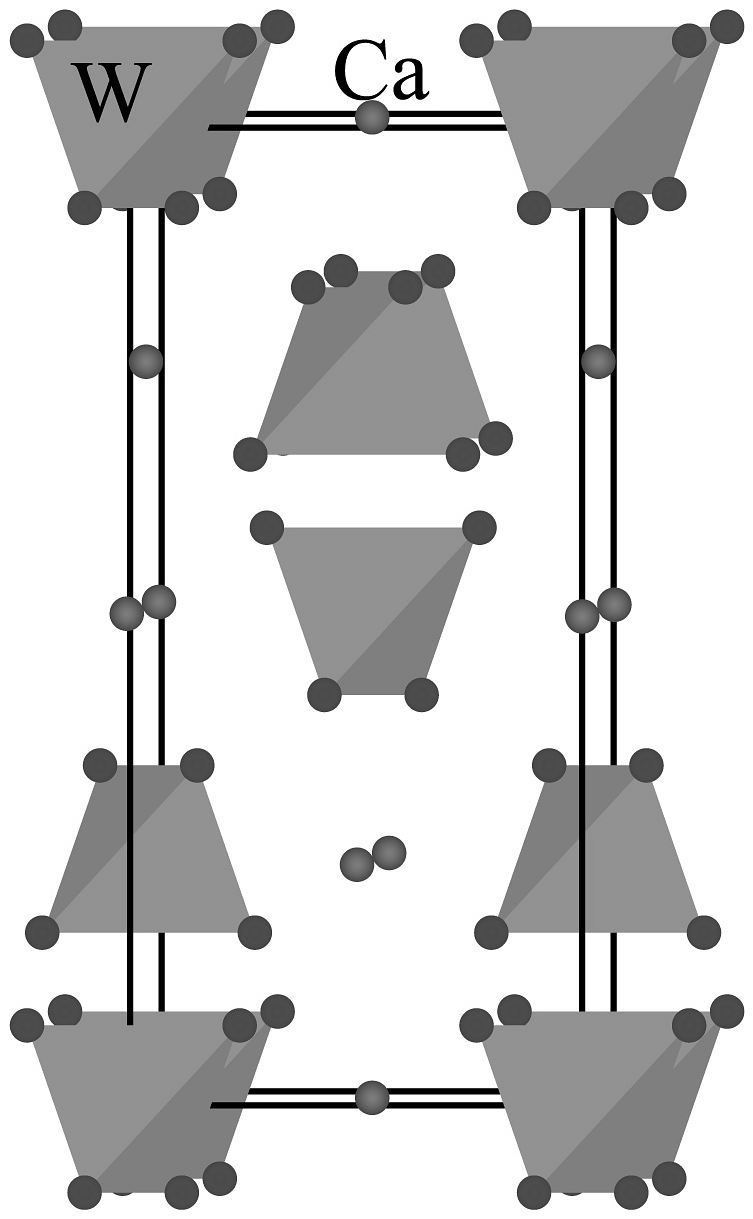
(1)钨作灯丝与_______性质有关(不定项)。
A.延展性 B导电性 C.高熔点 D.高密度
(2)钨有金属光泽的原因________ (从微观角度解释)。(3)原子在晶胞中的_______位置。
A. 顶点 B. 棱上 C. 面上 D. 体心 (4)钨在周期表中的位置是_______。

A. 第五周期第ⅡB族 B. 第五周期第ⅣB族 C. 第六周期第ⅡB族 D. 第六周期第ⅥB族 (5)根据价层电子对斥理论,的价层电子对数是________。
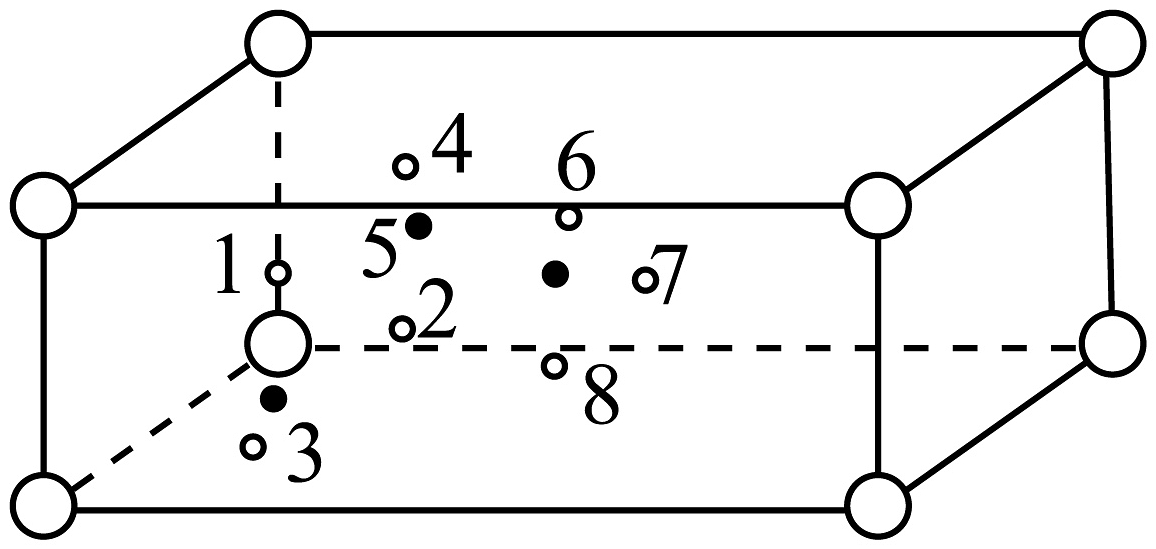
(6)图晶胞号O原子,若晶胞仅含1个完整四面体,组成该四面体的O编号是________。
表格(各种矿石密度)。

(7)给出晶胞参数,求并说明“重石头”俗名依据________。(有V和M?)
电解制备是光电陶瓷材料
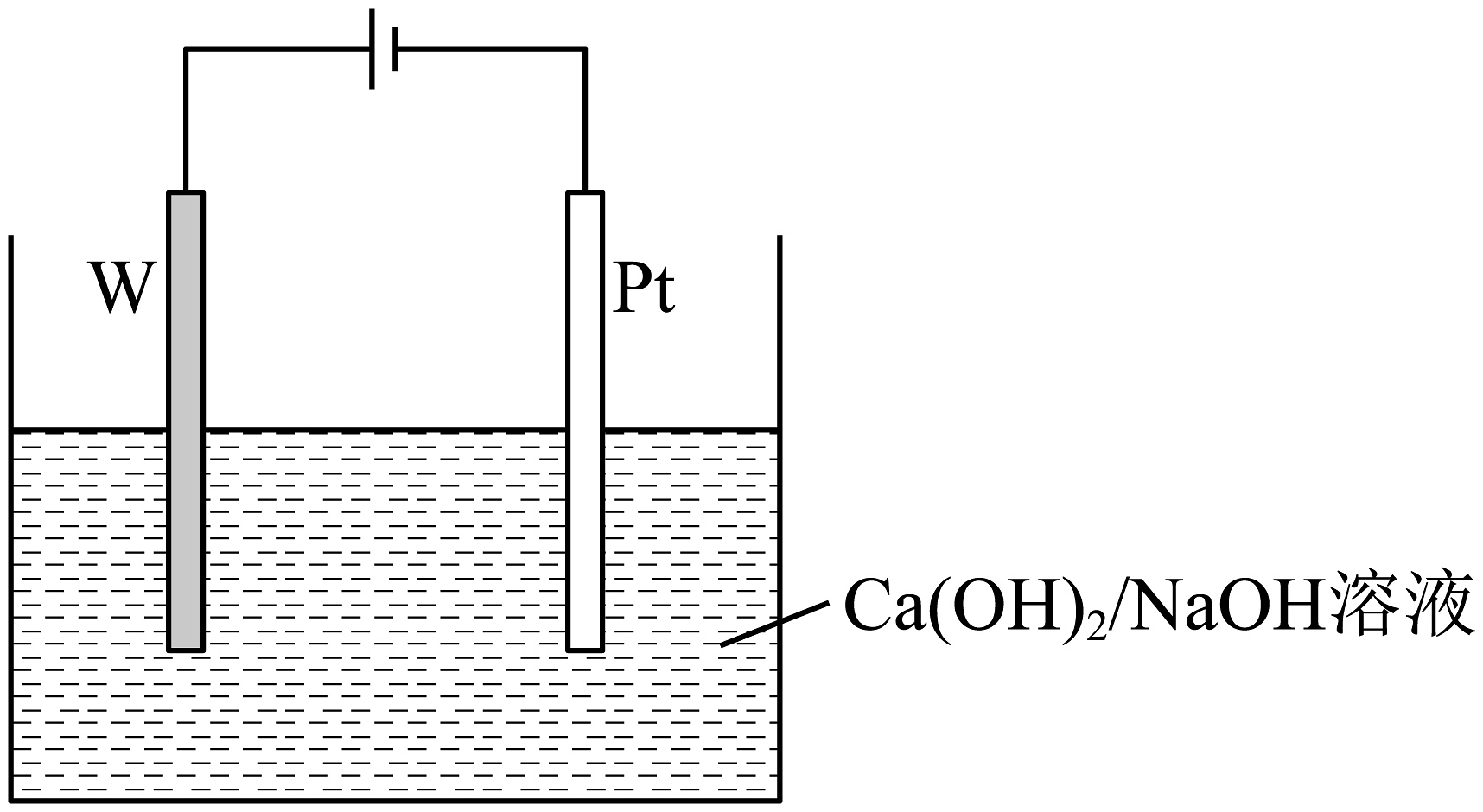
已知
(8)写出电解的阳极方程式________。
(9)为获取高纯产物,制备时需要不断通入的原因________。
三、福辛普利中间体合成
-
3. (以下题目中的流程根据回忆所得信息结合文献资料重新整合所得,仅供参考)
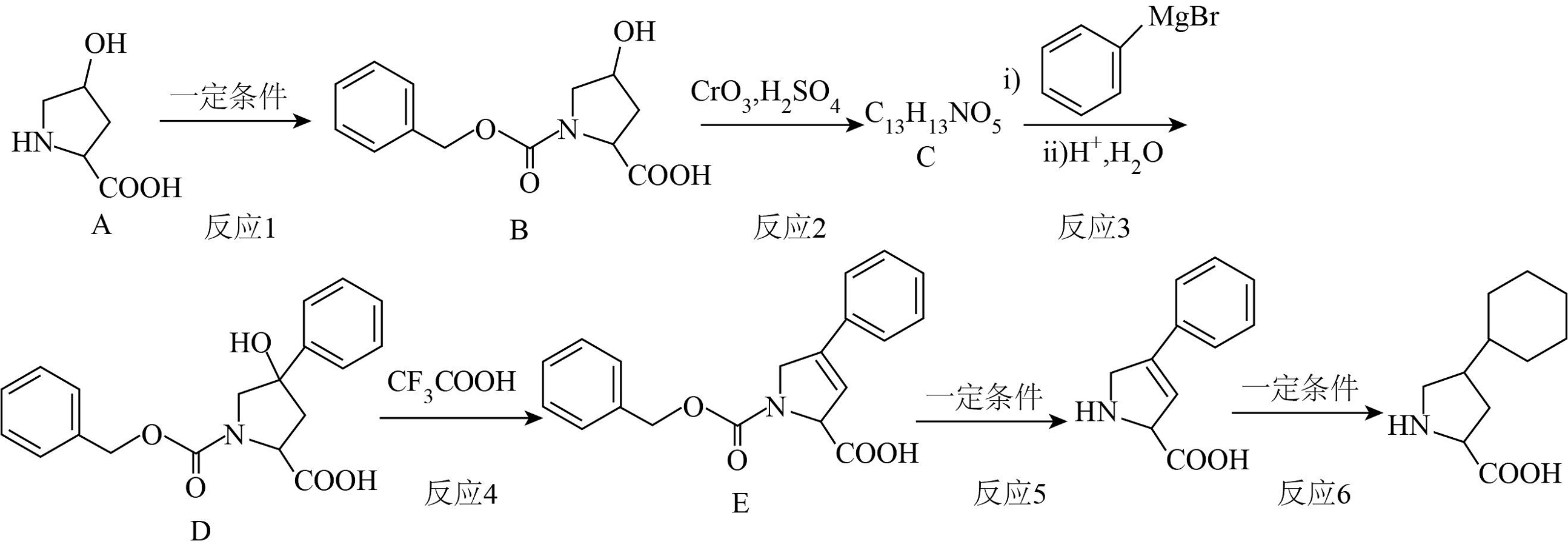
已知:
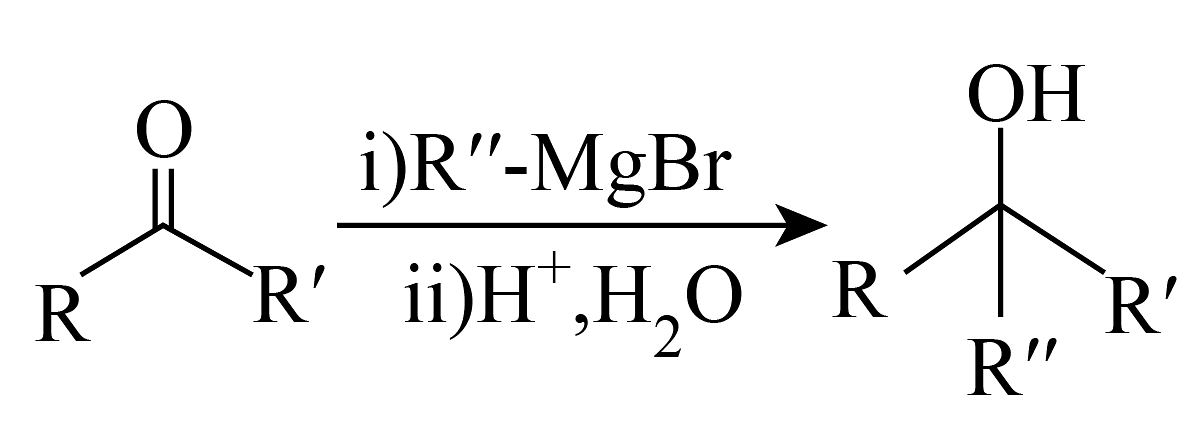 (1)、A中含氧官能团的结构简式为:。(2)、反应1的作用是:。(3)、反应2为(反应类型)。(4)、D中有_______个手性碳原子。A、1 B、2 C、3 D、4(5)、生成E的同时会生成其同分异构体H,H的结构简式为:。(6)、关于化合物E的说法中正确的是_______。A、碳的杂化方式有和两种 B、能与茚三酮反应 C、能与反应产生 D、能形成分子间氢键(7)、F的同分异构体I水解后生成J、K,写出一种符合条件的I即可。
(1)、A中含氧官能团的结构简式为:。(2)、反应1的作用是:。(3)、反应2为(反应类型)。(4)、D中有_______个手性碳原子。A、1 B、2 C、3 D、4(5)、生成E的同时会生成其同分异构体H,H的结构简式为:。(6)、关于化合物E的说法中正确的是_______。A、碳的杂化方式有和两种 B、能与茚三酮反应 C、能与反应产生 D、能形成分子间氢键(7)、F的同分异构体I水解后生成J、K,写出一种符合条件的I即可。i.J是有3个碳原子的α-氨基酸
ii.K遇溶液溶液能显色
iii.由核磁共振氢谱分析,K的苯环上有2种氢,个数比为
(8)、反应的反应条件是:。(9)、以和 为原料,合成
为原料,合成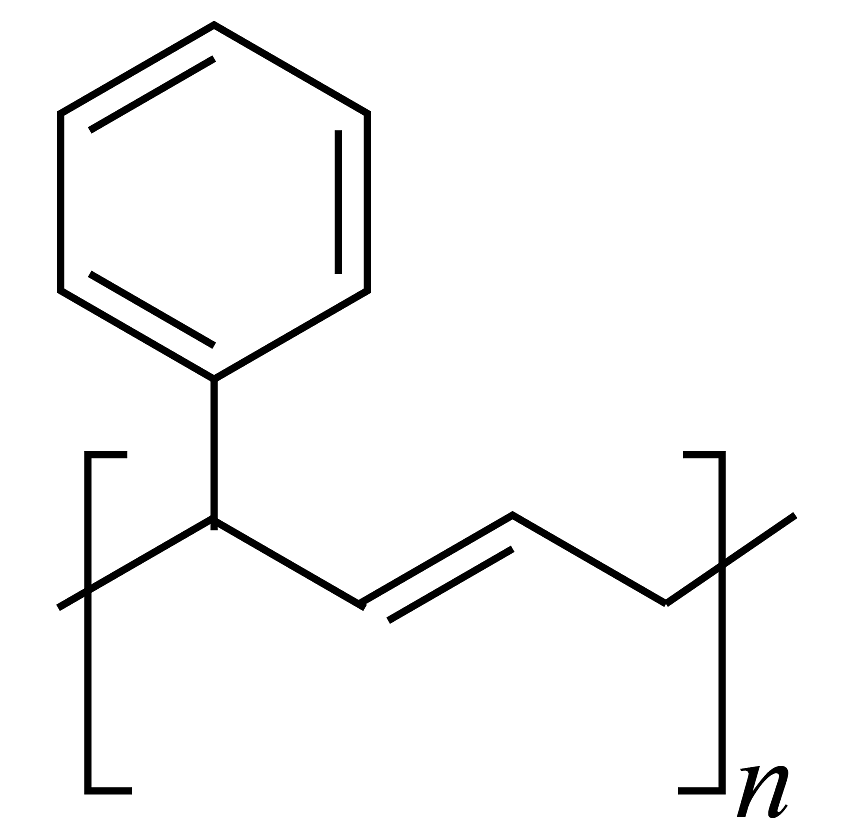 (无机试剂任选)。
(无机试剂任选)。 四、锗的工业提取
-
4.
工业从低品位锗矿中提取精锗,使用分步升温的方法:

(1)验证矿石中的锗元素可使用的方法为________。
A.原子发射光谱法 B.红外光谱法 C.X射线衍射
(2)既能和强酸反应,也能与强碱反应,由此推测是________氧化物。
已知矿中含有、煤焦油、等杂质,相关物质的熔、沸点如下表所示:
煤焦油
熔点
升华
沸点
(3)使用分段升温的原因是________。
(4)下图为在不同温度下,使用不同浓度的真空还原时,元素的萃出率,图可知真空还原采用的最佳温度及浓度为_______。
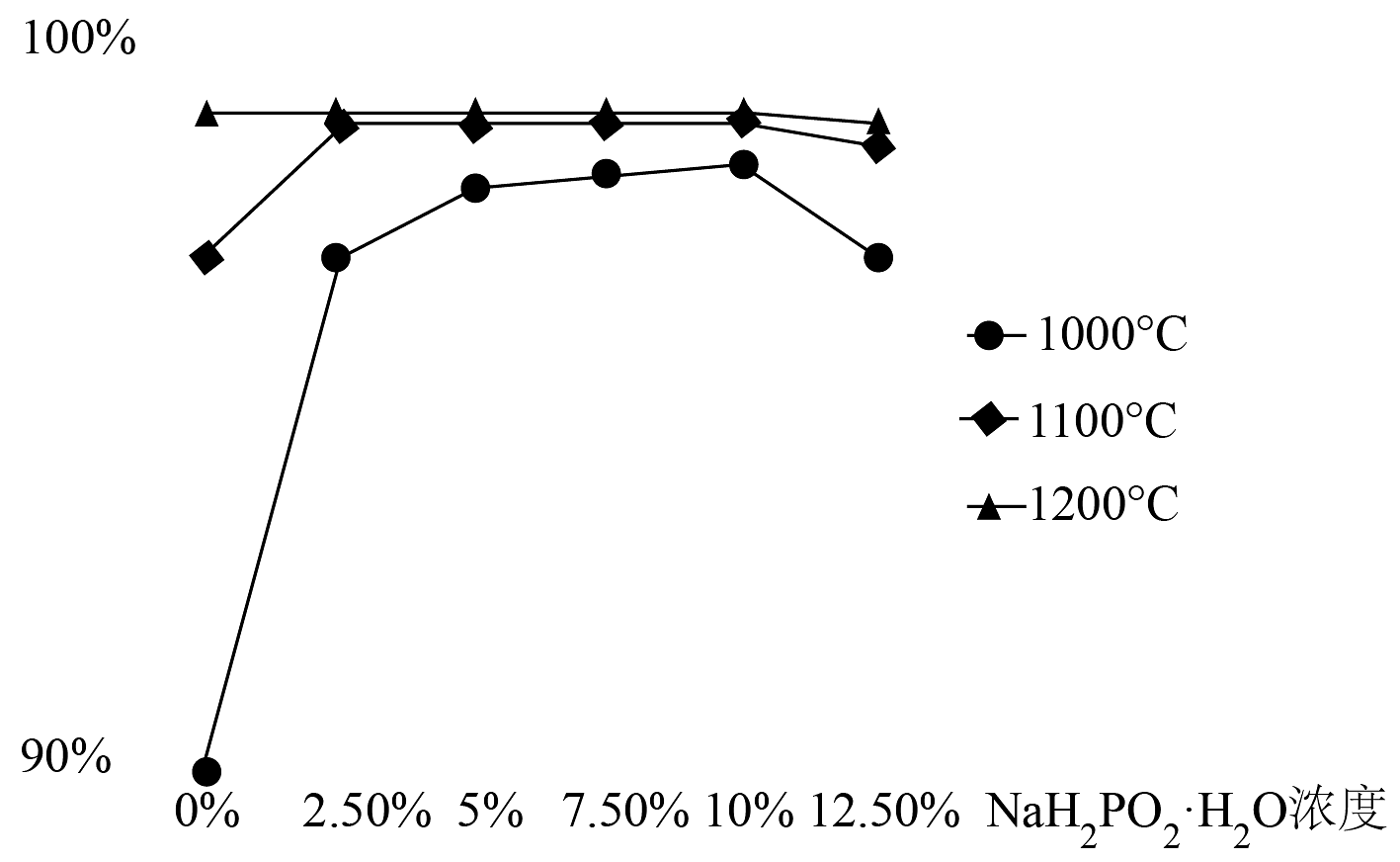
A. , 2.5% B. , 5.0% C. , 2.5% D. , 2.5% (5)真空还原阶段用除 , 产物还有等生成,写出该阶段的化学方程式________。
采用滴定法测定样品中元素含量的方法如下:
(以下实验过程根据回忆所得信息结合文献资料重新整合所得,仅供参考)
准确称取含锗矿石粉末,置于圆底烧瓶中。加入浓盐酸和溶液,加热至微沸(溶解)冷却后,加入 , 搅拌至溶液变为无色。将溶液转移至锥形瓶,用稀盐酸冲洗烧瓶并入锥形瓶中。
加入磷酸 , 冷却溶液至以下(冰水浴),用橡胶塞密封锥形瓶。向锥形瓶中加入淀粉溶液作为指示剂。用标准溶液滴定至滴定终点。
记录消耗的体积为。
(还原)
(主反应)
(终点反应)
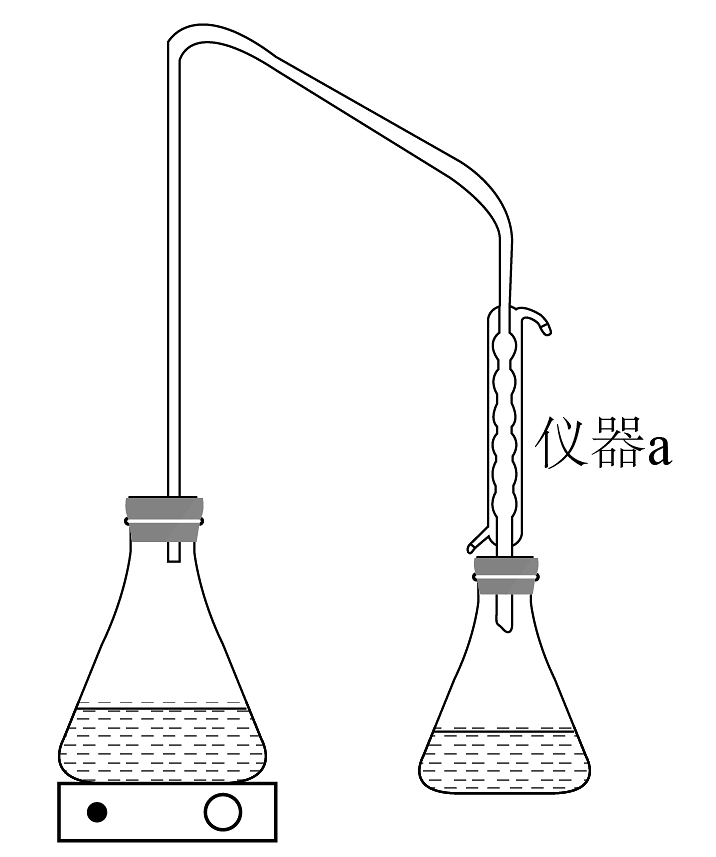
(6)装置a名称为_______。
A. 锥形瓶 B. 恒压滴液漏斗 C. 球形冷凝管 D. 滴定管 (7)滴定终点时,颜色由________变为________,半分钟不褪色。
(8)滴定时为什么要用橡胶塞塞紧锥形瓶________?(真空还原)
(9)已知 , 求样品(固体)中元素的质量分数【纯度】________(用c、V、m表示)。
(10)滴定结果纯度偏大,可能的原因是_______。
A. 未用标准溶液润洗滴定管 B. 未用将样品从冷凝管中洗入锥形瓶(仪器a) C. 滴定结束后,在滴定管尖嘴处出现气泡 D. 在常温下滴定(未保持在以下滴定) 五、铁及其化合物
-
5. 铁红是颜料,什么什么自古以来使用很多的……(题干缺失)。(1)、赭红的主要成分是_______。A、 B、 C、 D、(2)、饱和氯化铁溶液说法正确的是_______。A、常温显中性 B、加铁粉变红褐色 C、遇沸水后得到胶体 D、加氨水有白色沉淀(3)、有关铁原子说法正确的是_______。(不定项)A、有4个不同能级的电子 B、有5个未成对电子 C、占据15个原子轨道 D、有26种能量不同的电子(4)、加热试管中固体至红热,则_______。(不定项)
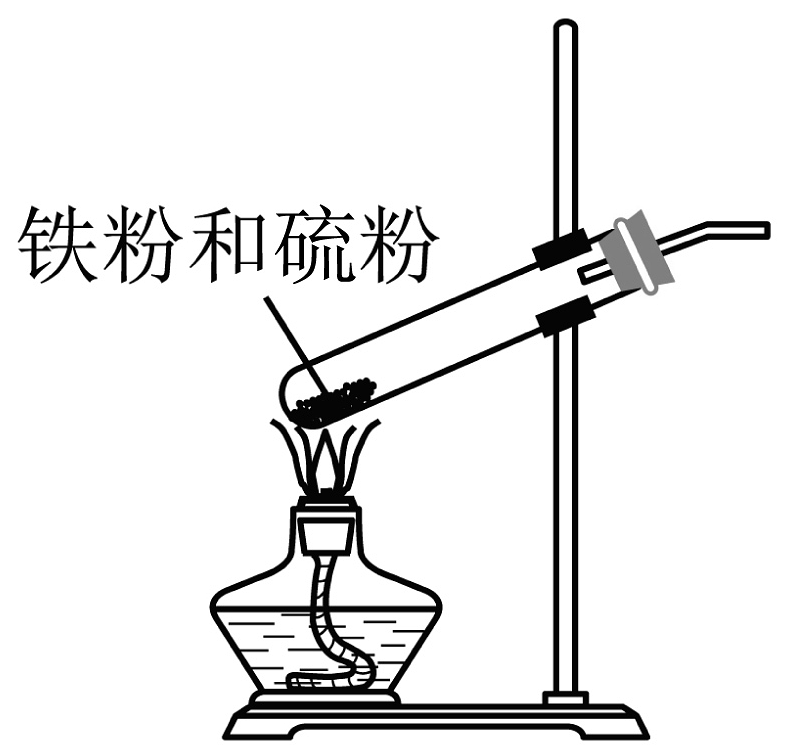 A、移开酒精灯后固体保持红热 B、S只做还原剂 C、主要产生的气体附产物为 D、最终得到黑色的(5)、内界为 , 配体有种(6)、 , 加水稀释至体积为原来的2倍,则。
A、移开酒精灯后固体保持红热 B、S只做还原剂 C、主要产生的气体附产物为 D、最终得到黑色的(5)、内界为 , 配体有种(6)、 , 加水稀释至体积为原来的2倍,则。A.增大 B.不变 C.减小
并用浓度商Q与平衡常数K的大小关系解释原因。
(7)、已知 , 求的分布系数。x
1
2
3
4
K
30.2
134.9
97.72
1.02
-
-
-
-