-
1、某实验小组依据反应:设计如图原电池,探究对氧化性的影响。测得电压与pH的关系如图,下列有关叙述错误的是( )
 A、时,氧化性 B、时盐桥中向右移 C、调节可以改变反应的方向 D、时,正极的电极反应为
A、时,氧化性 B、时盐桥中向右移 C、调节可以改变反应的方向 D、时,正极的电极反应为 -
2、实验装置不能达到实验目的的是( )




A.验证浓硫酸的吸水性
B.提纯乙酸乙酯
C.制取少量碳酸钙
D.制取少量
A、A B、B C、C D、D -
3、为短周期主族元素,的一种同位素具有放射性,可用来断定古生物体死亡的年代。X、Y的某种同位素之间的转化如下:。由组成的双原子分子和Y常见单质分子所含电子数相同。下列说法错误的是( )A、元素非金属性 B、M与其它三种元素均可形成两种或两种以上的二元化合物 C、能组成离子化合物 D、简单氢化物的热稳定性
-
4、催化作用下,发生反应的历程如图所示。下列说法正确的是( )
 A、改变反应途径,提高了单位时间原料转化率 B、反应过程中Mo形成的共价键数目始终保持不变 C、总反应为 D、如果原料为乙二醇,则主要有机产物是乙醛和乙烯
A、改变反应途径,提高了单位时间原料转化率 B、反应过程中Mo形成的共价键数目始终保持不变 C、总反应为 D、如果原料为乙二醇,则主要有机产物是乙醛和乙烯 -
5、碳酸甘油酯为生物基化学品,具有无污染可降解等特性,应用广泛,其中一种合成方法如图所示。下列说法正确的是( )
 A、碳酸丙烯酯分子中碳原子一定共面 B、环氧丙烷生成碳酸丙烯酯的反应是取代反应 C、碳酸甘油酯在水中的溶解性比碳酸丙烯酯强 D、可采用1,2-丙二醇与浓硫酸共热得到纯净的丙烯
A、碳酸丙烯酯分子中碳原子一定共面 B、环氧丙烷生成碳酸丙烯酯的反应是取代反应 C、碳酸甘油酯在水中的溶解性比碳酸丙烯酯强 D、可采用1,2-丙二醇与浓硫酸共热得到纯净的丙烯 -
6、《中国诗词大会》不仅弘扬了中国传统文化,还蕴含着许多化学知识,下列分析正确的是( )A、“爆竹声中一岁除,春风送暖入屠苏”,爆竹的燃放不涉及氧化还原反应 B、绘制“山水画”所用的纸和墨的主要成分都是有机物 C、“日照香炉生紫烟,遥看瀑布挂前川”,“紫烟”指“香炉”中碘升华现象 D、“朝坛雾卷,曙岭烟沉”,雾产生丁达尔效应是胶体粒子对光的散射
-
7、被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。如图为氢氧燃料电池的结构示意图,回答下列问题:
 (1)、进入的电极为极。(2)、电池工作时:溶液中的向(填“正极”或“负极”)迁移,通(填“”或“”)一极的电势较低。(3)、写出电池工作时的负极反应式:。(4)、若电池工作时转移0.01mol电子,理论上消耗标准状态下。(5)、该电池在工作过程中,电解液的pH将(填“不变”、“变大”或“变小”),用该电池电解水,其阴极的电极反应式。(6)、若将此燃料电池改成以和为原料进行工作时,正极极反应式为:。
(1)、进入的电极为极。(2)、电池工作时:溶液中的向(填“正极”或“负极”)迁移,通(填“”或“”)一极的电势较低。(3)、写出电池工作时的负极反应式:。(4)、若电池工作时转移0.01mol电子,理论上消耗标准状态下。(5)、该电池在工作过程中,电解液的pH将(填“不变”、“变大”或“变小”),用该电池电解水,其阴极的电极反应式。(6)、若将此燃料电池改成以和为原料进行工作时,正极极反应式为:。 -
8、水是生命的源泉、工业的血液、城市的命脉。河水是主要的饮用水源,污染物通过饮用水可宵接毒害人体,也可通过食物链和灌溉农田间接危及健康。请回答下列问题:(1)、纯水在100℃时,pH=6,该温度下1mol·L-1的NaOH溶液中,由水电离出的c(OH-)=mol·L-1。(2)、25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为。(3)、体积均为100mLpH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则相同温度时,HX的电离平衡常数(填“大于”或“小于”或“等于”)CH3COOH的电离平衡常数,理由是。
 (4)、电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
(4)、电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:化学式
电离常数(25℃)
HCN
K=4.9×10-10
CH3COOH
K=1.8×10-5
H2CO3
K1=4.3×10-7、K2=5.6×10-11
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三种溶液的pH由大到小的顺序为。
②向NaCN溶液中通入少量的CO2 , 发生反应的化学方程式为。
(5)、25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=mol·L-1(填精确值)。 -
9、甲醇是重要的化工原料,发展前景广阔。研究表明,二氧化碳与氢气反应可以合成甲醇,反应如下:(1)、反应的平衡常数表达式为K=。(2)、有利于提高平衡时转化率的措施有(填字母)。
a.使用催化剂
b.加压
c.增大和的初始投料比
(3)、研究温度对甲醇产率的影响时发现,在210~290℃,保持原料气中和的投料比不变,得到平衡时甲醇的产率与温度的关系如图所示,则该反应的∆H0(填“>”“=”或“<”),依据是。 (4)、电子式 , 分子空间构型 , 属于分子(填极性或非极性)。
(4)、电子式 , 分子空间构型 , 属于分子(填极性或非极性)。 -
10、乙酸俗称醋酸,因是醋的主要成分而得名,是一种重要的化工原料。(1)、纯的无水乙酸常温下是无色液体,低于16.6℃凝结为类似冰一样的晶体,又称为冰醋酸。一定温度下,冰醋酸稀释过程中溶液的导电能力变化如图所示,加水前导电能力接近零的原因是;a、b、c三点对应的溶液中,由大到小的顺序是。
 (2)、t℃时,的 , 0.010mol/L的醋酸溶液中 , pH=。(lg2=0.3)(3)、为了测定某醋酸中的浓度,某学习小组进行了如下实验:取20.00mL待测溶液,用0.1000mol/LNaOH标准溶液滴定。
(2)、t℃时,的 , 0.010mol/L的醋酸溶液中 , pH=。(lg2=0.3)(3)、为了测定某醋酸中的浓度,某学习小组进行了如下实验:取20.00mL待测溶液,用0.1000mol/LNaOH标准溶液滴定。①滴定加入的指示剂应是(选填“甲基橙”或“酚酞”)。滴定终点的颜色变化为。
②滴定操作测得数据记录如下:
测定次数
滴定前读数/mL
滴定后读数/mL
第1次
0.20
20.14
第2次
0.12
19.98
第3次
0.00
18.30
第4次
0.00

的读数如上图所示,则mL,根据以上实验数据,所测醋酸的浓度是mol/L。
③上述实验中,当其它操作正确时,下列操作一定会造成测定结果偏高的是(填字母)。
A.待装NaOH标准溶液的滴定管用蒸馏水洗净后,未用标准溶液润洗
B.锥形瓶用蒸馏水洗净后,直接盛装待测液
C.读取NaOH溶液体积时,开始仰视读数,滴定结束时俯视读数
D.盛NaOH标准溶液的滴定管,滴定前尖嘴部分有气泡,滴定后无气泡
④25℃下,用酸式滴定管量取25.00mL未知浓度的醋酸溶液,放入烧杯中,并放入磁力搅拌子,开启磁力搅拌器,往滴数传感器的滴定管中注入一定量的1.00mol/LNaOH溶液,通过数字化实验,计算机绘制出溶液pH随NaOH溶液体积变化的曲线如图。酸碱刚好完全反应时对应曲线上的点。

-
11、下列装置中能构成原电池产生电流的是( )A、
 B、
B、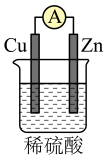 C、
C、 D、
D、
-
12、T℃时,NaCl溶液中c(H+)=1×10-6mol/L 。下列说法正确的是( )A、该NaCl溶液显酸性 B、该NaCl溶液中KW=1×10-12 C、该NaCl溶液中c(OH-)> c(H+) D、该NaCl溶液pH=7
-
13、室温时纯水中存在电离平衡:H2O⇌H++ OH-。下列叙述正确的是( )A、升高温度,水的电离程度增大,c(H+)增大,pH<7,溶液显酸性 B、向水中加入少量氨水,平衡逆向移动,抑制水的电离,c(OH-)降低 C、向水中加入少量硫酸,c(H+)增大,由水电离出的 c(H+)>1×10-7 mol/L D、向水中加入少量 NH4Cl 固体,结合水电离出的 OH- , 由水电离出的c(H+)>1×10-7 mol/L
-
14、氢氰酸(HCN)是一种弱酸,在水溶液中存在电离平衡:HCN⇌H++CN- , 常温下电离常数为Ka。下列说法正确的是( )A、0.1mol/LHCN溶液的pH<1 B、增大HCN溶液浓度,其电离程度减小 C、升高HCN溶液温度,平衡逆向移动 D、加入少量NaOH溶液,会使Ka增大
-
15、过氧化氢是常用的氧化剂,其分子结构如右图所示,两个氢原子犹如分布在半展开的书的两面上。下列关于的判断错误的是( )
 A、电子式为
A、电子式为 B、属于非极性分子
C、分子间存在氢键
D、难溶于四氯化碳
B、属于非极性分子
C、分子间存在氢键
D、难溶于四氯化碳
-
16、下列物质中,属于弱电解质的是( )A、 B、 C、 D、NaOH
-
17、工业上的一氧化碳变换反应为: 。反应达平衡后,下列措施既能提高其反应速率,又能提高CO转化率的是( )A、增大水蒸气浓度 B、增大压强 C、升高温度 D、除去部分
-
18、下列反应中 , 的是( )A、 B、高温下能自发进行的反应: C、 D、任何温度下均能自发进行的反应:
-
19、观察图:对合成氨反应中,下列叙述错误的是( )
 A、开始反应时,正反应速率最大,逆反应速率为零 B、随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大 C、反应到达t1时,正反应速率与逆反应速率相等,反应停止 D、反应在t1之后,正反应速率与逆反应速率相等,反应达到化学平衡状态
A、开始反应时,正反应速率最大,逆反应速率为零 B、随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大 C、反应到达t1时,正反应速率与逆反应速率相等,反应停止 D、反应在t1之后,正反应速率与逆反应速率相等,反应达到化学平衡状态 -
20、下列热化学方程式中,△H能正确表示物质的燃烧热的是( )A、2C8H18(l)+25O2(g)═16CO2(g)+18H2O(l) △H═﹣11003 kJ/mol B、H2(g)+O2(g)═H2O(g) △H═﹣241.8 kJ/mol C、2C(s)+O2(g)═2CO(g) △H═﹣221 kJ/mol D、CO(g)+O2(g)═CO2(g) △H═﹣283.0 kJ/mol