广东省两阳中学2024-2025学年高二下学期5月月考化学试题
试卷更新日期:2025-05-19 类型:月考试卷
一、选择题(本大题共16小题,1-10小题,每题2分,11-16小题,每题4分,共44分,每小题只有一个正确选项。)
-
1. 文物凝结了人类智慧的结晶,是历史进步的标志。下列文物所用主要材料属于有机物的是A、
 黄金面具
B、
黄金面具
B、 战国初期竹木简牍
C、
战国初期竹木简牍
C、 曲阳石雕
D、
曲阳石雕
D、 葫芦纹彩陶壶
2. 我国力争2030年前实现碳达峰,2060年前实现碳中和,这体现了中国对解决气候问题的大国担当。在实际生产中,可利用反应来捕捉废气中的 , 下列有关化学用语表示正确的是A、的分子结构模型:
葫芦纹彩陶壶
2. 我国力争2030年前实现碳达峰,2060年前实现碳中和,这体现了中国对解决气候问题的大国担当。在实际生产中,可利用反应来捕捉废气中的 , 下列有关化学用语表示正确的是A、的分子结构模型: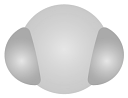 B、键电子云轮廓图
B、键电子云轮廓图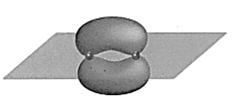 C、的电子式:
C、的电子式: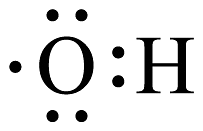 D、的电子排布式:
3. 化学处处呈现美,下列说法不正确的是A、舞台上干冰升华时,共价键断裂 B、与18-冠-6的空腔大小相近,形成稳定的超分子结构(
D、的电子排布式:
3. 化学处处呈现美,下列说法不正确的是A、舞台上干冰升华时,共价键断裂 B、与18-冠-6的空腔大小相近,形成稳定的超分子结构( ),这体现出超分子的分子识别特征
C、缺角的晶体在饱和溶液中变为完美立方体块,体现晶体的自范性
D、雪花是天空中的水汽经凝华而来的一种晶体,其六角形形状与氢键的方向性有关
4. 吸湿性强,常被用作气体和液体的干燥剂,它甚至可以使硝酸脱水:。下列说法正确的是A、第一电离能:N<P B、电负性:N<P C、离子半径: D、沸点:5. 下列关于物质的结构(或性质)及解释均正确的是
),这体现出超分子的分子识别特征
C、缺角的晶体在饱和溶液中变为完美立方体块,体现晶体的自范性
D、雪花是天空中的水汽经凝华而来的一种晶体,其六角形形状与氢键的方向性有关
4. 吸湿性强,常被用作气体和液体的干燥剂,它甚至可以使硝酸脱水:。下列说法正确的是A、第一电离能:N<P B、电负性:N<P C、离子半径: D、沸点:5. 下列关于物质的结构(或性质)及解释均正确的是选项
物质的结构(或性质)
解释
A
键角:
水分子中O上孤电子对数比氨分子中N上的多
B
稳定性:
HF分子间氢键强于HCl分子间作用力
C
熔点:碳化硅>金刚石
键的键能大于键的键能
D
在中的溶解度比在水中的大
和都是非极性分子,是极性分子
A、A B、B C、C D、D6. 下列有机物命名正确的是A、3,3-二甲基-2-乙基戊烷 B、3,3-二甲基戊烷 C、2-甲基-3-丁烯 D、1,5-二甲苯7. 维生素C是一种很好的抗氧化剂,适当的补充维生素C可增加中性粒细胞的趋化性和变形能力,提高白细胞的杀菌能力,其分子的结构简式如图所示。下列关于维生素C的叙述错误的是 A、属于烃的衍生物 B、分子中含有3种官能团 C、1mol该物质最多能与2molBr2加成 D、该物质能使酸性KMnO4溶液褪色8. 有机物X为合成光刻胶的一种中间体,其结构简式如图所示。下列有关说法中正确的是
A、属于烃的衍生物 B、分子中含有3种官能团 C、1mol该物质最多能与2molBr2加成 D、该物质能使酸性KMnO4溶液褪色8. 有机物X为合成光刻胶的一种中间体,其结构简式如图所示。下列有关说法中正确的是 A、分子式为 B、1mol该物质中含有4mol碳碳双键 C、在一定条件下该物质能合成有机高分子化合物 D、该物质能使溴水褪色,但不能使酸性高锰酸钾溶液褪色9. 下列实验装置可以达到实验目的的是
A、分子式为 B、1mol该物质中含有4mol碳碳双键 C、在一定条件下该物质能合成有机高分子化合物 D、该物质能使溴水褪色,但不能使酸性高锰酸钾溶液褪色9. 下列实验装置可以达到实验目的的是

A.用酒精萃取碘水中的碘
B.除去乙烷中的乙烯杂质得到纯净的乙烷
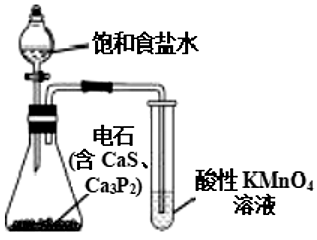

C.验证乙炔具有还原性
D.实验室制硝基苯
A、A B、B C、C D、D10. 甲氧基肉桂酸辛酯是一种化学防晒剂,其分子结构如图。下列说法正确的是 A、分子式为 B、分子中有2种官能团 C、该物质易溶于水 D、分子中有2个手性碳原子11. 如图为几种晶体或晶胞的结构示意图,下列说法错误的是
A、分子式为 B、分子中有2种官能团 C、该物质易溶于水 D、分子中有2个手性碳原子11. 如图为几种晶体或晶胞的结构示意图,下列说法错误的是
 A、晶胞A的化学式是LaNi4 B、在金刚石晶体中,碳原子与碳碳键个数的比为1:2 C、碘单质是分子晶体,碘单质在CCl4中比水中溶解度更大 D、金刚石、MgO、碘单质三种晶体的熔点顺序为:金刚石>MgO>碘单质12. 氟化钾镁是一种具有优良光学性能的材料,主要应用于激光领域,其立方晶胞结构如图。表示阿伏加德罗常数的值。下列说法不正确的是
A、晶胞A的化学式是LaNi4 B、在金刚石晶体中,碳原子与碳碳键个数的比为1:2 C、碘单质是分子晶体,碘单质在CCl4中比水中溶解度更大 D、金刚石、MgO、碘单质三种晶体的熔点顺序为:金刚石>MgO>碘单质12. 氟化钾镁是一种具有优良光学性能的材料,主要应用于激光领域,其立方晶胞结构如图。表示阿伏加德罗常数的值。下列说法不正确的是 A、的配位数为8 B、氟化钾镁晶体的化学式为 C、每个位于距其最近且等距的构成的正八面体空隙中 D、若位于晶胞的体心,则位于晶胞的面心13. 绥阳金银花是贵州特产之一,有抗菌、解热、增强免疫等功效,其所含咖啡酰奎尼酸结构如图所示。下列说法正确的是
A、的配位数为8 B、氟化钾镁晶体的化学式为 C、每个位于距其最近且等距的构成的正八面体空隙中 D、若位于晶胞的体心,则位于晶胞的面心13. 绥阳金银花是贵州特产之一,有抗菌、解热、增强免疫等功效,其所含咖啡酰奎尼酸结构如图所示。下列说法正确的是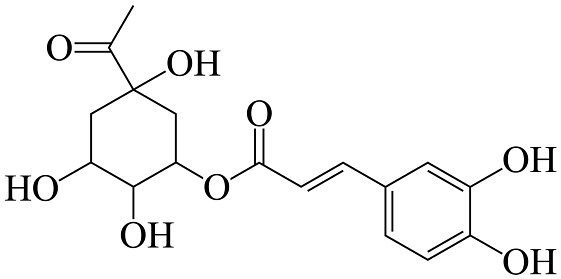 A、分子中所有碳原子有可能在同一平面内 B、1mol该有机物最多与3molNa反应 C、分子中碳原子的杂化类型有sp、sp2、sp3三种 D、该有机物遇氯化铁溶液会发生显色反应,有四个手性碳原子14. 下列实验操作、现象、结论均正确的是
A、分子中所有碳原子有可能在同一平面内 B、1mol该有机物最多与3molNa反应 C、分子中碳原子的杂化类型有sp、sp2、sp3三种 D、该有机物遇氯化铁溶液会发生显色反应,有四个手性碳原子14. 下列实验操作、现象、结论均正确的是实验操作
现象
结论或目的
A
向等体积乙醇与水中分别加入等质量金属钠
都产生具有可燃性的气体
乙醇中羟基H原子与水中H原子的活性一样
B
将光亮的铜丝在酒精灯火焰上加热,立即伸入无水乙醇中
铜丝先变黑后恢复成原来的颜色
乙醇被氧化,铜作氧化剂
C
常温下,将二氧化碳通入苯酚钠溶液
溶液变浑浊
制得苯酚,同时生成碳酸氢钠
D
将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,再滴加AgNO3溶液
产生淡黄色沉淀
检验溴乙烷中的溴元素
A、A B、B C、C D、D15. 环辛四烯 、立方烷
、立方烷 、苯乙烯
、苯乙烯 分子式均为C8H8 , 下列对这三种化合物的叙述中正确的是 A、环辛四烯的七氯代物有2种 B、苯乙烯最多能与1molH2发生加成反应 C、三者均属于不饱和烃 D、苯乙烯中的所有碳原子可能共平面16. 某届奥运会上,有个别运动员因服用兴奋剂被取消参赛资格。如图是检测出兴奋剂的某种同系物X的结构,下列关于X的说法正确的是
分子式均为C8H8 , 下列对这三种化合物的叙述中正确的是 A、环辛四烯的七氯代物有2种 B、苯乙烯最多能与1molH2发生加成反应 C、三者均属于不饱和烃 D、苯乙烯中的所有碳原子可能共平面16. 某届奥运会上,有个别运动员因服用兴奋剂被取消参赛资格。如图是检测出兴奋剂的某种同系物X的结构,下列关于X的说法正确的是 A、1molX与NaOH溶液反应最多消耗4molNaOH B、X能使酸性KMnO4溶液褪色,可证明其分子中含有碳碳双键 C、1molX与足量的饱和溴水反应,最多消耗4molBr2 D、1molX与足量H2反应最多消耗6molH2
A、1molX与NaOH溶液反应最多消耗4molNaOH B、X能使酸性KMnO4溶液褪色,可证明其分子中含有碳碳双键 C、1molX与足量的饱和溴水反应,最多消耗4molBr2 D、1molX与足量H2反应最多消耗6molH2二、非选择题(本大题共4小题,共56分。)
-
17.
实验小组探究卤代烃的性质。
实验1:取一支试管,滴入15滴1−溴丁烷,加入1mL5%的NaOH溶液,振荡后放入盛有热水的烧杯中水浴加热。为证明1−溴丁烷在NaOH水溶液中能否发生取代反应,同学们提出可以通过检验产物中是否存在溴离子来确定。
(1)甲同学进行如下操作:将1−溴丁烷与NaOH溶液混合后充分振荡,加热,取反应后的上层清液,加硝酸银溶液来进行溴离子的检验。①1−溴丁烷在NaOH水溶液中反应的方程式。
②乙同学认为甲同学设计不合理。理由是。于是,乙同学将实验方案补充完整确定了溴离子的生成,乙同学的操作是:取反应后的上层清液,。
(2)丙同学提出质疑:通过检验溴离子不能证明该反应类型为取代反应。理由是。(3)综合上述实验,检测实验1中的生成可判断发生取代反应,实验小组用红外光谱证实了该物质的生成。实验2: 向圆底烧瓶中加入2.0gNaOH和15mL无水乙醇,搅拌,再加入5mL1−溴丁烷和几片碎瓷片,微热,一段时间后,B中酸性高锰酸钾溶液褪色。(加热和夹持装置略去)
 (4)甲同学认为,依据实验2中酸性高锰酸钾溶液褪色,不能判断A中发生了消去反应,理由是。(5)乙同学对实验进行了如下改进(加热和夹持装置略去),依据实验现象可判断是否发生消去反应, 改进后A中物质为。
(4)甲同学认为,依据实验2中酸性高锰酸钾溶液褪色,不能判断A中发生了消去反应,理由是。(5)乙同学对实验进行了如下改进(加热和夹持装置略去),依据实验现象可判断是否发生消去反应, 改进后A中物质为。 18. 有机物a是一种重要的化工原料,其分子式为C5H10 , 结构简式为(H3C)2C=CH—CH3 , 有机物a在一定条件下能发生如图所示的反应,其中b为高分子化合物。
18. 有机物a是一种重要的化工原料,其分子式为C5H10 , 结构简式为(H3C)2C=CH—CH3 , 有机物a在一定条件下能发生如图所示的反应,其中b为高分子化合物。
已知:
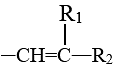 —COOH+
—COOH+ (R1、R2为烃类基团)(1)、a的名称是。(2)、b的结构简式为。(3)、下列关于b的说法正确的是(填标号)。
(R1、R2为烃类基团)(1)、a的名称是。(2)、b的结构简式为。(3)、下列关于b的说法正确的是(填标号)。A.为混合物 B.能使酸性高锰酸钾溶液褪色 C.0.1molb完全燃烧可消耗7.5molO2
(4)、a→d的反应类型为。(5)、有机物a与酸性高锰酸钾溶液反应的有机产物除了H3C-CO-CH3 , 还有。(6)、a的一种同分异构体具有顺反异构,写出其顺式结构:。(7)、已知不对称烯烃加成时氢原子首先加到碳碳双键上含氢较多的碳上:根据信息写出a→c的化学方程式:。19. 铬(Cr)、锰(Mn)、钴(Co)、镍(Ni)等过渡金属元素化合物的应用研究是前沿科学之一,回答下列问题:(1)、基态铬原子的价层电子排布式为。(2)、含铬化合物CrO5中Cr元素化合价为+6价,常温下呈蓝色,则其结构式可能为析。A.
 B.
B. C.
C. (3)、已知金属锰有多种晶型,型锰的面心立方晶胞俯视图符合下列(填序号),每个Mn原子周围紧邻的原子数为。
(3)、已知金属锰有多种晶型,型锰的面心立方晶胞俯视图符合下列(填序号),每个Mn原子周围紧邻的原子数为。A.
 B.
B. C.
C. D.
D. (4)、[Co(DMSO)6](ClO4)2是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为SO(CH3)2 , DMSO中硫原子的杂化轨道类型为 , ClO的空间构型是。(5)、①NiO的晶胞结构如图甲所示,其中离子坐标参数A为(0,0,0),B为1,1,1),则C的离子坐标参数为。
(4)、[Co(DMSO)6](ClO4)2是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为SO(CH3)2 , DMSO中硫原子的杂化轨道类型为 , ClO的空间构型是。(5)、①NiO的晶胞结构如图甲所示,其中离子坐标参数A为(0,0,0),B为1,1,1),则C的离子坐标参数为。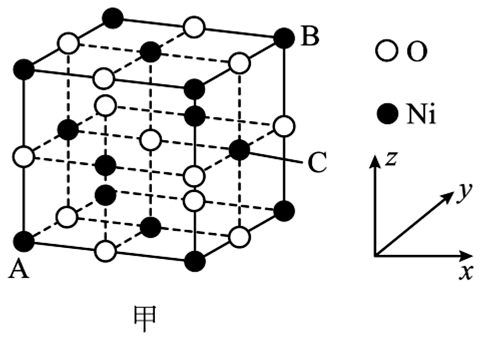
②一定温度下,NiO可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列(O2-之间相切),Ni2+填充其中(如图乙),已知O2-的半径为apm,设阿伏加德罗常数值为NA , 每平方米面积上具有该单分子层的质量为g(用含a、NA的代数式表示)。
 20. 由丙烯经下列反应可得到F和高分子化合物G,它们都是常用的塑料。
20. 由丙烯经下列反应可得到F和高分子化合物G,它们都是常用的塑料。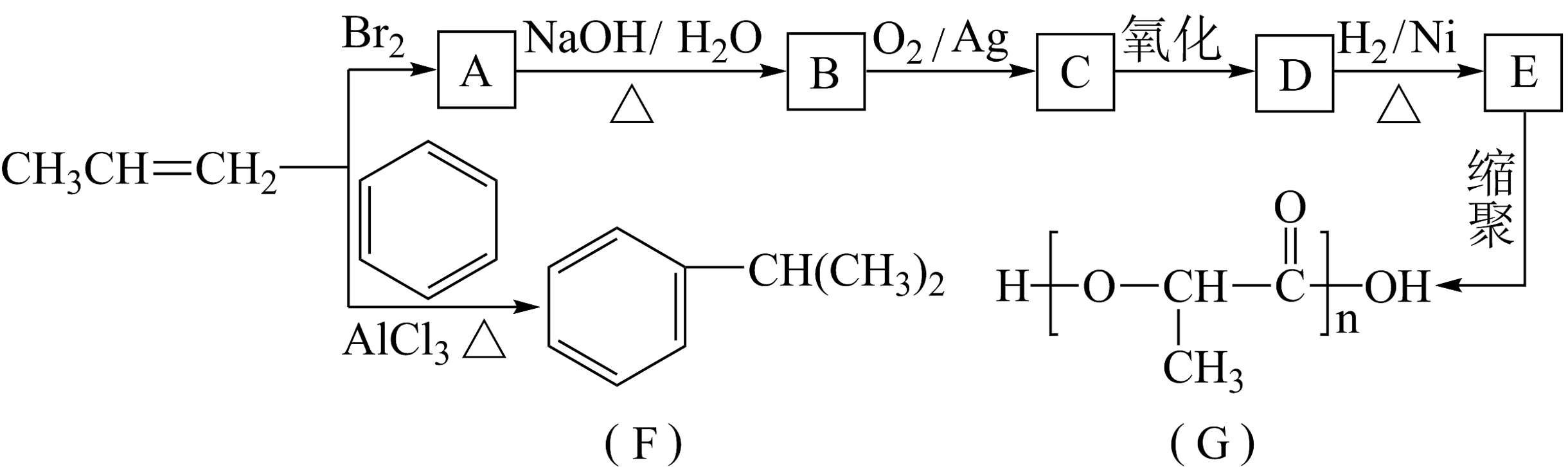 (1)、C中含氧官能团的名称是。(2)、生成F的反应类型:。(3)、B转化为C的化学方程式为。(4)、F的芳香同分异构体有种,其中核磁共振氢谱中显示峰面积比为3:1的同分异构体的结构简式为。(5)、写出由
(1)、C中含氧官能团的名称是。(2)、生成F的反应类型:。(3)、B转化为C的化学方程式为。(4)、F的芳香同分异构体有种,其中核磁共振氢谱中显示峰面积比为3:1的同分异构体的结构简式为。(5)、写出由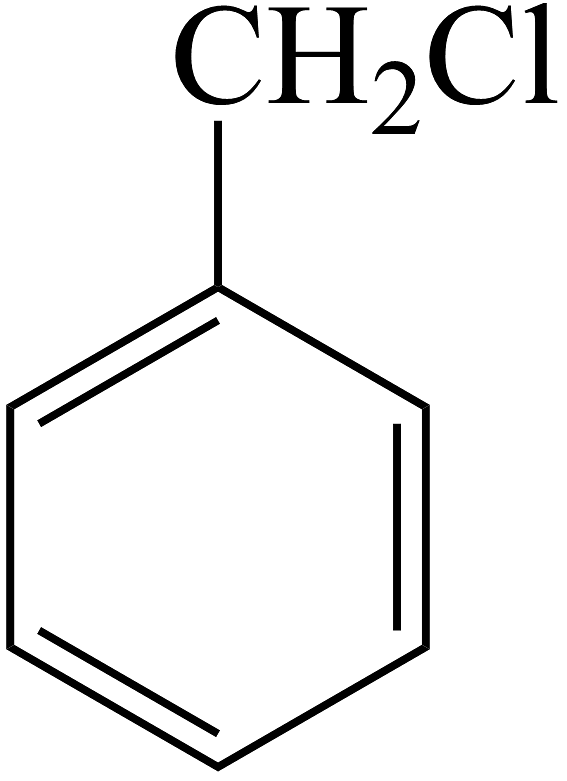 合成
合成 (合成路线常用表示方法为)。
(合成路线常用表示方法为)。