湖南省2025年高考真题化学试卷
试卷更新日期:2025-07-08 类型:高考真卷
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 材料是人类赖以生存和发展的物质基础。下列材料属于金属材料的是( )A、高强韧无磁不锈钢——聚变能实验装置中的低温结构部件 B、金刚石薄膜——“梦想”号大洋钻探船使用的钻头表面涂层 C、超细玄武岩纤维——嫦娥六号携带的月面国旗的纺织材料 D、超细玻璃纤维——国产大飞机中隔音隔热的“飞机棉”2. 化学实验充满着五颜六色的变化。下列描述错误的是( )A、
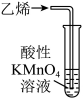
溶液褪色 B、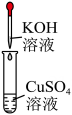
产生红色沉淀 C、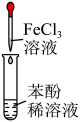
溶液呈紫色 D、
试纸变为蓝色
3. 加热时,浓硫酸与木炭发生反应:。设为阿伏加德罗常数的值。下列说法正确的是( )A、含质子数为 B、常温常压下,含σ键数目为 C、的稀硫酸中含数目为 D、与充分反应得到的分子数为4. 只用一种试剂,将四种物质的溶液区分开,这种试剂是( )A、溶液 B、溶液 C、溶液 D、溶液5. 下列有关物质性质的解释错误的是( )性质
解释
A
酸性:
是推电子基团
B
熔点:
的体积大于;
C
熔点:
比的金属性弱
D
沸点:
分子间存在氢键
A、A B、B C、C D、D6. 浓溶液中含有的具有酸性,能溶解金属氧化物。元素X、Y、Z、M的原子序数依次增大,分别位于不同的前四周期。Y的最外层电子数是内层的3倍,X和Y的最外层电子数之和等于Z的最外层电子数,M的价层电子排布是。下列说法正确的是( )
A、电负性: B、Y形成的两种单质均为非极性分子 C、由X、Y、Z形成的化合物均为强电解质 D、铁管上镶嵌M,铁管不易被腐蚀7. 掺杂的铋酸钡具有超导性。替代部分形成(摩尔质量为),其晶胞结构如图所示。该立方晶胞的参数为 , 设为阿伏加德罗常数的值。下列说法正确的是( )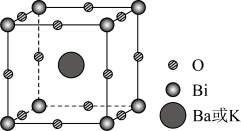 A、晶体中与铋离子最近且距离相等的有6个 B、晶胞中含有的铋离子个数为8 C、第一电离能: D、晶体的密度为8. 是一种合成聚酯的催化剂,可用“硝酸钠法”制备,反应方程式为。下列说法错误的是( )A、中元素的化合价为 B、的空间结构为平面三角形 C、反应中氧化剂和还原剂的物质的量之比为 D、反应中消耗 , 转移9. 一种电化学处理硝酸盐产氨的工作原理如图所示。下列说法错误的是( )
A、晶体中与铋离子最近且距离相等的有6个 B、晶胞中含有的铋离子个数为8 C、第一电离能: D、晶体的密度为8. 是一种合成聚酯的催化剂,可用“硝酸钠法”制备,反应方程式为。下列说法错误的是( )A、中元素的化合价为 B、的空间结构为平面三角形 C、反应中氧化剂和还原剂的物质的量之比为 D、反应中消耗 , 转移9. 一种电化学处理硝酸盐产氨的工作原理如图所示。下列说法错误的是( )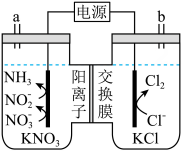 A、电解过程中,向左室迁移 B、电解过程中,左室中的浓度持续下降 C、用湿润的蓝色石蕊试纸置于b处,试纸先变红后褪色 D、完全转化为的电解总反应:10. 天冬氨酸广泛应用于医药、食品和化工等领域。天冬氨酸的一条合成路线如下:
A、电解过程中,向左室迁移 B、电解过程中,左室中的浓度持续下降 C、用湿润的蓝色石蕊试纸置于b处,试纸先变红后褪色 D、完全转化为的电解总反应:10. 天冬氨酸广泛应用于医药、食品和化工等领域。天冬氨酸的一条合成路线如下: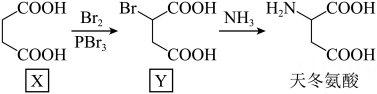
下列说法正确的是( )
A、X的核磁共振氢谱有4组峰 B、与水溶液反应,最多可消耗 C、天冬氨酸是两性化合物,能与酸、碱反应生成盐 D、天冬氨酸通过加聚反应可合成聚天冬氨酸11. 具有还原性,易水解。一种制备纯净的的装置示意图如下: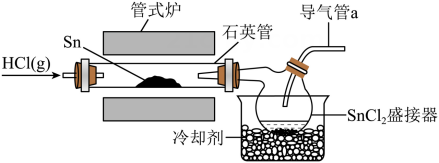
下列说法错误的是( )
A、导气管a需接一个装有碱石灰的干燥管 B、实验过程中应先通入 , 再开启管式炉加热 C、若通入气体更换为 , 也可制备纯净的 D、配制溶液需加盐酸和金属12. 工业废料的综合处理有利于减少环境污染并实现资源循环利用。从某工业废料中回收镉、锰的部分工艺流程如下: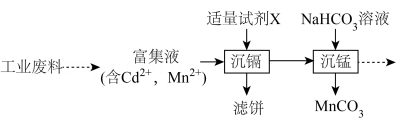
已知:①富集液中两种金属离子浓度相当。
②常温下,金属化合物的;
金属化合物
下列说法错误的是( )
A、粉碎工业废料有利于提高金属元素的浸出率 B、试剂X可以是溶液 C、“沉镉”和“沉锰”的顺序不能对换 D、“沉锰”时,发生反应的离子方程式为13. 草酸广泛应用于食品、药品等领域。常温下,通过下列实验探究了草酸的性质:实验1:向溶液中滴入一定量溶液。混合溶液的与的关系如图所示。
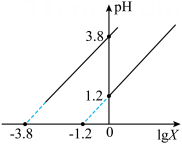
实验2:向溶液中加入溶液。
已知:时,。混合后溶液体积变化忽略不计。
下列说法错误的是( )
A、实验1,当溶液中时, B、实验1,当溶液呈中性时: C、实验2,溶液中有沉淀生成 D、实验2,溶液中存在:14. 环氧化合物是重要的有机合成中间体。以钛掺杂沸石为催化剂,由丙烯(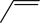 )为原料生产环氧丙烷(
)为原料生产环氧丙烷(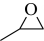 )的反应机理如图所示。下列说法正确的是( )
)的反应机理如图所示。下列说法正确的是( )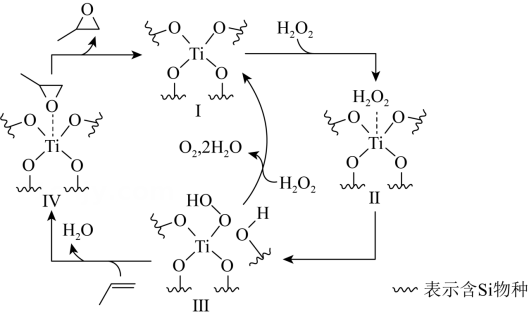 A、过程中Ⅱ是催化剂 B、过程中有极性键和非极性键的断裂和形成 C、过程中元素的化合价发生了变化 D、丙烯与双氧水反应生成环氧丙烷的原子利用率为100%
A、过程中Ⅱ是催化剂 B、过程中有极性键和非极性键的断裂和形成 C、过程中元素的化合价发生了变化 D、丙烯与双氧水反应生成环氧丙烷的原子利用率为100%二、非选择题:本题共4小题,共58分。
-
15. 苯胺是重要的有机化工原料,其实验室制备原理如下:
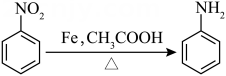
相关信息如下:
物质
相对分子质量
熔点/℃
沸点/℃
密度/
溶解性
硝基苯
123
5.9
210.9
1.20
不溶于水,易溶于乙醚
苯胺
93
184.0
1.02
微溶于水,易溶于乙醚
乙酸
60
16.6
117.9
1.05
与水互溶
乙醚
74
34.5
0.71
微溶于水
反应装置Ⅰ和蒸馏装置Ⅱ(加热、夹持等装置略)如下:
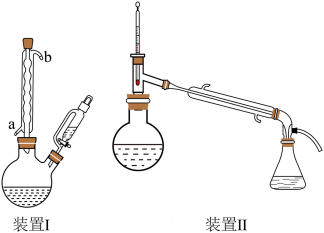
实验步骤为:
①向装置Ⅰ双颈烧瓶中加入铁粉、水及乙酸,加热煮沸;
②稍冷后,通过恒压滴液漏斗缓慢滴入硝基苯 , 再加热回流;
③将装置Ⅰ改成水蒸气蒸馏装置,蒸馏收集苯胺-水馏出液;
④将苯胺-水馏出液用饱和后,转入分液漏斗静置分层,分出有机层;水层用乙醚萃取,分出醚层;合并有机层和醚层,用粒状氢氧化钠干燥,得到苯胺醚溶液;
⑤将苯胺醚溶液加入圆底烧瓶(装置Ⅱ),先蒸馏回收乙醚,再蒸馏收集馏分,得到苯胺。
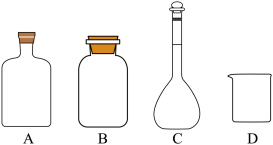
回答下列问题:
(1)、实验室保存硝基苯的玻璃容器是(填标号)。(2)、装置Ⅰ中冷凝管的进水口为(填“a”或“b”)。(3)、步骤④中将苯胺-水馏出液用饱和的原因是。(4)、步骤④中第二次分液,醚层位于层(填“上”或“下”)。(5)、蒸馏回收乙醚时,锥形瓶需冰水浴的原因是;回收乙醚后,需要放出冷凝管中的冷凝水再蒸馏,这样操作的原因是。(6)、下列说法正确的是____(填标号)。A、缓慢滴加硝基苯是为了减小反应速率 B、蒸馏时需加沸石,防止暴沸 C、用红外光谱不能判断苯胺中是否含有硝基苯 D、蒸馏回收乙醚,无需尾气处理(7)、苯胺的产率为。16. 一种从深海多金属结核[主要含 , 有少量的]中分离获得金属资源和电池级镍钻锰混合溶液的工艺流程如下: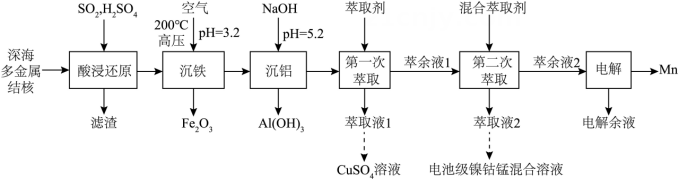
已知:①金属氢氧化物胶体具有吸附性,可吸附金属阳离子。
②常温下,溶液中金属离子(假定浓度均为)开始沉淀和完全沉淀的:
开始沉淀的
1.9
3.3
4.7
6.9
7.4
8.1
完全沉淀的
3.2
4.6
6.7
8.9
9.4
10.1
回答下列问题:
(1)、基态的价层电子排布式为。(2)、“酸浸还原”时,“滤渣”的主要成分是(写化学式);还原的化学方程式为。(3)、“沉铁”时,转化为的离子方程式为 , 加热至的主要原因是。(4)、“沉铝”时,未产生沉淀,该溶液中不超过。(5)、“第二次萃取”时,、(填离子符号)与混合萃取剂形成的配合物(其结构如图所示,M表示金属元素)更稳定,这些配合物中氮原子的杂化类型为。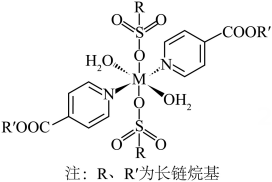 17. 化合物F是治疗实体瘤的潜在药物。F的一条合成路线如下(略去部分试剂和条件):
17. 化合物F是治疗实体瘤的潜在药物。F的一条合成路线如下(略去部分试剂和条件):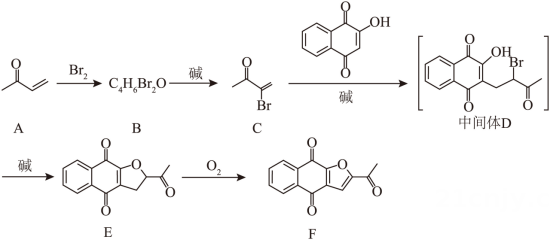
已知:
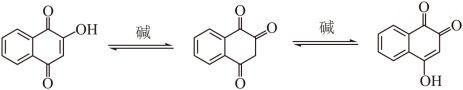
回答下列问题:
(1)、A的官能团名称是、。(2)、B的结构简式是。(3)、E生成F的反应类型是。(4)、F所有的碳原子共面(填“可能”或“不可能”)。(5)、B在生成C的同时,有副产物G生成。已知G是C的同分异构体,且与C的官能团相同。G的结构简式是、(考虑立体异构)。(6)、C与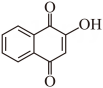 生成E的同时,有少量产物I生成,此时中间体H的结构简式是。
生成E的同时,有少量产物I生成,此时中间体H的结构简式是。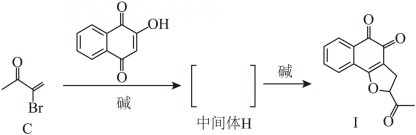 (7)、依据以上流程信息,结合所学知识,设计以
(7)、依据以上流程信息,结合所学知识,设计以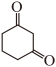 和为原料合成
和为原料合成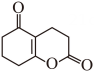 的路线(无机试剂和溶剂任选)。 18. 在温和条件下,将转化为烃类具有重要意义。采用电化学-化学串联催化策略可将高选择性合成 , 该流程示意图如下:
的路线(无机试剂和溶剂任选)。 18. 在温和条件下,将转化为烃类具有重要意义。采用电化学-化学串联催化策略可将高选择性合成 , 该流程示意图如下: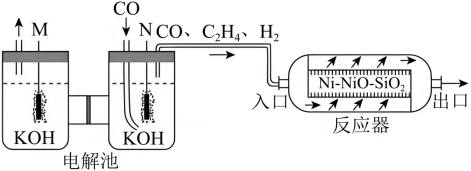
回答下列问题:
(1)、电解池中电极M与电源的极相连。(2)、放电生成的电极反应式为。(3)、在反应器中,发生如下反应:反应i:
反应ii:
计算反应的 , 该反应(填标号)。
A.高温自发 B.低温自发 C.高温低温均自发 D.高温低温均不自发(4)、一定温度下,和(体积比为)按一定流速进入装有催化剂的恒容反应器(入口压强为)发生反应i和ii。有存在时,反应ii的反应进程如图1所示。随着x的增加,的转化率和产物的选择性(选择性)如图2所示。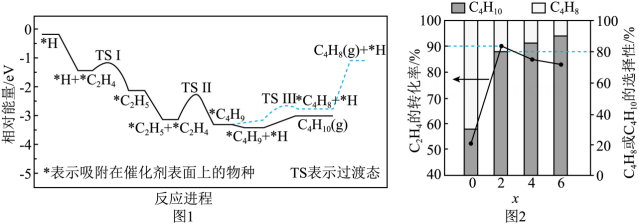
根据图1,写出生成的决速步反应式;的选择性大于的原因是。
②结合图2,当时,混合气体以较低的流速经过恒容反应器时,反应近似达到平衡,随着x的增大,的转化率减小的原因是;当时,该温度下反应ii的(保留两位小数)。0.16