-
1、邻二醇在酸的作用下能转化为酮(或醛),反应的分步机理和协同机理如下:

已知:
①当碳原子上连有推电子基团时,有利于碳正离子(通常指的是价层只有6个电子的碳阳离子,是活性中间体)的稳定。
②2,3-二甲基-2,3-丁二醇与酸反应,对应的中间体和生成物相对能量(kJ/mol)如下:

过渡态1
过渡态2
生成物
分步机理
0.00
30.1
38.3
-82.3
协同机理
0.00
44.0
-
-82.3
③当碳正离子的相邻碳上有两个不同芳基时,迁移的相对速率与芳基的关系如下表:
芳基



相对速率
0.7
1
500
下列说法不正确的是( )
A、酸性条件下,2,3-二甲基-2,3-丁二醇转化为 主要以分步机理进行
B、上述转化过程中酸可提高反应速率,但不影响平衡产率
C、乙二醇在酸性条件下只能通过协同机理生成醛,原因是碳正离子中间体不稳定
D、
主要以分步机理进行
B、上述转化过程中酸可提高反应速率,但不影响平衡产率
C、乙二醇在酸性条件下只能通过协同机理生成醛,原因是碳正离子中间体不稳定
D、 在酸的作用下,产物主要形式为
在酸的作用下,产物主要形式为
-
2、利用下图电池装置可验证不同化合价铁元素的相关性质。

已知:电池装置中,盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(如下表)应尽可能地相近;两烧杯中溶液体积相等。
离子
Li+
Na+
Ca2+
K+
Cl-
4.07
5.19
6.59
7.62
4.61
7.40
7.91
8.27
下列说法正确的是( )
A、根据上表数据,盐桥中应选择KNO3作为电解质 B、石墨电极上对应的电极反应式为: C、反应一段时间后,当右池中时,左池中 D、盐桥中的阴离子进入石墨电极一侧溶液中 -
3、由CO2合成环状碳酸酯的一种反应机理如图所示。

下列说法不正确的是( )
A、转化过程中涉及极性键的断裂与形成 B、根据杂化轨道理论,上述转化过程中的含碳化合物碳原子的杂化方式为sp2和sp3 C、化合物1的阳离子体积大,所含离子键较弱,其常温下可能为液态 D、 可按照该反应机理与CO2反应生成
可按照该反应机理与CO2反应生成
-
4、X、Y、Z、M、Q五种短周期主族元素,原子序数依次增大。X、Y、Z位于同一周期,且互不相邻,三者的最外层电子数之和为15,基态Y原子的价电子层中有3个未成对电子,Z与Q同主族,M原子在同周期中原子半径最大,下列说法不正确的是( )A、化学键中离子键成分的百分数:MZ>MQ B、键角:XZ3<YQ3 C、Z、M、Q原子形成稀有气体电子构型的简单离子的半径:M<Z<Q D、最高价氧化物对应水化物的酸性:X<Y
-
5、抗坏血酸(X)能被氧化为脱氢抗坏血酸(Y)而发挥抗氧化作用,下列说法不正确的是( )
 A、X可溶于水 B、X与NaOH醇溶液共热发生消去反应 C、X和Y中均含有两个手性碳原子 D、X和Y均能与金属钠反应产生氢气
A、X可溶于水 B、X与NaOH醇溶液共热发生消去反应 C、X和Y中均含有两个手性碳原子 D、X和Y均能与金属钠反应产生氢气 -
6、浩瀚的海洋中蕴藏着丰富的资源,其中海水提溴工艺流程如下所示:

下列说法中不正确的是( )
A、吹出塔中利用了溴单质的挥发性将溴分离出来 B、吸收塔中Br2与SO2发生反应以达到富集目的 C、蒸馏塔中利用物质沸点不同进行分离 D、吸收时可用Fe2(SO4)3溶液代替SO2和水 -
7、下列化学反应与方程式相符的是( )A、氢氧化钠溶液中加入过量草酸: B、碱性条件下,氢氧化铁与次氯酸钠溶液反应制备高铁酸钠: C、工业制取高纯硅: D、尿素与甲醛反应生成某线型脲醛树脂:

-
8、下列实验装置能用于相应实验的是( )


A.分离酒精和水
B.浓硫酸和铜片反应制SO2


C.验证丙烯醛(CH2=CHCHO)中有碳碳双键
D.铁制镀件镀铜
A、A B、B C、C D、D -
9、下列说法不正确的是( )A、淀粉、纤维素、麦芽糖在一定条件下都可转化为葡萄糖 B、单一波长的X射线通过水晶粉末时,记录仪上会产生明锐的衍射峰 C、通过核磁共振氢谱(1H-NMR)不能鉴别HCOOCH3和CH3COOH D、在鸡蛋清溶液中,加入硫酸铜溶液,蛋白质会发生变性
-
10、根据物质的组成和结构变化可推测其性能变化,下列推测不合理的是( )
物质
组成和结构变化
性能变化
A
铅晶体
将晶体颗粒粉碎至小于200纳米
熔点变高
B
普通玻璃
加入硼酸盐烧制
耐化学腐蚀,耐温度急剧变化
C
布洛芬
将分子结构进行成酯修饰
减少药物对胃、肠道的刺激
D
植物油
催化加氢
抗氧化性增强,便于储运
A、A B、B C、C D、D -
11、酸性条件下Na2S和Na2SO3发生反应: , 下列说法不正确的是(设为阿伏加德罗常数的值)( )A、生成24gS转移电子的数目为 B、Na2S是还原剂,发生氧化反应 C、Na2SO4是氧化产物 D、碱性条件下S2-和可以大量共存
-
12、下列表示不正确的是( )A、质子数为92、中子数为146的U原子: B、HClO的电子式:
 C、
C、 的名称:2,2,4-三甲基己烷
D、H2S的价层电子对互斥(VSEPR)模型:
的名称:2,2,4-三甲基己烷
D、H2S的价层电子对互斥(VSEPR)模型:
-
13、工业上常用NaOH溶液吸收NO2 , 发生反应: , 下列说法不正确的是( )A、NaNO3是强电解质 B、NaNO2有毒,不可用于食品添加剂 C、N元素位于元素周期表p区 D、NaNO2溶液中通入O2 , 溶液pH降低
-
14、材料是人类赖以生存和发展的物质基础,下列材料主要成分不属于新型无机非金属材料的是( )A、水泥 B、石英光导纤维 C、氮化铝陶瓷 D、石墨烯
-
15、M为治疗偏头痛的药物主要成分,其合成路线如下:

已知:
I. II.
 (1)、有机物A的官能团名称为。(2)、有机物D的结构简式为。(3)、下列说法正确的是____。A、化合物C可以发生加成,取代反应 B、D到E的过程中KOH的作用是做催化剂 C、化合物M的分子式是 D、化合物G与氢气完全加成后有两个手性碳原子(4)、写出E→F的化学方程式。(5)、结合上述信息,写出以苯甲醇为原料,选择合适的试剂制备
(1)、有机物A的官能团名称为。(2)、有机物D的结构简式为。(3)、下列说法正确的是____。A、化合物C可以发生加成,取代反应 B、D到E的过程中KOH的作用是做催化剂 C、化合物M的分子式是 D、化合物G与氢气完全加成后有两个手性碳原子(4)、写出E→F的化学方程式。(5)、结合上述信息,写出以苯甲醇为原料,选择合适的试剂制备 的合成路线。(无机试剂任选) (6)、写出化合物C同时符合下列条件的同分异构体的结构简式
的合成路线。(无机试剂任选) (6)、写出化合物C同时符合下列条件的同分异构体的结构简式①分子中含有一个苯环;②核磁共振氢谱和红外光谱表明,分子中共有4种不同化学环境的氢原子,且峰面积比为6:2:2:2,只有一个-NO2。
-
16、清凉茶酸乙酯()是一种消毒杀菌剂,对细菌霉菌等有灭活作用。通过酯化反应制备清凉茶酸乙酯的方法如下,实验装置(部分夹持装置省略)如图所示。
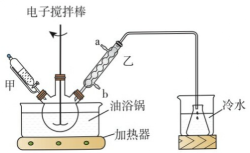
Ⅰ.在三颈烧瓶中加入5.6g清凉茶酸,4.6g乙醇,环己烷,少量浓硫酸等。
Ⅱ.油浴加热,控制温度为110℃,并不断搅拌,一段时间之后停止加热和搅拌。
Ⅲ.反应混合物冷却至室温,进行操作X
Ⅳ.在滤液中加入5%的小苏打溶液,洗涤,至混合液pH=7左右,再用蒸馏水洗涤。
V.将洗涤后混合液加入分液漏斗,进行分液。
Ⅵ.在分液后的有机层加入干燥剂,振荡,静置,过滤。
Ⅶ.对滤液进行蒸馏,收集一定温度的馏分,得到5.4mL纯净的清凉茶酸乙酯。
已知部分物质的性质如下:
沸点/℃
密度/(g·cm-3)
水溶性
备注
乙醇
78
0.789
混溶
清凉茶酸
228
1.204
易溶
清凉茶酸乙酯
195
0.926
难溶
环己烷
80.7
0.780
难溶
挥发过程中可带出较多的水
(1)、仪器甲的名称为(2)、写出实验中三颈烧瓶中发生的主要反应 , 其中环己烷的作用是。(3)、加热搅拌过程中忘加沸石,正确的操作是。(4)、下列有关该实验过程,正确的是____。A、乙中的进水口为a B、操作X使用的玻璃仪器有玻璃棒,漏斗,烧杯 C、加入小苏打是为了中和混合物中的酸性物质 D、分液后的有机层加入碱石灰干燥(5)、计算该制备实验的产率:(保留三位有效数字)。 -
17、NOx是大气主要污染物。有效去除大气中的NOx是环境保护的重要课题。
已知:的反应过程分为两步:
第一步:
第二步:
(1)、一定温度下,反应的平衡常数表达式是(用 , , , 表示)。(2)、将H2、NO、O2按体积之比为3:2:1充入恒温恒压(200℃,100Kpa)容器中,发生反应。达到平衡时,N2的体积分数为0.1。①平衡时,NO的转化率为 , 平衡常数=(以平衡分压表示,平衡分压=平衡时总压×平衡时的物质的量分数)。
②已知该反应ΔH<0,初始温度、压强和反应物的用量均相同,下列四种容器中NO的转化率最高的是。( )
A.恒温恒容容器 B.恒温恒压容器
C.恒容绝热容器 D.恒压绝热容器
③该反应需选择合适的催化剂进行,分别选用A,B,C三种不同的催化剂进行实验,所得结果如图所示(其它条件相同),则实际生产中适宜选择的催化剂是 , 理由为。
 (3)、用稀硝酸可以吸收NOx得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的反应式。
(3)、用稀硝酸可以吸收NOx得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的反应式。 -
18、氨气的用途非常广泛,下列是氨气的部分转化关系图。
 (1)、混合物A的成分为(用化学式表示)。(2)、N2H4又称联氨,为二元弱碱,不如氨气稳定。
(1)、混合物A的成分为(用化学式表示)。(2)、N2H4又称联氨,为二元弱碱,不如氨气稳定。①从分子结构角度分析,N2H4不如氨气稳定的原因是。
②N2H4在水中的电离与氨相似;25℃时,N2H4第一步电离平衡常数的值为。
(已知: )
(3)、NH3在无水环境下与CO2反应生成化合物B(不稳定),继续与NH3反应生成C。已知化合物C中含有铵根离子,可完全水解,其水解产物有NH4HCO3 , 下列说法正确的是____。A、化合物B的化学式为NH2COOH B、化合物B属于氨基酸 C、化合物C水解生成两种盐 D、化合物C可用于制备尿素(4)、实验中在加热条件下,通入过量的NH3与CuO反应,请设计实验验证尾气中比较活泼的两种气体。 -
19、硫及其化合物在生活、生产中有着广泛的应用。

图1
(1)、基态硫原子的价层电子轨道表示式是。(2)、S单质的常见形式为S8 , 其环状结构如图1所示,其中S原子的杂化方式是。(3)、下列说法正确的是____A、H2S分子的空间构形是直线型 B、六氟化硫(SF6)中心原子的杂化方式为sp3d2 C、第一电离能大小顺序F>O>S D、工业生产硫酸时用水吸收SO3(4)、大π键可用符号π表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则SO3中的大π键可表示为。(5)、黄铜矿为含硫矿石,这种矿石浑身都是宝。黄铜矿的晶胞如图2所示,原子1的坐标为与Cu(0,0,0)最近的Fe原子的坐标为;若阿伏加德罗常数的值为NA , 则黄铜矿晶体的密度是g⋅cm-3。
图2
-
20、下列实验操作及其现象、结论都正确的是( )
实验操作
现象
结论
A
将少量乙二醇滴入酸性KMnO4溶液中
溶液紫色变浅
乙二醇被氧化成乙二酸
B
用电导仪测定碱性条件下乙酸乙酯水解反应中导电能力的变化(溶液温度不变)
随着反应进行,
溶液的导电能力逐渐下降
相同浓度的OH-导电能力强于CH3COO-
C
用洁净的玻璃棒蘸取某无色溶液,在酒精灯上灼烧
火焰出现黄色
溶液中含有Na元素
D
用pH计测定浓度为0.1mol·L-1的NaHCO3溶液与CH3COOH溶液
NaHCO3的pH值小于CH3COOH的pH值
A、A B、B C、C D、D