-
1、设代表阿伏加德罗常数的数值,下列说法正确的是( )A、标准状况下,2.24L乙醇含非极性键数为 B、1L 1mol/L的溶液中含有的数目为 C、常温下,2g中所含中子数目为 D、标准状况下,22.4L NO与足量充分反应,所得混合气中分子数为
-
2、某同学在培养皿上做如下实验(如图所示),a、b、c、d是浸有相关溶液的滤纸。向晶体上滴加一滴浓盐酸后,立即用另一培养皿扣在上面。

下列对实验现象的“解释或结论”描述,不正确的是( )
选项
实验现象
解释或结论
A
a处试纸变蓝
还原性:
B
b处试纸变红
C
c处试纸褪色
与反应生成了具有漂白性的物质
D
d处红色褪去
和反应使溶液呈中性
A、A B、B C、C D、D -
3、部分硫元素或铁元素的“价—类”关系如图所示。下列叙述正确的是( )
 A、1mol d与足量a充分反应转移电子数为 B、g常用作涂料的红色颜料 C、含2mol i的溶液最多吸收1mol b D、常用d容器盛装c的浓溶液,因为d和c的浓溶液不反应
A、1mol d与足量a充分反应转移电子数为 B、g常用作涂料的红色颜料 C、含2mol i的溶液最多吸收1mol b D、常用d容器盛装c的浓溶液,因为d和c的浓溶液不反应 -
4、《本草纲目》记载,穿心莲有清热解毒、凉血、消肿、燥湿的功效。穿心莲内酯结构式如图所示。下列有关该物质说法不正确的是( )
 A、含有3种官能团 B、不能使溴水、酸性高锰酸钾溶液褪色 C、能发生加成反应、氧化反应、消去反应和聚合反应 D、1mol该物质分别与足量的Na、反应,消耗二者的物质的量之比为
A、含有3种官能团 B、不能使溴水、酸性高锰酸钾溶液褪色 C、能发生加成反应、氧化反应、消去反应和聚合反应 D、1mol该物质分别与足量的Na、反应,消耗二者的物质的量之比为 -
5、如图所示的新型电池可以处理含的碱性废水,同时还能淡化海水。下列说法不正确的是( )
 A、电子由a极经导线流向b极 B、电池工作一段时间后,右室溶液的pH增大 C、交换膜Ⅰ为阳离子交换膜,交换膜Ⅱ为阴离子交换膜 D、b极发生还原反应
A、电子由a极经导线流向b极 B、电池工作一段时间后,右室溶液的pH增大 C、交换膜Ⅰ为阳离子交换膜,交换膜Ⅱ为阴离子交换膜 D、b极发生还原反应 -
6、劳动创造美好生活。下列生活、生产活动中,没有运用相应化学原理的是( )
选项
生活、生产活动
化学原理
A
施肥时草木灰和铵态氮肥不能混合使用
溶液与铵盐发生双水解
B
葡萄糖与银氨溶液制银镜
葡萄糖具有还原性
C
液氨常用作制冷剂
液氨汽化时吸收大量的热
D
漂白粉漂白有色物质放置一段时间后效果更好
酸性强于
A、A B、B C、C D、D -
7、下列实验方案能达到实验目的的是( )
 A、甲可制取无水 B、乙可验证金属性: C、丙可验证非金属性: D、丁可探究压强对平衡的影响
A、甲可制取无水 B、乙可验证金属性: C、丙可验证非金属性: D、丁可探究压强对平衡的影响 -
8、化学无处不在,下列有关说法正确的是( )A、淀粉、纤维素、油脂均属于天然高分子 B、炒菜后铁锅不及时清理容易生锈,因为潮湿环境中铁锅发生析氢腐蚀 C、打开汽水瓶盖有大量气泡冒出,可用勒夏特列原理解释 D、向鸡蛋清溶液中加入食盐浓溶液有白色沉淀析出,因为食盐能使蛋白质变性
-
9、下列化学用语或图示表达正确的是( )A、CO2的电子式为:
 B、基态锗原子的简化电子排布式:
C、的空间结构为
B、基态锗原子的简化电子排布式:
C、的空间结构为 D、铝原子最高能级的电子云轮廓图:
D、铝原子最高能级的电子云轮廓图:
-
10、百年变局,科技创新是“关键变量”。下列说法不正确的是( )A、手机芯片的主要成分硅属于共价晶体 B、C919大飞机的燃料煤油属于混合物 C、新能源汽车的锂电池充电时将化学能转化为电能 D、奋斗者号潜水器使用钛合金外壳利用了合金的高强度特点
-
11、韶博文物展现了韶州地区的整体社会生活风貌。下列文物主要材料不属于硅酸盐的是( )




A.明编织纹铜盖豆
B.东晋陶谷仓
C.东晋青黄釉瓷钵
D.清款粉彩龙凤纹赏瓶
A、A B、B C、C D、D -
12、Darunavir(Prezista)是抗击新型冠状病毒潜在用药,其合成路线如下:

已知:①为叔丁氧羰基(
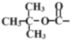 );为—碘代丁二酰亚胺(
);为—碘代丁二酰亚胺( )
):甲基;:乙基;:苯环
②
③
 , 能把酮还原到醇
, 能把酮还原到醇请回答:
(1)、化合物B的所含官能团名称是。(2)、下列说法不正确的是____。A、1mol化合物E最多能消耗的物质的量为1mol B、D→E的转变过程中会释放出 , 其中反应①②依次为:还原反应、取代反应 C、F的分子式可能为: D、F→G转化过程,反应②中试剂的作用为催化剂(3)、化合物C的结构简式是。(4)、写出E转变成G过程中,反应①的化学方程式。(5)、利用题给中的相关信息,完善以H为原料制备I的路线(用流程图表示,无机试剂任选) (6)、写出同时符合下列条件的化合物D的2种同分异构体的结构简式。
(6)、写出同时符合下列条件的化合物D的2种同分异构体的结构简式。①分子中含有两个环,其中一个为吡啶环(
 ),另外一个为含两个氮的五元杂环(已知:碳碳三键在五元环中不稳定)
),另外一个为含两个氮的五元杂环(已知:碳碳三键在五元环中不稳定)②谱检测表明:分子中共有5种不同化学环境的氢原子。
-
13、氢化钙可作为轻便的氢气发生剂,也可用作还原剂、干燥剂。某兴趣小组拟选用如下装置制备氢化钙。

请回答:
(1)、请从图1中选择必要的装置,按气流方向连接顺序为。(填仪器接口的字母编号,装置不可重复使用)→ , →d,→ , k→
(2)、利用所选装置进行实验,步骤如下:①检查装置气密性后,装入药品;②打开启普发生器活塞;____(请按正确的顺序填入下列步骤的标号)。A、加热反应一段时间 B、收集气体并检验其纯度 C、关闭启普发生器活塞 D、停止加热,充分冷却(3)、为验证实验确有生成。某同学取少量产物,小心加入水中,并滴加酚酞,观察到有气泡生成,加入酚酞后溶液显红色,该同学据此推断有生成。该同学的推断不正确,原因是。(4)、某同学利用图2装置测定氢化钙产品含量。他称取所制得的氢化钙样品(假设唯一杂质是钙),实验前后量气管中液面读数分别为、。(上述气体体积均已换算为标准状况下)
①装置中导管a的作用是 , 。
②氢化钙样品的纯度为%。
-
14、I.电解法可处理氯化钙废同时,吸收CO2 , 装置如图所示。(1)、阴极室发生的变化可视为两步,电极反应式:和。(2)、II.工业含硫烟气污染大气,研究烟气脱硫具有重要意义。
方法一、H2还原脱硫:
300℃,发生反应:①
②
③
请用一个等式来表示三个反应的之间的关系。
(3)、反应③,在恒温、恒容的密闭容器中,充入和 , 平衡常数 , 测得平衡时和的浓度均为 , 则平衡时的值为。(4)、方法二、O2氧化脱硫:某同学探究活性炭吸附催化氧化 , 以N2作稀释剂,一定温度下,通入、和反应生成 , 其中不同温度下,在活性炭上的吸附情况如图,下列说法正确的是____。
 A、温度越低,SO2的吸附量越高,SO2氧化反应速率越快 B、已知:SO2的物理吸附过程能自发进行,可推断该过程是熵减、放热的过程,温度过高不利 C、原料中水蒸气的含量越大,脱硫速率一定越快 D、随着时间的推移,SO2吸附速率降低,可能是由于生成的占据了吸附位点没及时脱出导致(5)、在SO2与O2反应过程中掺入少量CH4有利于提高SO2转化成SO3 , 其中一种解释是甲烷参与氧化反应过程中存在如图机理。原料以一定流速通过反应容器,出口处测SO3的含量,结合机理说明甲烷体积分数增大,SO3体积分数也增大的理由。
A、温度越低,SO2的吸附量越高,SO2氧化反应速率越快 B、已知:SO2的物理吸附过程能自发进行,可推断该过程是熵减、放热的过程,温度过高不利 C、原料中水蒸气的含量越大,脱硫速率一定越快 D、随着时间的推移,SO2吸附速率降低,可能是由于生成的占据了吸附位点没及时脱出导致(5)、在SO2与O2反应过程中掺入少量CH4有利于提高SO2转化成SO3 , 其中一种解释是甲烷参与氧化反应过程中存在如图机理。原料以一定流速通过反应容器,出口处测SO3的含量,结合机理说明甲烷体积分数增大,SO3体积分数也增大的理由。
-
15、黄铜矿的主要成分为 , 以为原料实现如下转化。

请回答:
(1)、步骤Ⅰ的化学方程式是。步骤Ⅲ的目的是。
步骤Ⅴ的操作是蒸发浓缩、冷却结晶,据此可以推测F的溶质、和中溶解度最小的是。
(2)、下列说法正确的是____。A、气体A是常见的漂白剂 B、单质B和溶液C不能发生反应 C、可以用作污水处理的混凝剂 D、气体E的水溶液在空气中长期放置易变质(3)、设计实验方案证明中金属阳离子。 -
16、回答下列问题(1)、钦铝合金是制造航空航天及武器装备热端部件的理想材料。

①基态原子的价电子的轨道表示式。
②下列说法正确的是。
A.分子中既存在共价键又存在离子键
B.化学键中离子键成分的百分数:
C.第一电离能:
D.测定接近沸点的水蒸气的相对分子质量,测量值偏大的理由是存在相当量的水分子因氢键而相互缔合
③该合金的化学式是 , 密度为。
(2)、碳和氧是构建化合物的常见元素。某烃结构如图,结合图2所示信息,分析带星号碳的杂化方式为;带星号碳碳之间的键长比一般碳碳单键的键长要长,请从碳成键轨道的成分角度分析其原因。
-
17、根据实验目的设计方案并进行实验,观察到相关现象,其中方案设计或结论不正确的是( )
实验目的
方案设计
现象和结论
A
探究与反应的限度
取5mL溶液于试管中,加入1mL溶液,充分反应后滴入5滴15%溶液
若溶液变血红色,则与的反应有一定限度
B
探究乙酰水杨酸样品中是否含有水杨酸
取少量样品,加入3mL蒸馏水和少量乙醇,振荡,再加入1-2滴溶液
若有紫色沉淀生成,则该产品中含有水杨酸
C
检验家里空气中是否含有甲醛
用注射器多次抽取空气,慢慢注入盛有酸性稀溶液的同一试管中,观察溶液颜色变化
若溶液不变色,说明空气中几乎不含甲醛
D
探究铝配合物的形成
取1mL溶液于试管中,加入2mL饱和溶液,再加入1mL溶液
若无沉淀生成,说明与形成了稳定的配合物
A、A B、B C、C D、D -
18、已知选项中的反应均在常温下进行,有关常数近似处理为: , ; , 。下列说法不正确的是( )A、物质的量浓度均为0.1mol/L的与的混合溶液的约为13 B、0.05mol气体通入1L 0.5mol/L的硫酸铜溶液,能观察到黑色沉淀 C、0.1mol/L溶液中 D、0.1mol固体不能溶解在1L的一元强酸(无络合性、无强氧化性)中
-
19、在一定温度下,以为催化剂,氯苯和在中发生平行反应,分别生成邻二氯苯和对二氯苯

已知:
①两产物浓度之比与反应时间无关。
②反应物起始浓度均为 , 反应30min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。下列说法不正确的是( )
A、反应Ⅰ的活化能大于反应Ⅱ B、保持其他条件不变,改变反应物浓度可以提高产物中邻二氯苯的比例 C、保持其他条件不变,改变催化剂可以提高产物中邻二氯苯的比例 D、保持其他条件不变,适当提高反应温度可以提高产物中邻二氯苯的比例 -
20、古代青铜器的出土,体现了古代中国对人类物质文明的巨大贡献。青铜器埋藏会产生多种锈蚀产物,其中结构致密,可以阻止内部青铜继续被腐蚀,而结构疏松膨胀,可使锈蚀很快蔓延。青铜锈蚀过程大致如下:

下列说法不正确的是( )
A、青铜锈蚀Ⅰ过程属于电化学腐蚀,负极的电极反应方程式为: B、青铜锈蚀Ⅰ过程中浓度越大,腐蚀趋势越大 C、青铜锈蚀Ⅲ生成的方程式为: D、青铜器修复可用碳酸钠溶液浸泡一段时间,使其保存更长久