-
1、维生素C是重要的营养素,又称“抗坏血酸”,在空气中易发生如下转化:

下列说法不正确的是( )
A、维生素C易溶于水 B、上述转化发生了氧化反应 C、维生素C体现出的酸性可能与a、b两个羟基有关 D、抗坏血酸能发生加成反应、酯化反应、水解反应 -
2、下列方程式的书写,不正确的是( )A、溶液暴露在空气中: B、铅酸蓄电池放电的负极反应: C、葡萄糖与新制氢氧化铜反应: D、煅烧黄铁矿制
-
3、关于有机物分析检测,下列说法不正确的是( )A、通过X射线衍射可确定乙酸的空间结构 B、用溴的四氯化碳溶液,可以鉴别己烯和己醛 C、红外光谱图可获得分子中所含有的化学键或官能团的信息 D、卤代烃与氢氧化钠溶液共热、滴加溶液后根据沉淀颜色可判断卤原子种类
-
4、某兴趣小组用与反应制备高纯 , 实验装置如图所示(装置A内产生的气体中含有酸性气体杂质)

下列说法不正确的是( )
A、装置A中的反应利用了水解原理 B、为了简化装置,B可以省略 C、装置C中的可以换成 D、为了快速排除体系内的空气,可先断开装置F和装置G的连接 -
5、根据物质的组成和结构变化推测其性能变化,下列推测不合理的是( )
物质
组成和结构变化
性能变化
A
纯铝
加入少量Cu、Mg、Mn、Si
增大硬度和强度
B
饱和一元醇
增加烃基R碳原子的个数
水中溶解度增大
C
二氧化硅
加热熔融后快速冷却
各方向导热性相同
D
阿司匹林
(
 )
)使其与乙二醇、聚甲基丙烯酸连接起来
得到缓释阿司匹林
A、A B、B C、C D、D -
6、利用下列装置和试剂进行实验,能达到实验目的的是( )




A.用乙醇萃取碘水中的碘
B.验证易溶于水且溶液呈碱性
C.比较碳酸和苯酚的酸性强弱
D.中和反应反应热的测定
A、A B、B C、C D、D -
7、在溶液中能大量共存的离子组是( )A、、、、 B、、、、 C、、、、 D、、、、
-
8、运动会上发令枪所用“火药”的主要成分是氯酸钾、硫磺、木炭,撞击时发生的化学反应为:。下列有关叙述不正确的是( )A、氧化产物只有 B、反应中氯酸钾是氧化剂 C、发令时产生的白烟主要是固体颗粒 D、反应中消耗氯酸钾时,转移电子数
-
9、对下列事实的解释不正确的是( )A、常温下,浓硫酸可以用铝制容器贮存,说明铝与浓硫酸不反应 B、硫酸沸点高,主要是因为分子间形成了氢键 C、将浓硫酸和铜片反应生成的气体通入品红溶液红色褪去,说明产生漂白性气体 D、反应能进行,说明不溶于稀硫酸
-
10、下列化学用语使用正确的是( )A、甲胺的电子式:
 B、某烷烃名称为2,5-二甲基戊烷
C、中子数为7的碳原子:
D、的价层电子对互斥模型:
B、某烷烃名称为2,5-二甲基戊烷
C、中子数为7的碳原子:
D、的价层电子对互斥模型:
-
11、下列食品添加剂中常用作防腐剂的是( )A、 B、苯甲酸 C、 D、碘酸钾
-
12、某研究小组通过下列路线合成一款新型抗惊厥药F。

已知:
 。请回答:(1)、化合物E含氧官能团的名称是。(2)、化合物C的结构简式。(3)、下列说法正确的是____。A、A→B为取代反应 B、完全转化为D需要消耗 C、E在酸性条件下可转化为D D、最多可消耗(4)、写出D→E的化学方程式。(5)、请写出符合下列条件的
。请回答:(1)、化合物E含氧官能团的名称是。(2)、化合物C的结构简式。(3)、下列说法正确的是____。A、A→B为取代反应 B、完全转化为D需要消耗 C、E在酸性条件下可转化为D D、最多可消耗(4)、写出D→E的化学方程式。(5)、请写出符合下列条件的 的同分异构体。
的同分异构体。a.分子中含六元环
b.无氮氮相连的键
b.谱检测表明:分子中有2种不同环境的氢原子
(6)、以丙酮()和尿素( )为主要原料合成
)为主要原料合成 (用流程图表示,无机试剂任选)。
(用流程图表示,无机试剂任选)。 -
13、半水煤气(含有、、、 , 以及少量的、和)经提纯后可获得工业合成氨所需的和混合气。过程如下:

已知:①。
②与反应的方程式为:。
③。请回答:
(1)、半水煤气通过溶液(填化学式)可证明有气体。(2)、在“催化转化炉”的后半段补充通入作“冷激气”,原因是。(3)、已知:高压下极易溶于水;用醋酸亚铜氨溶液(易被氧化)溶液可吸收 , 碱性焦没食子酸溶液(易受酸性气体影响)可吸收。“精制过程”需除去混合气体中的、、和 , 请排序: 。



(a)
(b)
(c)
(d)
(4)、通过测定“催化转化炉”进出口气体中体积分数以确定转化率。取标况下进口或出口气体,经历的实验过程以及反应前后每个装置的质量变化()如下:
①I、II的目的是
②体积分数为(用含及的式子表示,忽略空气影响)。
(5)、下列说法正确的是____A、“煤气发生炉”应先通后通 B、采用饱和溶液吸收会造成管道堵塞 C、吸收塔内放置空心瓷环可提高的吸收率 D、半水煤气中的会导致催化剂失效 -
14、金属钨是重要的战略金属。请回答:(1)、I.用电极电解熔融盐体系,可小规模生产高纯金属钨。
其阴极的反应式为。(2)、II.工业上利用“蒸气转移法”提纯金属钨的原理为:。模拟装置如下图所示。

该反应中,反应物总能量生成物能量(选填“高于”“低于”)。
(3)、已知瞬时速率与的浓度、平衡浓度的定量关系为(为速率常数,只与温度有关)。向恒温恒容容器中加入 , 当固体为时,最大。当转化率为0.9%时,=(用含的式子表示)。(4)、粗钨中的杂质与碘不反应。下列说法正确的是____A、反应前后气态物质的计量数相等,故反应的 B、高温区中的平衡浓度大于低温区 C、粗钨应放入高温区 D、分批取出纯钨比一次性取出纯钨,可得到更多纯钨(5)、时反应平衡常数 , 时。①若气体在低温区与高温区循环一周称为一次转移。向装置内充入与足量粗 , 则理论上至少需要次转移才能得到纯(两区连接部分体积忽略不计)。
②已知要先吸附到固体的表面才能发生反应生成。向容器中充入与足量粗 , 获得纯所需时间与的物质的量的关系如图所示。当后所需时间增大的原因是。

-
15、一种制备的工艺路线如图所示,反应②所得溶液在3~4之间,反应③需及时补充以保持反应在条件下进行。

已知:常温下,的电离平衡常数 , 。请回答:
(1)、溶液①中阴离子浓度大小(用“>”表示):。(2)、下列说法正确的是____。A、反应①、②和③均为氧化还原反应 B、气体①和②是造成酸雨的主要成分 C、往反应①后的溶液中加水可得到硫酸铜溶液 D、溶液Y可循环用于反应②进行吸收气体①(3)、写出反应③的化学方程式:。(4)、“低温真空蒸发”可防止被氧化。请设计实验证明是否被氧化。若部分被氧化,为不降低的产率,补充的量应适当(填“增加”“减少”或“不变”)。 -
16、、、、是生命元素。请回答:(1)、下列说法正确的是____。A、第一电离能: B、电负性: C、酸性: D、键角:(2)、键中的杂化方式;画出的结构式(用“→”表示配位键)。(3)、、、与能形成一种阳离子 , 呈轴向狭长的八面体结构(如下图所示)。
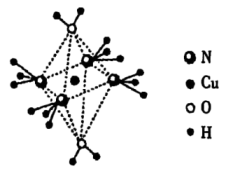
①阳离子的化学式为 , 加热时首先失去的组分是 , 该组分的分子空间构型为。
②可选用(填“射线衍射仪”或“质谱仪”)判断中的键是否相同。
③转化为阳离子时,需逐级结合分子,各级反应的平衡常数分别为 , , , , 如。
请从结构角度解释的原因。
-
17、根据实验目的设计方案,观察到相关现象,其中方案设计或结论正确的是( )
实验目的
方案设计
现象
结论
A
探究的溶解平衡
将收集有的试管倒立于水中
水进入试管占据试管容积四分之三
溶于水,达到溶解平衡
B
比较金属A和B的活动性强弱
将金属A、B分别与镁条、电压表连通后,插入稀硫酸中
与A连接时,电压表的示数更大
金属活动性:A<B
C
判断的晶体类型
将晶体溶于水,测导电性
溶液可导电
晶体为离子晶体
D
探究能否使蛋白质变性
往装有鸡蛋清的试管中先加入少量 , 再加过量水,振荡
试管底部可见少量固体
能使蛋白质变性
A、A B、B C、C D、D -
18、已知:;草酸:、;醋酸:。下列说法正确的是( )A、悬浊液中滴加过量冰醋酸,悬浊液变澄清 B、饱和溶液中加溶液,无现象,则 C、饱和溶液中存在: D、溶液中滴加等浓度等体积的醋酸,有生成
-
19、叔丁醇与羧酸发生酯化反应的机理具有其特殊性,可用下图表示,下列说法正确的是( )

已知:连在同一碳原子上的甲基之间存在排斥力。
A、中间体2的甲基间的排斥力比叔丁醇的甲基间的排斥力大 B、相同外界条件下,乙酸比中间体3更易给出 C、用溶液中和步骤④产生的 , 有利于提高叔丁酯的产率 D、用标记醇羟基,可区别叔丁醇与乙醇在酯化反应时的机理差异 -
20、取琼脂、饱和食盐水的混合溶液倒入培养皿中,滴入几滴酚酞和溶液,混合均匀,放入裹有锌片的铁钉(如下图所示),一段时间后,下列说法不正确的是( )
 A、锌片附近琼脂颜色变红 B、铁钉上的电极反应式: C、离子在半凝固态的琼脂内可定向移动 D、将锌片改为铜片,琼脂中会出现蓝、红、蓝三个色块
A、锌片附近琼脂颜色变红 B、铁钉上的电极反应式: C、离子在半凝固态的琼脂内可定向移动 D、将锌片改为铜片,琼脂中会出现蓝、红、蓝三个色块