-
1、富马酸亚铁[]又称富马铁,是一种安全、高效的有机营养补铁剂,可由富马酸()与硫酸亚铁制取,其制备装置(夹持装置略)如图所示。
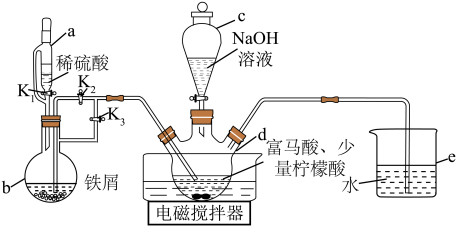
已知:①富马酸可溶于乙醇,微溶于水。
②柠檬酸易溶于水和乙醇,酸性较强,具有强还原性。
③富马酸亚铁易溶于水,性质稳定,难溶于无水乙醇。
实验步骤如下:
Ⅰ.打开活塞、 , 关闭 , 向d中通入气体,待d中空气被排尽后,将b中溶液压入d中。
Ⅱ.在50℃恒温条件下用电磁搅拌器不断搅拌,然后向d中滴加溶液,调节溶液 , 使反应物充分反应。
Ⅲ.反应完成后,向d中反应混合液中加入无水乙醇,生成白色沉淀,将沉淀过滤、洗涤得粗产品,将粗产品纯化后得精品。
回答下列问题:
(1)、仪器a的名称是 , 相对于c,仪器a的优点是。(2)、步骤Ⅰ中将b中溶液压入d中的操作是。(3)、反应混合液中加入柠檬酸的作用是。(4)、写出步骤Ⅱ中生成富马酸亚铁的化学方程式:。(5)、步骤Ⅲ中加入无水乙醇的作用是 , 沉淀洗涤时用作洗涤剂。(6)、若富马酸的投料量为 , 产出纯品 , 则富马酸亚铁的产率为(保留两位有效数字)。 -
2、时,三种硫化物(表示、或)的沉淀溶解平衡曲线如图所示。已知 , 。下列说法正确的是( )
 A、时,溶度积大小为 B、点对应的过饱和溶液,溶液中 C、时,反应的平衡常数为 D、向点的溶液中加入少量固体,溶液组成沿曲线向点方向移动
A、时,溶度积大小为 B、点对应的过饱和溶液,溶液中 C、时,反应的平衡常数为 D、向点的溶液中加入少量固体,溶液组成沿曲线向点方向移动 -
3、利用对二甲苯制取对甲基苯甲醛的部分反应历程如图所示(其中带“·”的表示自由基)。

下列说法错误的是( )
A、Co(Ⅲ)使苯环上甲基的键断裂生成对二甲苯自由基和 B、该反应的催化剂为 C、对二甲苯自由基在反应ⅱ中发生还原反应 D、总反应为:

-
4、在不同温度下向容积为的密闭容器中充入一定量 , 发生反应 。若在时,通入 , 时达到平衡状态;时,通入 , 时达到平衡状态。已知反应过程中有关物质的物质的量随时间的变化曲线如图所示。

下列说法错误的是( )
A、 B、时,的平均反应速率为 C、时,的平衡转化率约为 D、时,该反应的平衡常数 -
5、以丙酮为原料,以KI溶液为电解质溶液,BP膜为双极膜(中间层中的解离为和),利用电化学方法合成乙酸,同时生成清洁能源的原理及装置如图所示:

下列说法错误的是( )
A、N极的阴极 B、M极电极反应式为I--2e-+H2O=IO-+2H+ C、电解过程中阴极区溶液不变 D、外电路转移时,理论上可制备乙酸 -
6、利用下列仪器(夹持装置略)和用品及试剂能达到相应实验目的的是( )
选项
实验目的
仪器和用品
试剂
A
检验的存在
试管、滴瓶
稀硝酸、溶液、待检溶液
B
实验室制备氯气
圆底烧瓶、分液漏斗、集气瓶、烧杯、导管、酒精灯、橡皮塞、陶土网
浓盐酸、、NaOH溶液
C
检验的存在
烧杯、酒精灯、洁净的铁丝
盐酸、待检溶液
D
配制溶液
托盘天平、药匙、烧杯、量筒、玻璃棒、100mL容量瓶
蒸馏水、
A、A B、B C、C D、D -
7、铈是地壳中最丰富的稀土金属,可用作合金添加剂、医药、制革等。某兴趣小组以二氧化铈()废渣为原料制备金属铈和的流程如图所示。

下列说法错误的是( )
A、“酸浸”时发生的反应为 B、“中和”时,加入氨水不宜过量 C、“试剂X”可选用和氨水混合物 D、“电解”时,阴极上得到的同时阳极上得到 -
8、装置甲是将废水中的乙醛()在微生物作用下转化成的装置,可同时利用此装置与装置乙制备“84”消毒液。

下列说法错误的是( )
A、装置甲为原电池,N极为正极 B、制备“84”消毒液时,Y接口与a接口相连 C、M极上发生反应的电极反应式为 D、若M极消耗乙醛,则理论上生成质量为 -
9、黄铁矿()在酸性条件下发生催化氧化的反应历程如图所示。下列说法错误的是( )
 A、反应Ⅰ、Ⅱ、Ⅲ均发生氧化还原反应 B、反应Ⅰ中氧化剂与还原剂的物质的量之比为 C、反应Ⅱ的离子方程式为 D、该过程的总反应为
A、反应Ⅰ、Ⅱ、Ⅲ均发生氧化还原反应 B、反应Ⅰ中氧化剂与还原剂的物质的量之比为 C、反应Ⅱ的离子方程式为 D、该过程的总反应为 -
10、有机物W(结构简式如图所示)是合成抗肿瘤药物培美曲塞的一种反应物,下列有关说法错误的是( )
 A、除H外,其余原子均位于同一平面上 B、第一电离能: C、W的沸点较高是由于该物质分子间存在氢键 D、W分子具有碱性,可与盐酸反应生成盐
A、除H外,其余原子均位于同一平面上 B、第一电离能: C、W的沸点较高是由于该物质分子间存在氢键 D、W分子具有碱性,可与盐酸反应生成盐 -
11、W、X、Y、Z、M为原子序数依次增大的短周期主族元素,其中仅有X、Y、Z相邻,且为同周期元素,五种元素可组成抗生素氧哌嗪青霉素中间体,其结构如图所示,下列说法正确的是( )
 A、W与X、Y、Z、M形成的简单化合物的熔点: B、X、Y、M元素形成的氧化物对应的水化物的酸性: C、Y、Z、M元素对应的简单阴离子的半径: D、W与X、Y、Z、M元素均能形成18电子的化合物
A、W与X、Y、Z、M形成的简单化合物的熔点: B、X、Y、M元素形成的氧化物对应的水化物的酸性: C、Y、Z、M元素对应的简单阴离子的半径: D、W与X、Y、Z、M元素均能形成18电子的化合物 -
12、用下列仪器或装置(图中部分夹持装置已省略)进行相应实验,可以达到实验目的的是( )


A.装置①可用于验证溴乙烷消去反应的气体产物为乙烯
B.装置②可用于溶液滴定盐酸


C.装置③可用于组装铜银原电池
D.装置④可用于蒸发溶液得到固体
A、A B、B C、C D、D -
13、实验室安全至关重要,下列做法正确的是( )A、蒸发液体时液体体积不超过蒸发皿容积的 , 且要用玻璃棒搅拌 B、溶液不慎溅在皮肤上,先用大量水冲洗,再用的碳酸氢钠溶液冲洗 C、还原时,要先通一段时间氢气后再加热还原,最后还原铁粉在氢气气氛中冷却 D、蒸馏实验时忘记加碎瓷片,应停止加热,然后立即加入碎瓷片
-
14、下列化学用语表示正确的是( )A、含18个中子的氯离子为 B、钠离子的结构示意图为
 C、乙醇的空间填充模型为
C、乙醇的空间填充模型为 D、为极性分子,电子式为
D、为极性分子,电子式为
-
15、化学与社会、生产、生活密切相关。下列说法错误的是( )A、碳酸氢钠可用作食品膨松剂 B、温室气体是形成酸雨的主要物质 C、袋装食品中常伴有还原铁粉,其作用是防止食物氧化变质 D、家庭装修时用植物生态涂料替代传统涂料,有利于健康及环保
-
16、化合物K常用作医药中间体、材料中间体,其合成路线如图所示。

已知:①;
②
 。
。回答下列问题:
(1)、检验苯中含有A的化学试剂为;B分子中碳原子的杂化方式为;(2)、C→D的反应类型为G的结构简式为 , J中官能团的名称为。(3)、H→I的化学方程式为。(4)、满足下列条件的D的同分异构体有种(不考虑立体异构)。①含苯环;②苯环上只有两种取代基:和
(5)、根据上述信息,写出以苯和 为主要原料制备
为主要原料制备 的合成路线:。
的合成路线:。 -
17、我国力争2030年前实现“碳达峰”,2060年前实现“碳中和”。其中的关键技术是运用催化转化法实现二氧化碳的综合利用。资源化利用受到越来越多的关注,它能有效减少碳排放,有效应对全球的气候变化,并且能充分利用碳资源。二氧化碳催化加氢制甲醇有利于减少温室气体排放,涉及的反应如下:
Ⅰ. kJ⋅mol-1
Ⅱ. kJ⋅mol-1
回答下列问题:
(1)、CO加生成气态甲醇的热化学方程式为。(2)、在恒温恒容的容器中发生上述反应,下列说法正确的有。a.加入催化剂,可提高的平衡转化率
b.气体密度保持不变,反应体系已达平衡
c.气体平均摩尔质量保持不变,反应体系已达平衡
d.平衡后缩小体积增大体系压强,有利于提高产率
e.平衡后升高温度,反应Ⅱ的正反应速率增大、逆反应速率减小,平衡正移
(3)、不同压强下,按照投料,发生反应I,实验测得的平衡转化率随温度的变化关系如图1所示。
①压强、由大到小的顺序为。
②图中A点对应的甲醇的体积分数是(计算结果保留1位小数)
③该温度下反应Ⅰ的平衡常数(用表示)。
(4)、0.5 MPa下,将的混合气体以一定流速通过装有催化剂的反应器,测得的转化率、或CO的选择性以及(的收率(的收率的转化率的选择性)随温度的变化如图2所示
曲线a表示(填“”或“CO”)的选择性随温度的变化,270℃时,对应CO的吸收率为;在210~250℃之间,的吸收率增大的原因是。
-
18、乳酸亚铁是某些补铁口服液的有效成分,主要用于治疗缺铁性贫血,吸收效果比无机铁好,易溶于水,几乎不溶于乙醇,可由乳酸与反应制得。以下是一种制备乳酸亚铁的实验方法,按要求回答下列问题:

Ⅰ.制备
实验步骤:
①检查装置的气密性,添加试剂;
②制取硫酸亚铁,并排净装置内的空气;
③将B中溶液压入C中产生沉淀;
④将C中混合物抽滤、洗涤、干燥,获得纯净的产品。
(1)、仪器C的名称是;(2)、将B中生成的溶液压入C中的操作是;(3)、抽滤用图2所示装置进行,下面有关抽滤的说法正确的是____; A、抽滤可缩短过滤的时间并且滤出固体易干燥 B、抽滤适用任何固液分离 C、向漏斗内转移浊液需用玻璃棒引流 D、滤毕,应先关闭抽气泵,再打开活塞A(4)、Ⅱ.制备乳酸亚铁晶体
A、抽滤可缩短过滤的时间并且滤出固体易干燥 B、抽滤适用任何固液分离 C、向漏斗内转移浊液需用玻璃棒引流 D、滤毕,应先关闭抽气泵,再打开活塞A(4)、Ⅱ.制备乳酸亚铁晶体将制得的加入乳酸溶液中,再加入少量铁粉,在75℃下搅拌使之充分反应,然后再加入适量乳酸。冷却,加入适量乙醇,过滤,再洗涤和干燥,得到产品。
加入适量乳酸的作用是。
(5)、加入乙醇可使溶剂的极性变(填“弱”或“强”),有利于析出晶体。(6)、检验久置空气中的乳酸亚铁晶体是否含有 , 从下面选择合理试剂,写出相关反应的离子方程式。①酸性溶液 ②KSCN溶液和氯水 ③铁氰化钾溶液 ④NaOH溶液
(7)、Ⅲ.样品中乳酸亚铁晶体()纯度的测定称取3.00 g样品,灼烧至完全灰化,加足量盐酸溶解,取所得可溶物配成100 mL溶液。吸取25.00 mL该溶液加入过量KI溶液充分反应,然后加入1~2滴淀粉溶液,用0.10 mol⋅L-1硫代硫酸钠标准溶液滴定,平行滴定3次,硫代硫酸钠溶液的平均用量为24.60 mL。(已知:)
接近滴定终点时,向锥形瓶中滴入半滴标准液的操作是____;
A、 B、
B、 C、
C、 D、
D、 (8)、产品中乳酸亚铁晶体的质量分数为。(保留4位有效数字)。
(8)、产品中乳酸亚铁晶体的质量分数为。(保留4位有效数字)。 -
19、新型锂电池正极材料有望取代广泛使用的 , 由软锰矿(主要成分为 , 还含有少量、FeO、、等杂质)为原料制备锰酸锂的流程如图:

已知:① , ;
②离子浓度 mol⋅L-1时除尽;
回答下列问题:
(1)、软锰矿水磨浆化处理的作用是。(2)、锂电池放电时正极反应式为 , 则锰酸锂中锰元素的化合价为。(3)、用代替氧化除杂,反应物利用率会更高,理由是。(4)、调pH时加入的X不能选用下列物质的是____。A、NaOH B、氨水 C、 D、(5)、常温下,调节 , 除去、 , 写出已经除尽的计算过程:。(6)、其他条件一定,沉锰过程中的沉淀率与溶液温度的关系如下图。:50℃后,随溶液温度升高,的沉淀率下降的原因是。 (7)、煅烧窑中,生成反应的化学方程式为。(8)、一种锰的氧化物四方晶胞结构如图所示,该晶胞由和构成。
(7)、煅烧窑中,生成反应的化学方程式为。(8)、一种锰的氧化物四方晶胞结构如图所示,该晶胞由和构成。
该氧化物的化学式为 , 基态的价层电子轨道表示式为。
-
20、25℃时,向0.1 mol/L的某三元羧酸(用表示)溶液中滴加0.1 mol/L NaOH溶液,溶液中含A微粒的分布系数(δ为某种含A微粒占所有含A微粒的物质的量分数)随pH变化如下图所示,已知碳酸的 , ()则下列说法错误的是( )
 A、b点溶液中: B、d点溶液的 C、反应的平衡常数 D、与足量溶液反应的离子方程式为
A、b点溶液中: B、d点溶液的 C、反应的平衡常数 D、与足量溶液反应的离子方程式为