-
1、向某密闭容器中充入1mol N2和3molH2 , 一定条件下发生反应N2(g) + 3H2(g) 2NH3(g),达到化学平衡时,下列说法正确的是( )A、反应停止了 B、正逆反应速率相等 C、N2的浓度为0 D、H2的转化率为100%
-
2、三氟化氯是极强助燃剂,能发生自耦电离: , 其分子的空间构型如图所示。下列推测合理的是( )
 A、与反应生成和 B、分子是含有极性键的非极性分子 C、比更难发生自耦电离 D、熔沸点:
A、与反应生成和 B、分子是含有极性键的非极性分子 C、比更难发生自耦电离 D、熔沸点: -
3、明代宋应星著《天工开物》记载:“凡铜供世用,出山与出炉止有赤铜。以炉甘石或倭铅掺和,转色为黄铜,以砒霜等药制炼为白铜;矾、硝等药制炼为青铜;广锡掺和为响铜;倭铅和写为铸铜。初质则一味红铜而已”。下列说法错误的是( )A、青铜的硬度大于纯铜 B、黄铜为铜铅合金,制造锣类乐器一般用黄铜 C、在炉甘石(主要成分ZnCO3)上滴加稀盐酸有气体放出 D、CuSO4·5H2O 失去结晶水变为CuSO4的过程是化学变化
-
4、下列不属于常用金属冶炼方法的是( )A、电解法 B、蒸馏法 C、热分解法 D、热还原法
-
5、下列实验操作或装置正确的是( )A、蒸发除去苯甲酸中的乙醇
 B、除去水中的苯酚
B、除去水中的苯酚 C、实验室纯化工业乙酸乙酯
C、实验室纯化工业乙酸乙酯 D、用氢氧化钠溶液滴定醋酸溶液
D、用氢氧化钠溶液滴定醋酸溶液
-
6、化合物I是一种药物的有效成分。合成I的一种路线如下:

已知:①

②C能发生银镜反应
回答下列问题:
(1)、A的化学名称是;反应A→B的试剂是。(2)、B→C反应类型是。(3)、D、G的结构简式分别为、。(4)、H→I的化学反应方程式为;检验I中还有H的实验方法是。(5)、X是C的同系物(相对分子质量比C大14),其中核磁共振氢谱有4组峰,且峰面积之比为2∶2∶2∶1的结构简式为(写两个)。 -
7、Si、S、Se在自然界中形成多种多样的物质结构。回答下列问题:(1)、Se与O同族,电负性较大的是;基态Se原子的价电子运动状态有种。(2)、已知液态的二氧化硫可以发生类似水的自电离:。中各原子满足8电子结构,则其键和键数目之比为 , 的空间结构为。(3)、有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物和的结构如图所示,为平面形,二者中N的杂化方式分别为 , 二者中更易与形成配位键的是。
 (4)、Se与Si均为非金属元素,熔点(>1700℃)明显高于(315℃),原因是。(5)、-硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。-硒六方晶胞参数为、、(其中),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为。
(4)、Se与Si均为非金属元素,熔点(>1700℃)明显高于(315℃),原因是。(5)、-硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。-硒六方晶胞参数为、、(其中),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为。
相邻链间的作用力为。晶胞中含有Se原子的数目为;则-硒晶胞的摩尔体积为(列出算式)。
-
8、研究二氧化碳的转化与减排具有重要的社会意义。用还原的反应过程如下:
①
②
回答下列问题:
(1)、(2)、同时提高与的平衡转化率和速率的措施是。(3)、在密闭容器中分别充入0.1mol与0.3mol。①保持密闭容器体积为10L,只发生①②反应,经10min反应达到平衡,测定出和均为0.05mol。10min内的平均反应速率为;该条件下,反应②的平衡常数为。
②在150℃时,改变密闭容器的体积,测得和平衡转化率随压强变化如图所示。平衡转化率随压强增大而减小的主要原因是;后平衡转化率随压强增大而减小缓慢甚至增大,可能的原因是。
 (4)、在刚性密闭容器中按体积比1∶3投入和 , 加入催化剂,仅发生反应①②。经实验测出两步反应过程的能量变化示意图如下:
(4)、在刚性密闭容器中按体积比1∶3投入和 , 加入催化剂,仅发生反应①②。经实验测出两步反应过程的能量变化示意图如下:
①在较低温度时,反应物转化率较高,但体系中体积分数很低,主要原因是活化能(填“>”、“<”或“=”)。
②随温度升高,的体积分数变化趋势为先增后减小,其可能原因是。
-
9、贵金属银有广泛用途。工业上用银锰精矿(主要含、MnS、等)制备银,同时获得二氧化锰的流程如下。

回答下列问题:
(1)、“浸锰”步骤中产生的浸锰液主要含有 , 生成气体的主要成分为;用惰性电极电解浸锰液制 , 写出电解总反应的化学方程式。(2)、已知“浸铁”步骤中保持不变,反应中n(氧化剂):n(还原剂)=;浸铁滤饼的主要成分为S和。(3)、“浸银”时发生反应 , 其中在溶液中是一种稳定配合物。加入的作用是;结合离子方程式,从平衡角度分析选用氯化物浓溶液的原因是。(4)、“沉银”步骤中,生成单质银的离子反应方程式为 , 沉银液经处理可再利用,方法是向沉银液中通入(写化学式),通过一步转化后循环再用。 -
10、实验室用废铁屑制取无水氯化铁并测其纯度。实验方案如下:
Ⅰ.制备
①将废铁屑加入30%NaOH溶液中,煮沸30分钟,过滤,洗涤2~3次。
②将洗涤后废铁屑加入20%盐酸,控制温度在40~50℃之间,至反应完毕,过滤。
③向滤液中逐滴加入10%双氧水,同时加入25%盐酸,充分搅拌至溶液呈棕黄色。
④将溶液转移至蒸发皿中,加热浓缩,缓慢冷却至大量晶体析出,抽滤,洗涤。
回答下列问题:
(1)、用NaOH溶液洗涤废铁屑的目的是。(2)、控制温度在40~50℃的原因是。(3)、滴加10%双氧水时,滴加速率过快会产生气泡。该气体为。(4)、Ⅱ.无水制备已知熔点―156℃,沸点77℃,易水解生成和HCl。
按图装置进行实验。锥形瓶中生成无水的总化学方程式为;仪器A的作用是。
 (5)、Ⅲ.产品纯度测定
(5)、Ⅲ.产品纯度测定称取3.250g产品试样,配制成100.00mL溶液,取20.00mL于锥形瓶中,加入足量KI溶液,经充分反应后,滴入淀粉溶液3~5滴,然后用溶液滴定(),经三次平行实验,平均消耗溶液19.00mL。
①所制产品的纯度为(以无水质量分数表示,保留三位有效数字);
②所制产品中可能含有杂质,检验的试剂为(填化学式)溶液;产生的原因可能是。
-
11、MX是一种难溶弱酸盐,离子不水解,某温度下,水溶液中pM与pH关系如下图。若代表 , , , 。下列说法错误的是( )
 A、无外加酸碱时,MX溶液中存在 B、 C、加入HX可实现由甲到乙 D、
A、无外加酸碱时,MX溶液中存在 B、 C、加入HX可实现由甲到乙 D、 -
12、“三组电解质”储能电池工作示意图如下,放电时,通过固体电解质向Cu电极移动,充电时,Cu电极上生成。下列说法错误的是( )
 A、放电时,Na电极失电子,发生氧化反应 B、放电时,正极的电极反应为 C、充电时,当外电路通过1mol电子时,Cu极区域溶液质量减少8g D、三组电解质有利于运动并防止副反应发生
A、放电时,Na电极失电子,发生氧化反应 B、放电时,正极的电极反应为 C、充电时,当外电路通过1mol电子时,Cu极区域溶液质量减少8g D、三组电解质有利于运动并防止副反应发生 -
13、下列设计的实验装置能达到实验目的的是( )


A,制备少量
B.分离酒精和碘


C.吸收
D.检验石蜡油分解产物中含有不饱和烃
A、A B、B C、C D、D -
14、甲、乙、丙为原子序数依次增大的不同短周期的主族元素。甲、丙形成的单核离子所带电荷数相同;乙和丙的原子最外层电子数之和为10。下列说法错误的是( )A、丙位于第三周期第ⅦA族 B、甲、丙形成的化合物熔融态不导电 C、最高价含氧酸酸性:乙<丙 D、乙、丙形成的单中心分子中各原子满足8电子结构
-
15、设为阿伏加德罗常数的值。下列说法一定正确的是( )A、56g Fe与1.0mol充分反应,转移电子数目为 B、标准状况下,22.4L中含有氮原子的数目大于 C、1.0L0.1mol/L一元酸HA溶液中含有氢离子数目为 D、100g质量分数为46%的乙醇水溶液中含有O―H键数目为
-
16、某有机合成中间体的结构简式为
 。下列有关分析正确的是( ) A、该物质在一定条件下可以发生聚合反应 B、该物质分子所有原子可能共面 C、该物质分别与足量Na和反应生成气体的体积比为2∶1 D、其苯环上的一溴取代物有2种
。下列有关分析正确的是( ) A、该物质在一定条件下可以发生聚合反应 B、该物质分子所有原子可能共面 C、该物质分别与足量Na和反应生成气体的体积比为2∶1 D、其苯环上的一溴取代物有2种 -
17、成都水井坊是我国最古老的酿酒遗址。其特色之一是在小麦、高粱中先后拌入糖曲和酒曲,发酵后进行“量质摘酒”——以如图所示的生铁“天锅”把酒头摘出后,边摘边尝,优中选优。下列有关说法错误的是( )
 A、小麦、高粱中含有的淀粉多糖为高分子化合物 B、“天锅”材料中只含金属元素 C、图中“摘酒”操作是指通过蒸馏分离出乙醇溶液 D、通过“量质摘酒”可得到不同酒精度的酒
A、小麦、高粱中含有的淀粉多糖为高分子化合物 B、“天锅”材料中只含金属元素 C、图中“摘酒”操作是指通过蒸馏分离出乙醇溶液 D、通过“量质摘酒”可得到不同酒精度的酒 -
18、化合物是一种化学药物合成的重要中间体。的一种合成路线如图所示。

已知:Ⅰ.
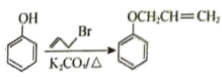
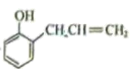 。
。Ⅱ.R1-CHO+
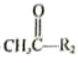
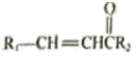 。
。回答下列问题:
(1)、 中基态原子的核外电子排布式为。 (2)、有机物的结构简式为 , 的反应类型为。(3)、的化学方程式为。(4)、有机物是的同分异构体,符合下列条件的有种(不考虑立体异构);
中基态原子的核外电子排布式为。 (2)、有机物的结构简式为 , 的反应类型为。(3)、的化学方程式为。(4)、有机物是的同分异构体,符合下列条件的有种(不考虑立体异构);①分子中除苯环外不含其他环状结构
②仅含有一种官能团,能与新制反应生成砖红色沉淀
③苯环上有3个取代基
其中核磁共振氢谱显示为5组峰,且峰面积之比为的同分异构体的结构简式为(写出一种即可)。
(5)、设计以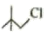 和
和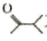 为原料制备
为原料制备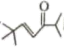 的合成路线:。
的合成路线:。 -
19、甲醇水蒸气重整制氢反应流程简单,但氢气中含有的CO会降低氢燃料电池性能,如何降低一氧化碳含量、提升氢气纯度成为研究的热点。甲醇水蒸气重整制氢过程发生的反应如下:
主反应:
副反应:
(1)、制氢过程中存在逆水气变换反应 , 。(2)、副反应部分机理如图所示(其中吸附在催化剂表面上的物种用*标注),其中决速步骤的反应为。 (3)、当水醇比为时,在催化剂作用下,温度对甲醇平衡转化率及选择性[]的影响如图所示。
(3)、当水醇比为时,在催化剂作用下,温度对甲醇平衡转化率及选择性[]的影响如图所示。
①升高温度平衡转化率增大的原因是。
②主反应的适宜温度在(填“210℃”“240℃”或“280℃”)左右。
(4)、在一定温度、压强和催化剂作用下,甲醇水蒸气重整反应中,CO、的选择性及单位甲醇的产氢率随水醇比的变化如图所示。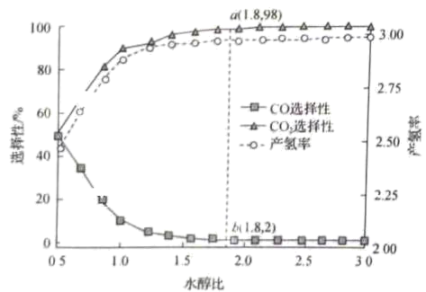
①一般水醇比选择1.6左右,原因是。
②若点甲醇的平衡转化率为96%,此时的物质的量分数(保留两位有效数字),以物质的量分数表示的主反应的平衡常数(列出计算式即可)。
-
20、氮化铍可用于新型的耐火陶瓷材料和反应堆材料,可由铍粉和干燥氮气在无氧气氛中于700~1400℃的温度下加热制得。以绿柱石(主要组成是 , 还含有少量铁元素)为原料生产氮化铍的工艺流程如图所示。

已知:常温下相关金属离子形成氢氧化物沉淀的如表所示。
金属离子
开始沉淀pH
6.3
1.8
3.1
5.6
12.4
沉淀完全pH
8.3
3.2
4.8
8.5
138
回答下列问题:
(1)、“酸浸”时绿柱石要进行粉碎,其目的是。(2)、“转化”时加入的目的是(用离子方程式表示)。(3)、“调”时加入适量细粉除去和 , 调节溶液的范围是 , 其中沉淀的离子方程式为 , “滤渣2”的主要成分是(填化学式)。(4)、“沉铍”时所加试剂是(填“氨水”或“溶液”)。(5)、生成的化学方程式为。