-
1、利用双极膜电解含有的溶液,使转化成碳燃料,实现了还原流动。电解池如下图6所示,双极膜中水电离的和在电场作用下可以向两极迁移。下列说法不正确的是( )
 A、银网电极与电源负极相连 B、双极膜b侧应该用质子交换膜 C、阴极电极反应为: D、双极膜中有0.1mol 电离,则阳极附近理论上产生0.05mol
A、银网电极与电源负极相连 B、双极膜b侧应该用质子交换膜 C、阴极电极反应为: D、双极膜中有0.1mol 电离,则阳极附近理论上产生0.05mol -
2、甲醇是重要的化工原料。与反应可合成甲醇,反应如下:
, 恒容密闭容器中,a mol 和3a mol , 下温度下反应达到平衡时,各组分的物质的量浓度(c)随温度(T)变化如图5所示。下列说法正确的是( )
 A、随温度升高该反应的平衡常数变大 B、加入合适催化剂有利于提高的平衡转化率 C、℃时,恒容下充入Ar,压强增大,平衡正向移动,平衡时浓度变小 D、T1℃时,恒压下2a mol 与6a mol 反应达到平衡时
A、随温度升高该反应的平衡常数变大 B、加入合适催化剂有利于提高的平衡转化率 C、℃时,恒容下充入Ar,压强增大,平衡正向移动,平衡时浓度变小 D、T1℃时,恒压下2a mol 与6a mol 反应达到平衡时 -
3、纳米碗是一种奇特的碗状共轭体系。高温条件下,可以由分子经过连续5步氢抽提和闭环脱氢反应生成。其中的反应机理和能量变化如图。下列说法不正确的是( )
 A、选择相对较高的温度更有利于制备纳米碗 B、推测纳米碗中含5个五元环 C、 D、该反应历程包含了3步基元反应,且第3步是该反应的决速步骤
A、选择相对较高的温度更有利于制备纳米碗 B、推测纳米碗中含5个五元环 C、 D、该反应历程包含了3步基元反应,且第3步是该反应的决速步骤 -
4、陈述Ⅰ和陈述Ⅱ均正确且具备因果关系的是( )
选项
陈述Ⅰ
陈述Ⅱ
A
向稀溶液滴加KSCN溶液,无现象
与不反应
B
溶液用于刻蚀铜制品
铜与溶液发生置换反应
C
用焦炭和石英砂制取粗硅
可制作光导纤维
D
酸性:
羧基中O-H键的极性:
A、A B、B C、C D、D -
5、已知M、R、X、Y、Z属于短周期非金属元素,M与X同主族,M单质与X单质化合可形成一种漂白性物质;R可形成三键的单质气体;X、Y、Z与R同周期,且Z原子的半径最小,Y的基态原子价层p轨道有2个电子。下列说法不正确的是( )A、原子半径:M>R>X B、与均为极性分子 C、最高价含氧酸酸性:R>Y D、第一电离能:Z>R>X
-
6、设阿伏加德罗常数的值为 , 下列说法正确的是( )A、1mol Fe与水蒸气完全反应转移电子数为3 B、标准状况下,2.24L 中含有原子数为0.4 C、常温下,1L pH=13的溶液中含有数0.1 D、0.3mol 和0.1mol 充分反应生成分子数为0.2
-
7、含Cl物质的分类与相应化合价关系如图所示,下列推断正确的是( )
 A、f是氯的酸性最强含氧酸 B、c分解得产物a和b C、d可用于自来水杀菌消毒,说明其有氧化性 D、为制备纯净的气体b,将气体通入饱和e溶液中洗气即可
A、f是氯的酸性最强含氧酸 B、c分解得产物a和b C、d可用于自来水杀菌消毒,说明其有氧化性 D、为制备纯净的气体b,将气体通入饱和e溶液中洗气即可 -
8、下列生活情境中对应的离子方程式正确的是( )A、泡沫灭火器灭火原理: B、除水垢时,先用溶液浸泡: C、铅蓄电池放电时总反应: D、84消毒液与洁厕灵不能混合使用原理:
-
9、按照下图进行铜与浓硫酸反应的探究实验。下列说法正确的是( )
 A、蘸有品红溶液的滤纸褪色,说明具有强氧化性 B、N形管溶液变为红色,说明有酸性气体进入N形管 C、反应后,从c口抽取反应液加到足量的氨水中最终产生蓝色沉淀 D、实验结束后从b口注入足量NaOH溶液,会有2种物质与NaOH反应
A、蘸有品红溶液的滤纸褪色,说明具有强氧化性 B、N形管溶液变为红色,说明有酸性气体进入N形管 C、反应后,从c口抽取反应液加到足量的氨水中最终产生蓝色沉淀 D、实验结束后从b口注入足量NaOH溶液,会有2种物质与NaOH反应 -
10、“劳动最光荣、劳动最崇高”。下列劳动项目与所述的化学知识没有关联的是( )
选项
劳动项目
化学知识
A
实验员用加大量的水制备
稀释促进盐的水解
B
科学家用乳酸合成聚乳酸
合成聚乳酸是缩聚反应
C
工人使用糯米酿造米酒
葡萄糖在酶作用下转化为乙醇
D
农艺师施肥时用土壤掩埋铵态氨肥
铵盐易溶于水
A、A B、B C、C D、D -
11、锌-空气电池因工作电压高、制造成本低等特点备受关注。该电池以特定晶型的为催化剂,KOH溶液为电解质,放电时,( )A、移向锌电极 B、在正极发生氧化反应 C、负极发生反应: D、用盐酸作电解质能减少锌电极的损耗
-
12、某种化合物可用于药用多肽的结构修饰,其结构简式如图1所示。下列说法正确的是( )

图1
A、该分子含有手性碳原子 B、该分子中含有3种官能团 C、该分子中所有的碳原子可共平面 D、1mol该化合物最多能与2mol NaOH发生反应 -
13、可用作脱硝剂。某科研小组探究被还原的反应,涉及的部分装置如图所示。

下列说法正确的是( )
A、用甲装置制备 B、乙装置中反应的n(还原剂)∶n(氧化剂)=2∶1 C、丙装置盛放无水用于干燥 D、在丁装置中为了更好混合反应气体,应先通入 -
14、Na及其化合物是重要的物质。下列说法不正确的是( )A、保存NaOH溶液用带橡胶塞的试剂瓶 B、俗名小苏打,可用作食用碱或工业用碱 C、与反应中,既是氧化剂又是还原剂 D、单质钠可用于冶炼金属,Na与溶液反应可制Cu
-
15、科技发展与化学密切相关。下列说法正确的是( )A、福建舰舰体材料无磁镍铬钛合金钢硬度高于纯铁 B、制造5G芯片材质之一氮化镓(GaN)为金属晶体 C、针核反应堆的主要原料是 , 与互为同位素 D、嫦娥5号带回的月壤中含有Al元素,Al属于s区元素
-
16、杭州亚运会口号“心心相融,@未来”。下列亚运会所涉及的材料中,主要由无机非金属材料制成的是( )




A.湖山奖牌—金牌
B.场馆建造—聚四氟乙烯
C.场馆用电—硅太阳能电池板
D.火炬燃料—甲醇
A、A B、B C、C D、D -
17、Ⅰ.过氧化氢和盐酸的混合溶液可以刻蚀含铜的电路板。(1)、请写出用过氧化氢和盐酸刻蚀电路板时发生的离子反应方程式:。(2)、当反应一段时间后,随着溶液变蓝,气泡产生的速率加快,可能的原因是 。(3)、Ⅱ.含铜电路板也可以用FeCl3进行刻蚀,对刻蚀后的液体(FeCl3、FeCl2和CuCl2)进行处理以提取FeCl2•4H2O、CuSO4•5H2O,流程如图:

从滤液A中提取FeCl2•4H2O的操作为:加入Fe粉后,应先浓缩滤液至出现 , 趁热过滤,取溶液, , 过滤、洗涤、干燥。
(4)、检验溶液B中提取出的Cu上粘附的Cl﹣已经洗净的操作为: , 制备CuSO4•5H2O时,将铜溶解于H2SO4、HNO3的混酸中,此过程中产生的红棕色气体为 产物(选填“氧化”或“还原”)。(5)、Ⅲ.利用滴定法可测定所得CuSO4•5H2O的纯度,操作如下:①取agCuSO4•5H2O样品,加入足量NH4F﹣HF溶液溶解(F﹣用于防止Fe3+干扰检验:Fe3++6F﹣═
 )。
)。②滴加足量KI溶液,发生反应2Cu2++4I﹣═2CuI↓+I2。
③再用cmol/LNa2S2O3标准溶液滴定,以淀粉溶液作指示剂,到达滴定终点时消耗亚硫酸钠标准溶液VmL,发生的反应为:I2+2S2
 ═S4
═S4 +2I﹣。
+2I﹣。已知NH4F溶液呈酸性,则水解程度
 F﹣(填“>”、“<”或“=”),稀释后消耗的值 (选填“增大”、“减小”或“不变”)。(6)、接近滴定终点时,向溶液中滴加KSCN,会发现CuI沉淀转化为CuSCN,其沉淀转化的原因是 。已知CuI能够吸附大量I2 , 若不加KSCN,则测得CuSO4•5H2O的纯度 (选填“偏高”、“偏低”或“不变”)。(7)、计算CuSO4•5H2O的纯度:(用a、c、V的代数式表示)。
F﹣(填“>”、“<”或“=”),稀释后消耗的值 (选填“增大”、“减小”或“不变”)。(6)、接近滴定终点时,向溶液中滴加KSCN,会发现CuI沉淀转化为CuSCN,其沉淀转化的原因是 。已知CuI能够吸附大量I2 , 若不加KSCN,则测得CuSO4•5H2O的纯度 (选填“偏高”、“偏低”或“不变”)。(7)、计算CuSO4•5H2O的纯度:(用a、c、V的代数式表示)。 -
18、用于治疗神经性疾病的药物布立西坦的合成路线如图所示:
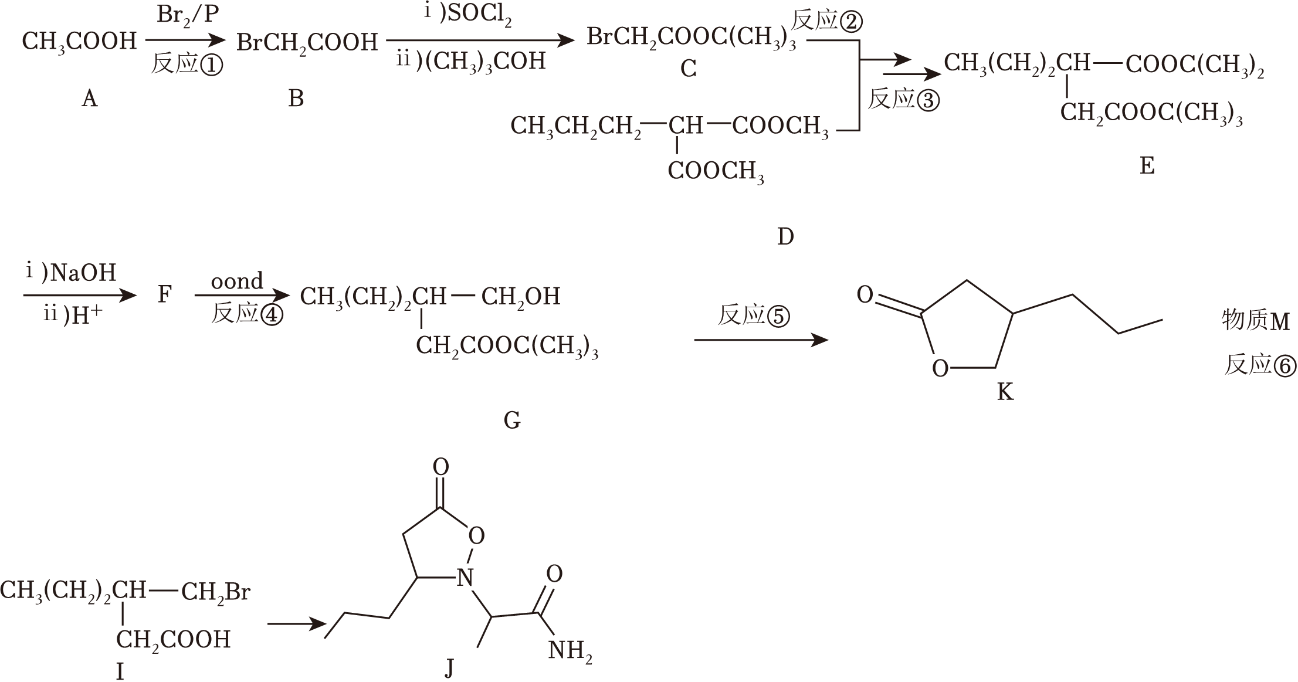
已知:
 ;
; 。(1)、反应①是 反应,反应④是 反应。(填反应类型,下同)(2)、有机物I中的含氧官能团名称为 , 有机物F的结构简式为 。(3)、已知反应⑤为酯交换反应,则另一产物的结构简式为 。(4)、已知反应⑥的原子利用率为100%,则物质M为 。(5)、写出一种满足下列条件的有机物K的同分异构体:。
。(1)、反应①是 反应,反应④是 反应。(填反应类型,下同)(2)、有机物I中的含氧官能团名称为 , 有机物F的结构简式为 。(3)、已知反应⑤为酯交换反应,则另一产物的结构简式为 。(4)、已知反应⑥的原子利用率为100%,则物质M为 。(5)、写出一种满足下列条件的有机物K的同分异构体:。①可以发生银镜反应;
②分子中存在3中化学环境不同的H原子,且个数比为1:2:3。
(6)、手性碳是指与四个各不相同原子与基团相连的碳原子,用C*表示。已知分子J中有2个手性碳,请用*将其在如图的结构简式中标出。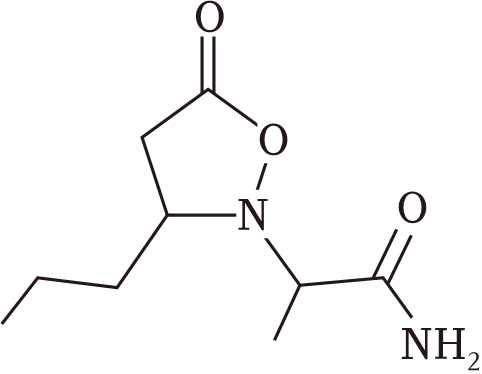 (7)、请写出以CH3(CH2)3COOH和CH3OH为原料制备CH3CH2CH=CHCOOCH3的路线(合成路线的表示方式为
(7)、请写出以CH3(CH2)3COOH和CH3OH为原料制备CH3CH2CH=CHCOOCH3的路线(合成路线的表示方式为 ••••••
•••••• 目标产物) 。
目标产物) 。 -
19、聚合氯化铝用于城市给排水净化。氧化铝法制取无水三氯化铝的反应如下:Al2O3(s)+3C(s)+3Cl2(g)
 2AlCl3(g)+3CO(g)。 (1)、标出上述反应的电子转移方向和数目 。(2)、写出该反应的平衡常数表达式:K=。(3)、Al原子核外有 种不同能量的电子。
2AlCl3(g)+3CO(g)。 (1)、标出上述反应的电子转移方向和数目 。(2)、写出该反应的平衡常数表达式:K=。(3)、Al原子核外有 种不同能量的电子。聚合氯化铝(PAC)是一种介于AlCl3和Al(OH)3之间的水溶性无机高分子聚合物,PAC的水解过程中会有一种聚合稳定态物质[AlO4Al12(OH)24(H2O)12]7+称为Al13 , Al13对水中胶体和颗粒物具有高度电中和桥联作用,是净水过程中的重要物质。
(4)、Al13在水解过程中会产生[Al(OH)2]+、[Al(OH)]2+等产物,请写出Al3+水解产生[Al(OH)]2+的离子方程式:。(5)、AlCl3溶液与NaOH溶液反应,若参加反应的铝离子最终转化生成Al13 , 则理论上参与反应的Al3+与OH﹣的物质的量之比是 。(6)、使用Al3+净水时应控制pH在6.8~8.02之间,否则净水效果不佳。请结合使用Al3+水解净化水时铝元素存在的形态,分析在强酸性和强碱性环境时净水效果差的原因 。 -
20、在某温度下,在体积为5L的密闭容器内发生如下反应:CH4(g)+H2O(g)⇌CO(g)+3H2(g)﹣Q(1)、在上述反应的反应物与生成物中,非极性分子为:。(2)、若反应20min后气体总物质的量增加了10mol,则甲烷的平均反应速率为 。(3)、下列选项中的物理量不变时,一定可以判断反应达到平衡的是 ____。A、容器中氢元素的质量分数 B、容器内的压强 C、反应的平衡常数 D、容器内气体的平均相对分子质量(4)、在某一时刻,v正=v逆=v0 , 反应若改变一条件,可使得v正<v逆<v0 , 指出可以改变的条件,并说明理由:。
已知CO与H2合成CH3OH是可逆反应:CO+2H2⇌CH3OH。
(5)、若上述反应达到平衡时CO与H2的转化率相同,则投料比n(CO):n(H2)=。