-
1、工业上用黄铁矿为原料制备硫酸的流程如图所示:

请回答:
(1)、已知FeS2的阴离子达到稳定结构,则FeS2的电子式为。(2)、已知: , 请写出焦硫酸的结构式。 (3)、写出步骤①的化学方程式。(4)、室温下,SO3为液体,SO2为气体。SO3熔点高于SO2的原因。(5)、下列说法正确的是____。A、步骤①,产生的气体进入接触室之前无需净化处理 B、步骤②,使用催化剂能使SO2的转化率达到100% C、步骤③,吸收设备中填充瓷环可提高SO3吸收率 D、可以预测:Na2S2O7的水溶液呈酸性,H2S2能将Fe2+氧化成Fe3+ E、17.8g H2S2O7与2.2g水充分混合后,可获得98%浓硫酸(6)、若硫铁矿煅烧不充分,则炉渣中混有+2价的铁元素,试设计一个简单的实验证明之。简述实验操作和有关的实验现象。(供选择的试剂:KSCN溶液、稀硫酸、稀盐酸、KMnO4溶液、品红溶液、NaOH溶液)
, 请写出焦硫酸的结构式。 (3)、写出步骤①的化学方程式。(4)、室温下,SO3为液体,SO2为气体。SO3熔点高于SO2的原因。(5)、下列说法正确的是____。A、步骤①,产生的气体进入接触室之前无需净化处理 B、步骤②,使用催化剂能使SO2的转化率达到100% C、步骤③,吸收设备中填充瓷环可提高SO3吸收率 D、可以预测:Na2S2O7的水溶液呈酸性,H2S2能将Fe2+氧化成Fe3+ E、17.8g H2S2O7与2.2g水充分混合后,可获得98%浓硫酸(6)、若硫铁矿煅烧不充分,则炉渣中混有+2价的铁元素,试设计一个简单的实验证明之。简述实验操作和有关的实验现象。(供选择的试剂:KSCN溶液、稀硫酸、稀盐酸、KMnO4溶液、品红溶液、NaOH溶液) -
2、回答下列问题。(1)、第117号元素Ts在周期表中的位置是。(2)、下图表示铷(Rb)及其化合物的产业链,回答相应问题。

①从卤水中分离铷离子常用离子交换法,而离子大小是影响交换效果的因素,铷的离子半径(填“小于”或“大于”)钾的离子半径。
②写出由氧化铷制备氢氧化铷的化学方程式。
③离子推进火箭是通过电离原子气体,转化为阳离子,然后离子被电场力作用加速,通过排气口射出推进器,产生反作用力推动火箭。单质铷适合用于离子推进火箭的原因是。
(3)、阅读短文,回答问题。硅元素在地壳中的含量仅次于氧。人类很早就利用硅酸盐烧陶制瓷、获得玻璃制品。
1824年,人类成功提炼出硅单质。由石英砂制高纯硅的过程如下:

如今,半导体“硅”已经成为信息时代高科技的代名词。由于硅元素储量丰富,且单晶硅具有优异的耐高温与抗腐蚀性能,所以单晶硅成为制造大规模集成电路(俗称“芯片”)的基底材料。
整个芯片制造过程需要许多高精密度的专业设备,其中不乏我国目前还未完全掌握而被“卡脖子”的技术。我国科学家正开发“碳基”芯片来替代硅基芯片,习近平主席评价此项研究“另辟蹊径,柳暗花明”。
①请依据以上短文,下列说法正确是。
A.硅元素在自然界中以游离态(单质)形式存在,石英砂的主要成分是SiO2
B.单晶硅做芯片的基底材料与硅元素储量丰富,单晶硅导电性好、耐腐蚀性能优异有关
C.制备单质硅的过程中焦炭过多容易生成副产物金刚砂
D.碳和硅在周期表中位于同一主族,性质相似,因此“碳基”芯片有望替代硅基芯片
②制备高纯硅过程必须严格控制无水无氧,因为SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出该反应的化学方程式。
③有一类组成最简单的有机硅化合物叫硅烷,硅烷的组成、结构与相应的烷烃相似,化学性质活泼,可在空气中自燃,写出乙硅烷在空气中自燃的化学方程式。
-
3、根据实验目的设计方案并进行实验,观察到相关现象,其中方案设计与结论都正确的是( )
实验目的
方案设计
现象
结论
A
检验固体样品中是否含有NH
将固体样品加水溶解,滴入浓NaOH溶液并加热,试管口放一张湿润的红色石蕊试纸
湿润的红色石蕊试纸变蓝
样品中含有NH
B
探究铝与浓硫酸的钝化现象
室温下,将铝片直接放入浓硫酸中,一段时间后取出并用水洗净,放入CuSO4溶液
铝片表面未见紫红色固体生成
室温下浓硫酸能将铝片钝化
C
探究Si、Cl元素非金属性的强弱
向Na2SiO3溶液中滴加1滴酚酞,然后逐滴加入盐酸至红色褪去
混合液逐渐变成白色凝胶
非金属性:Si<Cl
D
探究浓度与反应速率的关系
两支试管各盛4mL 0.01mol/L酸性高锰酸钾溶液,分别加入2mL 0.1mol/L草酸溶液和2mL 0.2mol/L草酸溶液
加入0.2mol/L草酸溶液的试管中,高锰酸钾溶液褪色更快
反应物浓度越大,反应速率越快
A、A B、B C、C D、D -
4、实验室中利用氧化铜和氧化铁混合物进行如图实验。下列说法错误的是( )
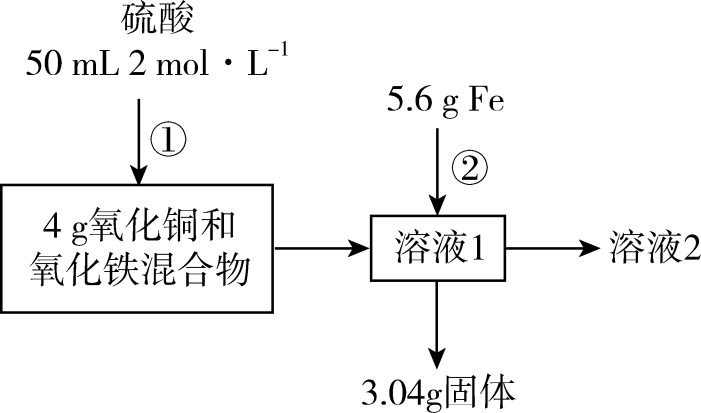 A、“3.04g固体”一定是铁铜混合物 B、“溶液2”中溶质的物质的量为0.1mol C、混合物中含氧元素的物质的量为0.06mol D、反应②能生成0.04gH2
A、“3.04g固体”一定是铁铜混合物 B、“溶液2”中溶质的物质的量为0.1mol C、混合物中含氧元素的物质的量为0.06mol D、反应②能生成0.04gH2 -
5、是硅酸盐水泥的重要成分之一,其相关性质的说法不正确的是( )A、可发生反应: B、具有吸水性,需要密封保存 C、能与 , 反应生成新盐 D、与足量盐酸作用,所得固体产物主要为
-
6、根据不同聚集态的碘单质与氢气反应的能量变化,下列判断正确的是( )
(i) I2(?)+H2(g)2HI(g) (该反应完全发生,放热9.48kJ)
(ii) I2(?)+H2(g)2HI(g) (该反应完全发生,吸收26.48kJ)
A、反应(i)中的I2为固态,反应(ii)中的I2为气态 B、1 mol固态碘升华时将吸收17.00 kJ热量 C、反应(ii)的反应物总能量比反应(i)的反应物总能量低 D、254 g I2(g)中与2gH2(g)充分反应放热9.48 kJ -
7、微生物燃料电池(MFC)以厌氧微生物催化氧化有机物(如葡萄糖),同时处理含Cu2+废水,装置如图所示,下列说法正确的是( )
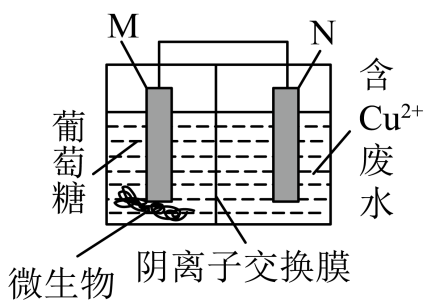 A、N极为电池的正极,发生氧化反应 B、温度越高,反应速率越快,电池工作效率越高 C、原电池中电子的移动方向是:M→导线→N→电解质溶液→M,阴离子移向M极 D、N极的电极反应式:Cu2++2e-=Cu
A、N极为电池的正极,发生氧化反应 B、温度越高,反应速率越快,电池工作效率越高 C、原电池中电子的移动方向是:M→导线→N→电解质溶液→M,阴离子移向M极 D、N极的电极反应式:Cu2++2e-=Cu -
8、用如图装置(夹持装置已略去)进行制备及性质实验,下列说法不正确的是( )
 A、甲中制备利用了的分解反应,丁也可以用于制备氨气 B、乙中的集气瓶内a导管短、b导管长 C、不能将丙中的换成食用油 D、向收集好的中通入少量 , 可能观察到白烟
A、甲中制备利用了的分解反应,丁也可以用于制备氨气 B、乙中的集气瓶内a导管短、b导管长 C、不能将丙中的换成食用油 D、向收集好的中通入少量 , 可能观察到白烟 -
9、反应N2(g)+3H2(g)2NH3(g)为放热反应,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( )A、容器内的压强不再变化 B、相同时间内断开H-H键数目和生成N-H键数目相等 C、容器内的温度不再变化 D、容器内气体的浓度c(N2):c(H2):c(NH3)=1:3:2
-
10、五种短周期元素在周期表中的位置如图所示。已知:W元素原子的最外层电子数是次外层的2倍,下列说法正确的是 ( )
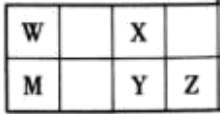 A、5种元素最高价氧化物的水化物都是酸 B、WZ4、MX2中所含化学键类型相同,熔点都很高 C、简单氢化物的稳定性:X>Y D、只有一种X的氢化物与Y的氧化物发生反应生成强酸
A、5种元素最高价氧化物的水化物都是酸 B、WZ4、MX2中所含化学键类型相同,熔点都很高 C、简单氢化物的稳定性:X>Y D、只有一种X的氢化物与Y的氧化物发生反应生成强酸 -
11、下列说法错误的是( )A、正戊烷和2-甲基丁烷互为同系物 B、某有机物在空气中充分燃烧后只生成CO2和H2O,该有机物可能是烃或烃的衍生物 C、医学上研究发现
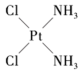 具有抗癌作用,而
具有抗癌作用,而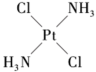 没有抗癌作用,说明二者互为同分异构,都是以Pt原子为中心的平面结构
D、C5H11Cl的同分异构体有8种
没有抗癌作用,说明二者互为同分异构,都是以Pt原子为中心的平面结构
D、C5H11Cl的同分异构体有8种
-
12、由乙烯推测丙烯(CH2=CH-CH3)的结构或性质,下列说法错误的是( )A、分子中3个碳原子不在同一直线上 B、在空气中燃烧时火焰明亮并伴有黑烟 C、能使酸性高锰酸钾溶液褪色,发生了氧化反应 D、聚丙烯的链节为-CH2-CH2-CH2-
-
13、下列有关说法不正确的是( )A、医用酒精含乙醇体积分数95% B、甲烷在高温下分解生成炭黑和氢气 C、高分子材料通常没有固定的熔沸点 D、天然橡胶可以使酸性高锰酸钾溶液褪色
-
14、下列说法正确的是( )
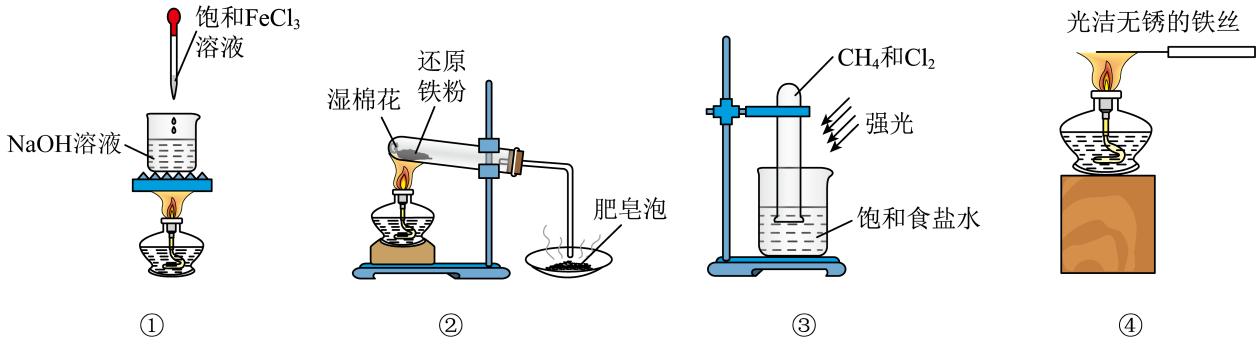 A、图①操作可用于实验室制取少量氢氧化铁胶体 B、图②可完成铁与水蒸气反应并根据固体颜色证明产物有Fe3O4 C、图③探究甲烷与氯气的反应 D、图④可用于硫酸钠的焰色试验
A、图①操作可用于实验室制取少量氢氧化铁胶体 B、图②可完成铁与水蒸气反应并根据固体颜色证明产物有Fe3O4 C、图③探究甲烷与氯气的反应 D、图④可用于硫酸钠的焰色试验 -
15、下列说法或有关反应的离子方程式正确的是( )A、与Al反应能放出H2的溶液中:NO、Na+、Fe3+、SO一定不能大量共存 B、钠与水反应:Na+2H2O=2OH﹣+Na++H2↑ C、向AlCl3溶液中滴加浓氨水至过量:Al3++4OH-=[Al(OH)4]- D、FeI2溶液中通入少量Cl2:
-
16、物质的性质决定用途,下列两者关系对应不正确的是( )A、铝合金质量轻、强度大,可用作制造飞机和宇宙飞船的材料 B、钾钠合金具有还原性,用于快中子反应堆的热交换剂 C、浓硫酸有吸水性,在实验室中常用作干燥剂 D、漂白粉具有强氧化性,可用作游泳池等场所的消毒剂
-
17、用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )A、标准状况下,11.2 LCHCl3中含原子数目为2.5NA B、足量Zn与一定量的浓硫酸反应产生22.4 L气体时,转移的电子数为2NA C、28 g乙烯和环丁烷的混合气体中含有的氢原子数为4NA D、Cu与浓硝酸反应生成NO2和N2O4共23 g,则铜失去的电子数为NA
-
18、下列说法错误的是( )A、
 表示易燃类物质,
表示易燃类物质, 表示爆炸类物质
B、
表示爆炸类物质
B、 均与“钠与水反应”这一实验有关
C、若不慎将浓硝酸沾到皮肤上,应立即用大量碱中和
D、含重金属元素的废液,可用沉淀法进行处理后再交由专业人员处理
均与“钠与水反应”这一实验有关
C、若不慎将浓硝酸沾到皮肤上,应立即用大量碱中和
D、含重金属元素的废液,可用沉淀法进行处理后再交由专业人员处理
-
19、氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中通过如下反应制得:3SiO2+6C+2N2=Si3N4+6CO。下列对该反应的说法正确的是( )A、该反应的氧化剂是SiO2和N2 B、该反应的还原剂为CO C、氮化硅中氮元素化合价为+3价 D、上述反应中每生成1mol Si3N4转移12mol电子
-
20、下列化学用语或图示不正确的是( )A、Cl的原子结构示意图:
 B、甲烷的空间充填模型:
B、甲烷的空间充填模型: C、NaHCO3溶于水的电离方程式:NaHCO3=Na++HCO
D、羟基的电子式:
C、NaHCO3溶于水的电离方程式:NaHCO3=Na++HCO
D、羟基的电子式: