-
1、下列反应属于氧化还原反应,且能量变化如图所示的是( )
 A、镁与盐酸的反应 B、双氧水的分解反应 C、灼热的炭与的反应 D、晶体与晶体的反应
A、镁与盐酸的反应 B、双氧水的分解反应 C、灼热的炭与的反应 D、晶体与晶体的反应 -
2、下列物质与俗名对应不正确的是( )A、氯仿: B、水玻璃:水溶液 C、重晶石: D、胆矾:
-
3、下列表示物质结构的化学用语或模型不正确的是( )A、氮气的结构式: B、分子的球棍模型:
 C、的结构示意图:
C、的结构示意图: D、异丁烷的结构简式:
D、异丁烷的结构简式:
-
4、在粗盐提纯实验中不需要用到的仪器是( )A、烧杯 B、玻璃棒 C、酒精灯 D、坩埚
-
5、下列属于酸性氧化物的是( )A、 B、 C、 D、
-
6、下列设备或物品工作时,将化学能转化为电能的是( )
 A、硅太阳能电池 B、干电池 C、燃气灶 D、太阳能集热器
A、硅太阳能电池 B、干电池 C、燃气灶 D、太阳能集热器 -
7、一种非甾体抗炎药物(H)的合成路线如下(部分反应条件省略):
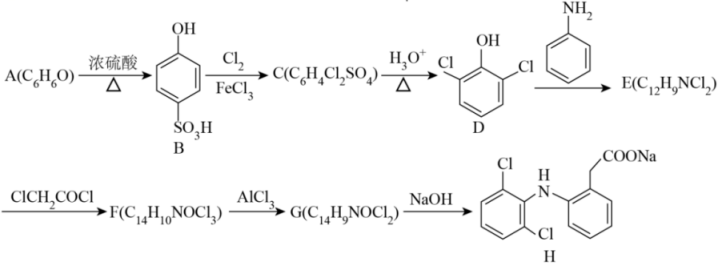
已知:
Ⅰ.

Ⅱ.

回答下列问题:
(1)、物质B中含氧官能团名称。(2)、下列说法正确的是____。A、反应D→E的反应类型是取代反应 B、含物质A的溶液中滴加氯化铁溶液,产生紫色沉淀 C、物质H中最多有13个碳原子共平面 D、设计A→B和C→D两步反应的目的是保护酚羟基的对位氢不被取代(3)、E→F的化学反应方程式为。(4)、G的结构简式为。(5)、符合下列条件G的同分异构体有种,写出其中一种结构简式为。①除
 结构外,不含其他环状结构;
结构外,不含其他环状结构;②含有;
③含有四种化学环境的氢
(6)、已知:。综合上述信息,写出以 和为主要原料制备
和为主要原料制备 的合成路线
的合成路线 -
8、实验室制备苯甲酸(相对分子质量122),提纯及纯度测定步骤如下:
Ⅰ.往圆底烧瓶中加入2.5mL甲苯和140mL水,加热至沸,从仪器A上口(如图)分批加入10.4g 固体,最后用少量水将粘在仪器A内壁的固体冲洗入圆底烧瓶内。

Ⅱ.继续煮沸并间歇性摇动圆底烧瓶,直至甲苯完全反应。
(反应方程式:
 )
)Ⅲ.趁热过滤反应混合物,用少量热水洗涤滤渣,合并滤液和洗涤液,将滤液放在冷水浴中冷却,用浓硫酸酸化,使溶液从强碱性至强酸性,苯甲酸全部析出为止。
Ⅳ.过滤可得粗产品约2g。用重结晶法提纯。
Ⅴ.用碱滴定法测纯度,取0.1000g样品,溶于乙醇中,加入10mL水和2滴酚酞,用0.02mol/L NaOH溶液滴定。
回答下列问题。
(1)、步骤Ⅰ中仪器A的名称是。(2)、步骤Ⅱ加热前需要向圆底烧瓶中加入沸石,目的是。(3)、步骤Ⅲ“趁热过滤反应混合物,用少量热水洗涤滤渣”中使用热水的目的是(4)、步骤Ⅳ中重结晶操作的合理步骤为a→→→→。(步骤不重复)a.加入约100mL水(75℃)配制成热的浓溶液;
b.加半匙活性炭;
c.用少量沸水淋洗烧杯和漏斗中的固体,合并滤液;
d.搅拌下将溶液煮沸3~5min,趁热过滤;
e.冷却结晶,过滤、洗涤、晾干得苯甲酸纯品。
(5)、步骤Ⅴ中测得苯甲酸纯度大于100%的可能原因是 , 因此将该步骤改为中和酸滴定法:称取0.1000g样品,溶于15mL浓度为0.1mol/L NaOH溶液中,加入2滴酚酞作指示剂,用0.1000mol/L盐酸调至红色消失,加入20mL乙醚,10滴溴酚蓝作指示剂,摇匀,用0.1000mol/L盐酸滴定,边滴边将水层和乙醚层充分摇匀使生成的苯甲酸及时被乙醚溶解,水层显淡绿色时为滴定终点,四次滴定平行数据如表,则苯甲酸的纯度为。序号
1
2
3
4
样品质量/g
0.1000
0.1000
0.1000
0.1000
耗酸体积/mL
8.00
8.02
7.98
8.96
-
9、“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国的新名片。(1)、Ⅰ.已知25℃和101kPa下:
①
②
③
表示(l)燃烧热的热化学方程式为。(2)、Ⅱ.和在一定条件下反应可制得合成气,反应方程式: 。该反应在(填“高温”或“低温”)条件下能自发进行。
(3)、下列能判断达到平衡状态的是____。A、一定温度下,容积固定的容器中,密度保持不变 B、容积固定的绝热容器中,温度保持不变 C、一定温度和容积固定的容器中,平均相对分子质量不变 D、和的物质的量之比不再改变(4)、一定条件下,在2L密闭容器中通入和各1mol,反应达到平衡时,测得的物质的量为1mol,则此条件下,该反应的平衡常数为。(5)、Ⅲ.如图所示组成闭合回路,其中甲装置是新型电池,以—为原料,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出。
装置中气体A为(填“”或“和”),a极上的电极反应式为。
-
10、酿酒工业中的食品添加剂 , 通过一系列变化可得重要的无机化合物M(仅含两种元素,且原子个数比为1∶1,相对分子质量为184)。转化关系如下图所示。
 (1)、中硫原子的杂化类型 , 中硫原子的杂化类型。(2)、下列叙述正确的是____。A、是橡胶硫化剂,橡胶硫化程度越高,弹性越好 B、可与发生反应,能作为的脱水剂 C、已知固体中含阳离子和阴离子 , 可以推测空间构型为正四面体 D、易溶于 , 则为非极性分子(3)、与反应的化学方程式。(4)、与反应除生成M外,同时有淡黄色固体和一种盐。则M的分子式为。(5)、设计实验检验与足量NaOH溶液反应生成的阴离子。
(1)、中硫原子的杂化类型 , 中硫原子的杂化类型。(2)、下列叙述正确的是____。A、是橡胶硫化剂,橡胶硫化程度越高,弹性越好 B、可与发生反应,能作为的脱水剂 C、已知固体中含阳离子和阴离子 , 可以推测空间构型为正四面体 D、易溶于 , 则为非极性分子(3)、与反应的化学方程式。(4)、与反应除生成M外,同时有淡黄色固体和一种盐。则M的分子式为。(5)、设计实验检验与足量NaOH溶液反应生成的阴离子。 -
11、铜及其化合物在生产和生活中有着广泛的应用,CuS是常见硫化物。请回答下列问题:(1)、基态铜原子的价层电子排布式。(2)、能与多种物质形成配合物,向溶液中逐滴加入氨水至过量,产生蓝色沉淀,随后溶解并得到深蓝色的溶液,经结晶分离得到深蓝色晶体。
①深蓝色晶体化学式为。
②该实验条件下,与的结合能力(填“>”、“=”或“<”)与的结合能力。
③H—N—H键角大小:(填“>”、“=”或“<”),其原因是。
(3)、已知:晶胞中硫离子的位置如图1所示,铜离子位于硫离子所构成的四面体中心。晶胞的俯视图如图2所示。已知CuS晶胞边长为a pm,阿伏加德罗常数的值为。
图1 图2
①CuS晶体中距离S最近的Cu数目为。
②CuS晶体的密度为(列出计算式即可)。
-
12、根据实验目的设计方案并进行实验,观察到相关现象,其中方案设计或结论正确的是( )
选项
实验目的
方案设计
现象
结论
A
比较和的大小
向悬浊液中加入几滴溶液。
生成蓝色沉淀
B
乙醇消去反应产物检验
向圆底烧瓶中加入无水乙醇和浓硫酸,加热,将产生的气体通入酸性溶液。
溶液褪色
乙醇消去反应的产物含有碳碳双键
C
比较Cl元素与C元素的非金属性
在碳酸钠固体中滴加盐酸
产生无色气体
非金属性:Cl>C
D
检验
向待测溶液中加入稀NaOH溶液,将湿润的红色石蕊试纸放在试管口
试纸不变蓝
该溶液中不含
A、A B、B C、C D、D -
13、室温下,通过矿物中获得的过程如下:

已知: , 。下列说法正确的是( )
A、溶液中: B、“脱硫”后上层清液中: C、悬浊液加入“溶解”过程中,溶液中浓度逐渐减小 D、反应正向讲行,需满足 -
14、与在铜催化剂上的反应机理和能量变化如图所示.下列说法正确的是( )
 A、反应Ⅰ、反应Ⅱ均为放热反应 B、CO分子中键和键数目和相同 C、选择合适的催化剂可降低反应活化能和焓变 D、该反应机理中涉及物质中有两种非极性分子、三种极性分子
A、反应Ⅰ、反应Ⅱ均为放热反应 B、CO分子中键和键数目和相同 C、选择合适的催化剂可降低反应活化能和焓变 D、该反应机理中涉及物质中有两种非极性分子、三种极性分子 -
15、如图所示是一种光电催化体系,该体系在实现烟气脱的同时,获得。下列说法不正确的是( )
 A、该装置将光能和电能转化为化学能 B、交换膜a为阳离子交换膜,b为阴离子交换膜 C、阳极反应为: D、每生成1mol 伴随着1mol 的生成
A、该装置将光能和电能转化为化学能 B、交换膜a为阳离子交换膜,b为阴离子交换膜 C、阳极反应为: D、每生成1mol 伴随着1mol 的生成 -
16、T、W、X、Y、Z是原子序数依次增大的前四周期元素。基态原子中,T有三个能级,各能级电子数相等;X的价层电子排布式为;Y的核外电子填充在8个轨道中;Z有4个未成对电子。下列说法不正确的是( )A、电负性大小:X>W>Y B、最简单氢化物的沸点:W>T>Y C、最高价氧化物对应水化物的酸性:W>T>Y D、Y与W、Z与X均能形成原子个数比为3∶4的化合物
-
17、克拉维酸钾是一种-内酰胺类抗生素,下列说法不正确的是( )
 A、克拉维酸钾存在顺反异构 B、克拉维酸分子含有5种官能团 C、上述转化中的二者均能使酸性溶液褪色 D、实现上述转化可加入KOH溶液
A、克拉维酸钾存在顺反异构 B、克拉维酸分子含有5种官能团 C、上述转化中的二者均能使酸性溶液褪色 D、实现上述转化可加入KOH溶液 -
18、下列化学反应与方程式不正确的是( )A、向冷的石灰乳中通入制漂白粉: B、铝片溶于NaOH溶液,有无色气体产生: C、苯酚钠溶液中通入 , 产生浑浊:
 D、碳酸氢铵溶液和足量氢氧化钠混合加热:
D、碳酸氢铵溶液和足量氢氧化钠混合加热:
-
19、关于有机物检测,下列说法正确的是( )A、用核磁共振氢谱可以鉴别正丁烷和异丁烷 B、用红外光谱可帮助确定有机物分子的相对分子质量 C、往1-溴丁烷中加入硝酸银溶液,检验1-溴丁烷中是否存在溴元素 D、淀粉与稀硫酸共热后加NaOH溶液调至碱性,再加入碘水,可判断淀粉是否完全水解
-
20、下列实验装置使用正确的是( )
 A、图①装置用于测定盐酸浓度 B、图②装置用于灼烧碎海带 C、图③除去中的HCl D、图④装置用于配置一定物质的量浓度的NaOH溶液
A、图①装置用于测定盐酸浓度 B、图②装置用于灼烧碎海带 C、图③除去中的HCl D、图④装置用于配置一定物质的量浓度的NaOH溶液