-
1、“十五”时期,碲化镉(Cde)薄膜电池研究被列入国家高技术研究发展计划(863计划)重点项目。碲化镉太阳能电池较单晶硅太阳能电池有制作方便、成本低廉和重量较轻等优点。下列说法错误的是( )A、和的核外电子数之差为2 B、的中子数比质子数多24个 C、和互为同素异形体 D、硅位于元素周期表中金属元素区与非金属元素区的分界线处,常用作半导体材料
-
2、2023年是我国实施新型基础设施建设的重要时期,在包括5G基站建设、城际高速铁路和城市轨道交通等领域都取得瞩目成就,其中涉及各种化学材料。下列相关说法错误的是( )A、中国自主研发的首个5G微基站射频芯片的主要材料是Si B、高铁动车的车厢厢体由不锈钢和铝合金制成,不锈钢和铝合金均属于金属材料 C、国产飞机C919用到的氮化硅陶瓷是新型无机非金属材料 D、歼-20战斗机在长春航展上完美亮相,其机身采用的碳纤维是有机高分子材料
-
3、下列选项涉及的过程中能实现化学能直接转化为电能的是( )A、水力发电
 B、太阳能发电
B、太阳能发电  C、微生物燃料发电
C、微生物燃料发电 D、电动汽车充电
D、电动汽车充电
-
4、在光照条件下与反应,可得到各种氯代甲烷。取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,并置于光亮处(如图)。回答下列问题:
 (1)、下列说法正确的是____(填字母)。A、反应过程中试管内黄绿色逐渐变浅,试管壁上有油珠产生 B、将该装置放在黑暗处,与也能反应 C、该实验发生了取代反应 D、和完全反应后试管内液面上升,液体充满试管(2)、生成的化学方程式为。(3)、氯代的机理为自由基(带有单电子的原子或原子团,如、)反应,包括以下几步:
(1)、下列说法正确的是____(填字母)。A、反应过程中试管内黄绿色逐渐变浅,试管壁上有油珠产生 B、将该装置放在黑暗处,与也能反应 C、该实验发生了取代反应 D、和完全反应后试管内液面上升,液体充满试管(2)、生成的化学方程式为。(3)、氯代的机理为自由基(带有单电子的原子或原子团,如、)反应,包括以下几步:Ⅰ.链引发
Ⅱ.链传递
Ⅲ.链终止
…
…
①写出由生成过程中链传递的方程式:、。
②已知:25℃、时,中键和中键的键能分别是和。则反应完全反应(填“放出”或“吸收”)热量。
(4)、丙烷氯代反应中链传递的一步反应能量变化如图。
分析上图可知,中键能比
 中键能(填“大”或“小”)。(5)、能说明甲烷是正四面体而非正方形平面结构的是(填序号)。
中键能(填“大”或“小”)。(5)、能说明甲烷是正四面体而非正方形平面结构的是(填序号)。①其一氯取代物不存在同分异构体 ②其二氯取代物不存在同分异构体
-
5、工业上,常用水蒸气通过炽热的焦炭制得水煤气(主要成分为和),其反应的化学方程式为 , 请回答下列问题:(1)、上述反应的能量变化图像如图所示。下列反应的能量变化与上述反应相同的是____。
 A、铝粉与氧化铁的反应 B、氯化铵与的反应 C、锌片与稀硫酸的反应 D、钠与冷水的反应(2)、一定条件下,焦炭和水蒸气在体积一定的密闭容器中进行反应,下列有关说法正确的是____。A、充入使容器压强增大,提高反应速率 B、 , 说明反应达到平衡状态 C、容器中焦炭的质量不再变化,说明反应达到平衡状态 D、容器中水蒸气与氢气的体积比为时,说明反应达到平衡状态(3)、在体积均为的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量炭粉和水蒸气,在不同温度下反应的过程如下图所示:
A、铝粉与氧化铁的反应 B、氯化铵与的反应 C、锌片与稀硫酸的反应 D、钠与冷水的反应(2)、一定条件下,焦炭和水蒸气在体积一定的密闭容器中进行反应,下列有关说法正确的是____。A、充入使容器压强增大,提高反应速率 B、 , 说明反应达到平衡状态 C、容器中焦炭的质量不再变化,说明反应达到平衡状态 D、容器中水蒸气与氢气的体积比为时,说明反应达到平衡状态(3)、在体积均为的甲、乙两个恒容密闭容器中,分别加入相同质量的一定量炭粉和水蒸气,在不同温度下反应的过程如下图所示:
①甲容器中,内的平均反应速率。
②甲容器中,A点正反应速率B点的逆反应速率(填“<”“>”或“=”)。
③反应过程中,两个容器温度:甲乙(填“<” “>”或“=”)。
④乙容器中C点时,的物质的量百分数为。
(4)、在溶液条件下,以为原料,可制成一种燃料电池,写出该电池的负极反应式 , 当燃料电池消耗(标况下)时,正极上有参与反应。 -
6、物质的类别和核心元素的化合价是研究物质性质的两个重要角度。部分含氮物质和含氯物质的价类二维图如下,回答下列问题:
 (1)、关于上述部分物质间转化的说法正确的是____(填字母)。A、a和c可在一定条件下反应生成b B、工业上通过a→b→d→e来制备HNO3 C、浓的a'溶液和浓的c'溶液反应可以得到b' D、a和a'在空气中相遇产生白烟(2)、固氮是将游离态的氮转变为氮的化合物,一种新型人工固氮的原理如图:
(1)、关于上述部分物质间转化的说法正确的是____(填字母)。A、a和c可在一定条件下反应生成b B、工业上通过a→b→d→e来制备HNO3 C、浓的a'溶液和浓的c'溶液反应可以得到b' D、a和a'在空气中相遇产生白烟(2)、固氮是将游离态的氮转变为氮的化合物,一种新型人工固氮的原理如图:
a.该转化过程①②③反应中为氧化还原反应(填编号)。
b.参与该人工固氮转化的物质中含有的化学键类型有(填字母)。
A.离子键 B.极性键 C.非极性键 D.氢键
c.假设每一步均完全转化,每生成1 mol NH3 , 同时生成molO2。
(3)、在常温下铁、铜与e的浓溶液组成原电池。①请在下面方框中画出该原电池的装置图。要求:注明电解质溶液名称、正负极材料,并标出电子移动方向。

②写出该电池总反应式和负极反应式:电池总反应式:;负极反应式:。
(4)、由氮和氯组成的一种二元化合物分子中,各原子最外层均达到8电子的稳定结构,该液态化合物遇水可生成一种具有漂白性的化合物,试写出该反应的化学方程式:。 -
7、某化学兴趣小组对与的产物进行了探究.
同学们经过讨论,提出了如下猜想:
猜想1:产物为和
猜想2:产物为
甲同学设计如图所示实验装置(夹持装置已省略)制备并进行实验探究,请回答下列问题:
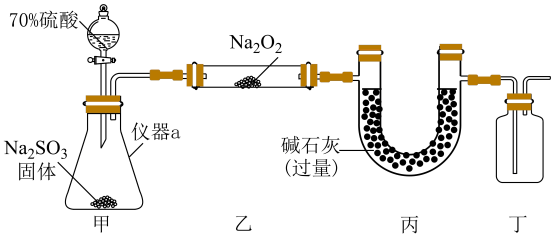 (1)、仪器a的名称为;打开分液漏斗活塞,装置甲中发生反应的离子方程式为;使用70%的硫酸而不用98%的硫酸的原因是 .(2)、①甲同学用带火星的木条检验出丁中收集的气体为氧气,该同学认为猜想1正确,乙同学分析装置后推翻了甲同学的结论,乙同学的理由可能是 , 乙同学对实验装置进行了改进,在装置甲和装置乙之间添加了装置戊,装置戊可能是(填标号).
(1)、仪器a的名称为;打开分液漏斗活塞,装置甲中发生反应的离子方程式为;使用70%的硫酸而不用98%的硫酸的原因是 .(2)、①甲同学用带火星的木条检验出丁中收集的气体为氧气,该同学认为猜想1正确,乙同学分析装置后推翻了甲同学的结论,乙同学的理由可能是 , 乙同学对实验装置进行了改进,在装置甲和装置乙之间添加了装置戊,装置戊可能是(填标号).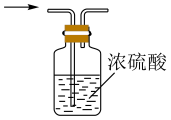
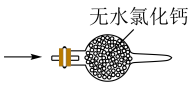
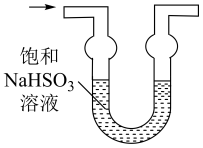
A
B
C
D
②改进实验装置后,丙同学在乙处硬质玻璃管内淡黄色固体全部变成白色后,取适量反应后的白色固体a于试管i中,加入适量的稀硫酸,有气泡产生,将产生的气体通入适量酸性高锰酸钾溶液b中,溶液b褪色,说明固体a中含有(填化学式),溶液b褪色的离子方程式为;另取适量固体a于试管ii中,加入足量的稀盐酸酸化,充分反应后,加入适量的溶液,观察到有白色沉淀产生,该白色沉淀为(填化学式)。
实验结论:与在常温时就能发生化学反应,生成(填化学式)和 .
-
8、下列有关离子检验的叙述正确的是( )
选项
操作及现象
结论
A
少量溶液于试管中,滴加BaCl2溶液,有白色沉淀生成,加稀硝酸沉淀不溶解
溶液中含有Ag+或SO42-
B
取少量溶液于试管中,滴加新制氯水,溶液由无色变为黄色
溶液中含有Br-
C
取少量溶液于试管中,滴加浓氢氧化钠溶液,微热,试管口湿润的红色石蕊试纸变蓝
溶液中含有NH4+
D
取少量溶液于试管中,滴加新制氯水后再滴加KSCN溶液,溶液变红色
原溶液中含有Fe2+
A、A B、B C、C D、D -
9、现用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理。下列说法正确的是( )
 A、制取氨气时烧瓶中的固体常用 B、将湿润的蓝色石蕊试纸置于三颈烧瓶瓶口,试纸变红,说明已经充满 C、关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内压强变化曲线如图2,则B点时喷泉最剧烈 D、若实验是在0℃、常压条件下完成,则在E点烧瓶中溶液溶质的物质的量浓度为
A、制取氨气时烧瓶中的固体常用 B、将湿润的蓝色石蕊试纸置于三颈烧瓶瓶口,试纸变红,说明已经充满 C、关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内压强变化曲线如图2,则B点时喷泉最剧烈 D、若实验是在0℃、常压条件下完成,则在E点烧瓶中溶液溶质的物质的量浓度为 -
10、化学电源在日常生活中有广泛应用。下列说法正确的是( )
 A、图I所示装置工作时,电子由锌片经浸有稀硫酸的滤纸流向铜片 B、图II干电池为一次电池,工作时做还原剂 C、图III铅蓄电池是二次电池,工作时负极反应为 D、图IV氢氧燃料电池中正极反应为
A、图I所示装置工作时,电子由锌片经浸有稀硫酸的滤纸流向铜片 B、图II干电池为一次电池,工作时做还原剂 C、图III铅蓄电池是二次电池,工作时负极反应为 D、图IV氢氧燃料电池中正极反应为 -
11、锂(Li)—空气电池的工作原理如图所示下列说法不正确的是( )
 A、金属锂作负极,发生氧化反应 B、Li+通过有机电解质向水溶液处移动 C、正极的电极反应:O2+4e-=2O2- D、电池总反应:4Li+O2+2H2O=4LiOH
A、金属锂作负极,发生氧化反应 B、Li+通过有机电解质向水溶液处移动 C、正极的电极反应:O2+4e-=2O2- D、电池总反应:4Li+O2+2H2O=4LiOH -
12、常温下把体积相同的甲烷和氯气充入一个无色的集气瓶中,光照一段时间后,发现气体的黄绿色变浅,集气瓶上有淡黄绿色液滴,此时集气瓶中最多含有气体物质的种数是 ( )A、5种 B、6种 C、4种 D、3种
-
13、在密闭容器、800℃时的反应:体系中,随时间的变化如下表:
时间(s)
0
1
2
3
4
5
0.020
0.010
0.008
0.007
0.007
0.007
各物质的物质的量浓度随时间的变化关系如下图:

下列说法正确的是( )
A、如图中A点处,v(正)等于v(逆) B、图中表示NO2的变化的曲线是a C、及时分离出NO2气体能使该反应的反应速率增大 D、用O2表示从内该反应的平均速率 -
14、工业制硫酸中的一步重要反应是SO2在400-500℃和常压下的催化氧化: 2SO2+ O2 2SO3 , 这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述相关说法中错误的是( )A、反应温度选择400-500℃是该反应催化剂的催化活性、反应速率、反应限度等角度综合考虑的结果 B、因为在常压下该反应的速率和SO2的转化率已经很高了,所以选择常压条件主要是从生产成本角度考虑 C、为提高SO2的转化率,应适当提高O2的浓度 D、使用催化剂是为了加快反应速率,提高SO3产率
-
15、如图所示是硫元素的“价类二维图”。图中箭头表示的物质间转化均能一步完成,a、g的焰色反应均为黄色。下列说法正确的是( )
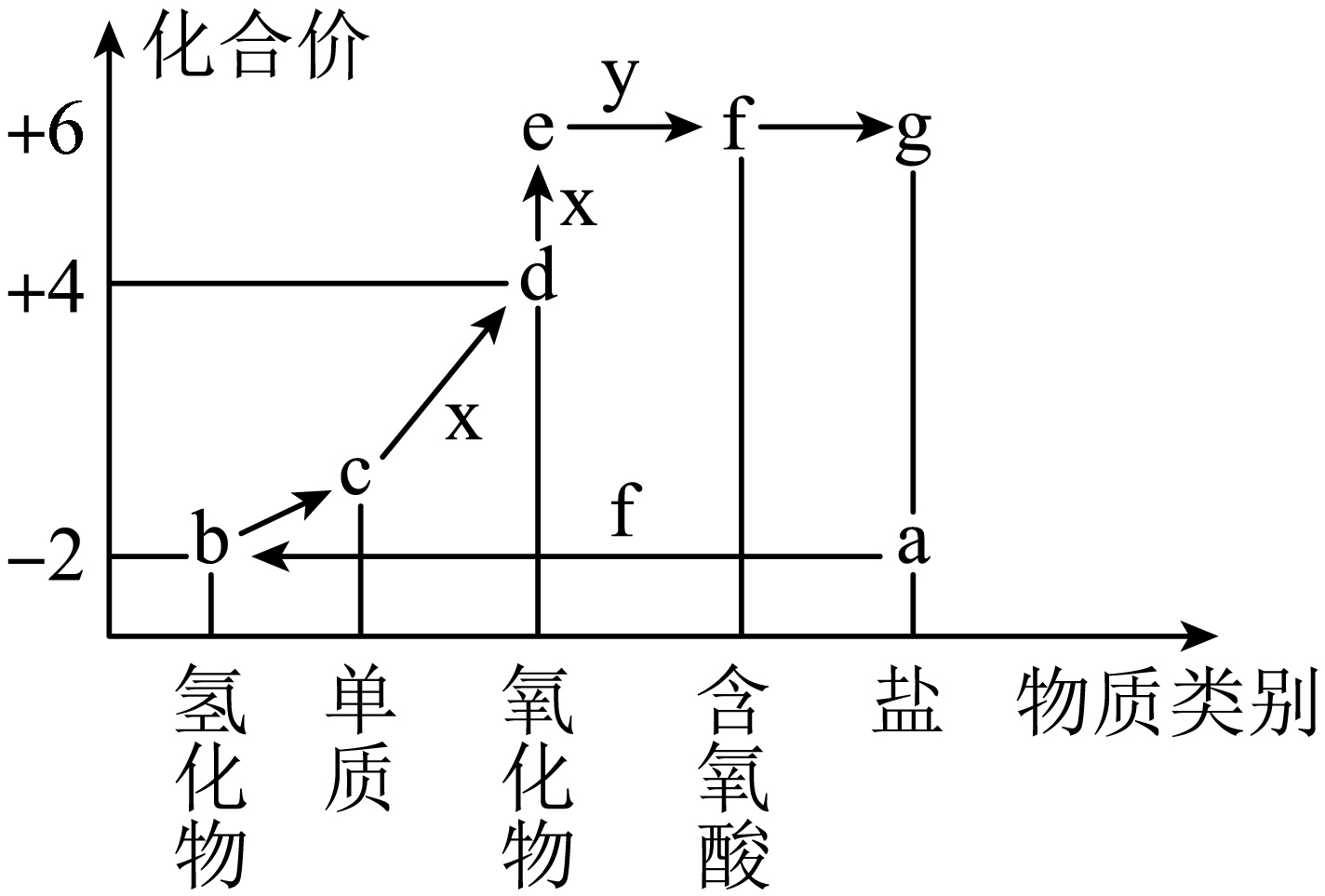 A、b通入FeSO4溶液中无明显现象 B、单质c易溶于水和酒精 C、d能使湿润的蓝色石蕊试纸先变红后褪色 D、实验室可用f的浓溶液与NaI反应制取HI气体
A、b通入FeSO4溶液中无明显现象 B、单质c易溶于水和酒精 C、d能使湿润的蓝色石蕊试纸先变红后褪色 D、实验室可用f的浓溶液与NaI反应制取HI气体 -
16、中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如下图所示。

已知:几种物质中化学键的键能如下表所示:
化学键
H—O键
O=O键
H—H键
O—O键
键能/(kJ/mol)
463
496
436
138
若反应过程中分解了2 mol H2O,则下列说法不正确的是( )
A、总反应为2H2O2H2↑+O2↑ B、过程Ⅰ吸收了926 kJ能量 C、过程Ⅱ放出了574 kJ能量 D、过程Ⅲ属于放热反应 -
17、下列表述Ⅰ、Ⅱ均正确并且有因果关系的是( )
选项
表述Ⅰ
表述Ⅱ
A
SO2具有漂白性
SO2能使酸性KMnO4溶液褪色
B
SiO2具有弱氧化性
工业上利用SiO2与焦炭制备粗硅
C
NH3是电解质
NH3的水溶液可以导电
D
浓硫酸具有吸水性
可用来干燥H2S气体
A、A B、B C、C D、D -
18、下列关于甲烷的叙述中错误的是( )A、甲烷分子具有正四面体结构,两个碳氢键之间的夹角为109°28' B、甲烷分子中两个氢原子被氯取代后,可形成两种不同结构的分子 C、甲烷是重要的化工原料,其分解产物可用于合成氨和橡胶工业 D、“抽”出坑道中的甲烷,既可用作清洁燃料,又可防止爆炸
-
19、无机非金属材料中,硅一直扮演着重要的角色。下列有关硅及其化合物的说法中正确的是( )A、最外层有四个电子,位于元素周期表的第三周期第VA族 B、是酸性氧化物,可以与水反应: C、硅在自然界主要以硅酸盐和氧化物的形式存在 D、碳化硅具有优异的耐高温性能是因为碳原子和硅原子通过离子键连接,硬度很大
-
20、化学知识无处不在,下列与古诗文记载对应的化学知识不正确的是( )
常见古诗文记载
化学知识
A
《泉州府志》:元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之。
泥土具有吸附作用,能将红糖变白糖
B
《荀子·劝学》:冰水为之,而寒于水。
冰的能量低于水,冰变为水属于吸热反应
C
《本草纲目》:采蒿蓼之属,晒干烧灰,以原水淋汁,久则凝淀如石(石碱),浣衣发面。
石碱具有碱性,遇酸产生气体
D
《天工开物》:凡研硝(KNO3)不以铁碾入石臼,相激火生,祸不可测。
性质不稳定,撞击易爆炸
A、A B、B C、C D、D