-
1、“侯氏制碱法是我国化工专家侯德榜为世界制碱工业作出的突出贡献。“侯氏制碱法”是将二氧化碳通入含有氨气的饱和溶液中,结晶、过滤得到晶体,加热分解制得。下列关于和说法不正确的是( )A、用澄清石灰水鉴别和 B、相同温度下,向同浓度和溶液中分别滴加几滴酚酞,溶液的红色较深 C、相同温度下,相同浓度和溶液分别与的稀盐酸反应,较剧烈 D、固体中含有少量杂质,可通过加热的方法除去
-
2、关于以下实验装置,说法不正确的是( )
 A、用装置A盛装NH4Cl粉末来制取氨气,并用向下排气法收集 B、装置B既可以防止倒吸,又可以检查实验时装置B后的装置是否发生堵塞 C、装置C、F中盛装的试剂分别为浓硫酸、碱石灰,装置C用来除去Cl2中的水蒸气,装置F用来防止空气中的水蒸气进入装置E D、装置D中的产物受热易升华,最好用粗短导管连接装置D、E
A、用装置A盛装NH4Cl粉末来制取氨气,并用向下排气法收集 B、装置B既可以防止倒吸,又可以检查实验时装置B后的装置是否发生堵塞 C、装置C、F中盛装的试剂分别为浓硫酸、碱石灰,装置C用来除去Cl2中的水蒸气,装置F用来防止空气中的水蒸气进入装置E D、装置D中的产物受热易升华,最好用粗短导管连接装置D、E -
3、下表是各物质及其所含的少量杂质,以及除去这些杂质所选用的试剂或操作方法,其中不正确的是( )
选项
物质
杂质
除杂试剂或操作方法
A
FeCl2溶液
FeCl3
加入过量铁粉,再过滤
B
NaHCO3溶液
Na2CO3
通入过量的CO2气体
C
NaNO3溶液
Na2SO4
加入适量的BaCl2溶液,再过滤
D
MgO固体
Al2O3
加入过量的NaOH溶液,再过滤
A、A B、B C、C D、D -
4、下图为铁元素的价类二维图,其中的箭头表示部分物质间的转化关系,下列说法正确的是( )
 A、铁与高温水蒸气的反应可实现上述转化① B、不稳定,在空气中受热,迅速发生转化② C、中加稀(强氧化剂)可实现转化⑦ D、加热发生转化⑥,但加水不能转化为
A、铁与高温水蒸气的反应可实现上述转化① B、不稳定,在空气中受热,迅速发生转化② C、中加稀(强氧化剂)可实现转化⑦ D、加热发生转化⑥,但加水不能转化为 -
5、一种用作锂离子电池电解液的锂盐的阴离子结构如图所示,X、Y、Z、W为原子序数依次增大的短周期主族元素,W的核外电子中有3个未成对电子。下列说法正确的是( )
 A、W元素最高价氧化物对应的水化物是强酸 B、该阴离子中不存在非极性键 C、X的氢化物沸点可能高于Z的氢化物 D、该离子中所有原子最外层均为8电子结构
A、W元素最高价氧化物对应的水化物是强酸 B、该阴离子中不存在非极性键 C、X的氢化物沸点可能高于Z的氢化物 D、该离子中所有原子最外层均为8电子结构 -
6、如图所示为元素周期表的一部分,其中X、Y、Z、W为四种短周期元素。Z元素原子核外K层与M层上的电子数相等。下列说法中正确的是( )
 A、Y元素的最高价氧化物对应的水化物的化学式为 B、最高价氧化物对应水化物的酸性: C、原子半径由小到大的顺序为 D、X、Z两种元素的氧化物中所含化学键的类型相同
A、Y元素的最高价氧化物对应的水化物的化学式为 B、最高价氧化物对应水化物的酸性: C、原子半径由小到大的顺序为 D、X、Z两种元素的氧化物中所含化学键的类型相同 -
7、实验室配制的溶液,下列说法错误的是( )A、称量时,若将固体置于托盘天平右盘,将导致所配溶液浓度偏小 B、将固体置于烧杯中溶解,冷却至室温后转移到容量瓶中 C、定容时仰视刻度线,会使所配溶液浓度偏小 D、定容摇匀后发现液面低于刻度线,应再滴加蒸馏水至刻度线
-
8、表示阿伏加德罗常数的值,下列说法正确的是( )A、金属镁变成镁离子时失去的电子数为 B、物质的量浓度为的溶液中,含有个数为 C、常温常压下,氯气所含原子数目为 D、中含有的电子数为
-
9、下列有关化学用语表示正确的是( )A、氯化镁的电子式:
 B、溶于水的电离方程式:
C、次氯酸的结构式:
D、氧离子(O2-)结构示意图:
B、溶于水的电离方程式:
C、次氯酸的结构式:
D、氧离子(O2-)结构示意图:
-
10、金属钛对人体体液无毒且能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关和的说法正确的是( )A、和的质子数相同,互为同位素 B、和的质量数不同,属于两种元素 C、和的质子数相同,是同一种核素 D、和的质子数相同,中子数不同,互为同素异形体
-
11、关于一些重要的化学概念,下列叙述错误的个数是( )
①CO2、CO、SO2均为酸性氧化物
②盐酸、NaOH溶液、NaCl固体均能导电
③能电离出H+的物质不一定是酸,酸的元数不一定等于所含的氢原子个数
④需要通电才可进行的有:电解、电泳、电离
⑤盐酸、亚硫酸、氯气分别为强电解质、弱电解质和非电解质
A、2个 B、3个 C、4个 D、5个 -
12、某含锰废料中主要含MnCO3及少量的FeCO3、SiO2、Cu2(OH)2CO3 , 以此为原料制备MnO2的流程如下:
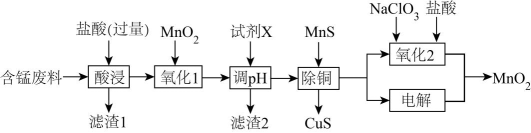
Ⅰ.氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物
Mn(OH)2
Fe(OH)2
Fe(OH)3
Cu(OH)2
开始沉淀时pH
8.3
6.3
2.7
4.7
完全沉淀时pH
9.8
8.3
3.7
6.7
Ⅱ.常温下Ksp(MnS)=2.0×10-10、Ksp(CuS)=6.0×10-36。
回答下列问题:
(1)、滤渣1的主要成分是(填化学式)。(2)、“氧化1”的目的是(用离子方程式表示)。(3)、“调pH”时,试剂X为(任写一种),pH的调节范围为。(4)、“除铜”时,当溶液中c(Mn2+)=12mol·L-1 , 溶液中c(Cu2+)=。(5)、“氧化2”制备MnO2 (恰好完全反应)时,n(Mn2+):n(ClO)=( ClO→Cl-);“电解”制备MnO2的阳极电极反应式为。 -
13、是存在于燃气中的一种有害气体,脱除的方法有多种。回答下列问题:(1)、Claus氧化回收硫的反应原理为:
① ;
② ;
③ 。
则。
(2)、化学反应的焓变与反应物和生成物的键能(气态分子中化学键解离成气态原子所吸收的能量)有关。已知某些化学键的键能如下表所示:共价键
键能
339
246
120
结合(1)中反应原理,。
(3)、电解法治理是先用溶液吸收含的工业废气,所得溶液用情性电极电解,阳极区所得溶液循环利用。
①进入电解池的溶液中,溶质是(填化学式)。
②阳极的电极反应式为。
(4)、工业上采用高温热分解的方法制取 , 在膜反应器中分离出。下,分解:。保持压强不变,反应达到平衡时,气体的体积分数随温度的变化曲线如图:
①在密闭容器中,关于上述反应的说法正确的是 (填字母)。
A.随温度的升高而增大
B.低压有利于提高的平衡分解率
C.维持温度、气体总压强不变时,向平衡体系中通入氩气,则v(正)<v(逆)
D.在恒容密闭容器中进行反应,当气体密度不再变化时,反应达到平衡状态
②图中点:的平衡转化率为;时,反应的(为以分压表示的平衡常数,分压=总压×物质的量分数)。
-
14、已知A、B、C、D、E为原子序数依次增大的短周期主族元素。其中A元素的一种同位素中没有中子,B元素原子的L层电子数是K层电子数的2倍,D元素是地壳中含量最多的元素,E的原子序数是A、C原子序数之和的2倍。回答下列问题:(1)、分子中键和键数目比为;是由极性键和非极性键形成的(填“极性”或“非极性”)分子。(2)、A与C可形成一种原子个数比为的六原子分子,其结构式为 , 其中C原子的杂化方式为。(3)、的VSEPR模型名称为 , 其属于(填“极性”或“非极性”)分子。(4)、基态E原子的价层电子排布式为 , 其最高价氧化物对应的水化物的化学式为。(5)、的沸点比的沸点低,其主要原因是。
-
15、化学是一门以实验为基础的学科。回答下列问题:(1)、Ⅰ.某同学设计如图所示实验,探究反应中的能量变化。
()所涉及的反应为(填“放”或“吸”)热反应,将实验()中的铝片更换为等质量的铝粉后,释放出的热量(填“增加”“减少”或“不变”)。 (2)、从实验装置()上看,图中尚缺少的一种仪器是。实验()为稀盐酸和氢氧化钠稀溶液反应测定反应热,反应物的用量理论上对中和反应反应热的测定(填“有”或“无”)影响;用相同浓度和体积的氨水代替溶液进行上述实验,测得的中和反应反应热的数值()会(填“偏大”“偏小”或“无影响”)。(3)、Ⅱ.用广谱高效的二氧化氯()替代液氯进行消毒,可避免产生对人体健康有害的有机氯代物。化学小组欲对用消毒过的自来水进行氯元素含量的测定(假设全部转化为),进行如下实验:向水样中加几滴溶液,用的溶液滴定(已知和可反应生成砖红色沉淀)。
(2)、从实验装置()上看,图中尚缺少的一种仪器是。实验()为稀盐酸和氢氧化钠稀溶液反应测定反应热,反应物的用量理论上对中和反应反应热的测定(填“有”或“无”)影响;用相同浓度和体积的氨水代替溶液进行上述实验,测得的中和反应反应热的数值()会(填“偏大”“偏小”或“无影响”)。(3)、Ⅱ.用广谱高效的二氧化氯()替代液氯进行消毒,可避免产生对人体健康有害的有机氯代物。化学小组欲对用消毒过的自来水进行氯元素含量的测定(假设全部转化为),进行如下实验:向水样中加几滴溶液,用的溶液滴定(已知和可反应生成砖红色沉淀)。在规格为的滴定管中,若溶液的起始读数是 , 则此时滴定管中溶液的实际体积为____(填字母)。
A、 B、小于 C、 D、大于(4)、如图所示,排去碱式滴定管中气泡的方法应采用操作(填“甲”“乙”或“丙”),然后轻轻挤压玻璃球使尖嘴部分充满碱液。 (5)、滴定过程如下:
(5)、滴定过程如下:①在清水洗涤后,用标准溶液润洗滴定管次
②取标准液注入滴定管至刻度线0处,并固定在铁架台上
③排气泡后,记下读数
④移取待测水样注入洁净的锥形瓶中,并加入滴试液
⑤把锥形瓶放在滴定管的下面,垫上白纸
⑥时,停止滴定,并记下滴定管液面的刻度
(6)、重复实验2次将操作⑥补充完整:。
下列操作或误差判断不正确的是(填字母)。
A.滴定过程中,眼睛始终注视锥形瓶中溶液颜色的变化
B.锥形瓶清洗后需要用待测水样润洗次
C.滴定完成后,俯视滴定管读数,会造成滴定结果偏高
D.若滴定结束发现滴定管中出现气泡,则使结果偏低
-
16、常温下,用某未知浓度的溶液滴定溶液,滴定曲线如图所示,c点溶液中,。下列说法错误的是( )
 A、c点为反应终点 B、该溶液的物质的量浓度为 C、b点溶液中, D、a点溶液中,
A、c点为反应终点 B、该溶液的物质的量浓度为 C、b点溶液中, D、a点溶液中, -
17、某温度下,2L容积不变的密闭容器中与反应生成 , 反应过程中X、Y、Z的物质的量变化如图1所示。保持其他条件不变,温度分别为和时,Z的体积百分含量与时间的关系如图2所示。下列结论错误的是( )
 A、反应的前3min内,用X表示的反应速率 B、容器中发生的反应可表示为: C、保持其他条件不变,升高温度,化学平衡向正反应方向移动 D、若改变反应条件,反应进程如图3所示,则改变的条件是使用催化剂
A、反应的前3min内,用X表示的反应速率 B、容器中发生的反应可表示为: C、保持其他条件不变,升高温度,化学平衡向正反应方向移动 D、若改变反应条件,反应进程如图3所示,则改变的条件是使用催化剂 -
18、如图为阳离子交换膜法以石墨为电极电解饱和溶液的原理示意图。已知溶液从A口进料,含少量的水从B口进料,下列说法错误的是( )
 A、阳极发生氧化反应,有氧气生成 B、电路中转移电子时,阳极区有生成 C、从D出口流出的是较浓的溶液 D、从E出口逸出的气体是
A、阳极发生氧化反应,有氧气生成 B、电路中转移电子时,阳极区有生成 C、从D出口流出的是较浓的溶液 D、从E出口逸出的气体是 -
19、磷化氢()是一种无色剧毒,有类似大蒜气味的气体,微溶于冷水。下列关于的叙述错误的是( )A、分子中有未成键的电子对 B、是非极性分子 C、分子结构为三角锥形 D、不能与水形成分子间氢键
-
20、常温下,在水中的沉淀溶解平衡曲线如图所示,已知常温下。下列说法正确的是( )
 A、升高温度曲线会往右上方移动 B、d点表示的过饱和溶液,b点表示的不饱和溶液 C、b点加水可以变到如图的曲线上,且此时的 D、加入 , 可以使溶液由c点变到a点
A、升高温度曲线会往右上方移动 B、d点表示的过饱和溶液,b点表示的不饱和溶液 C、b点加水可以变到如图的曲线上,且此时的 D、加入 , 可以使溶液由c点变到a点