-
1、下列化学用语表述正确的是( )A、的电子式:
 B、中子数为10的氧原子:
C、分子的VSEPR模型:
B、中子数为10的氧原子:
C、分子的VSEPR模型: D、基态原子的价层电子轨道表示式为
D、基态原子的价层电子轨道表示式为
-
2、近年来甲醇用途日益广泛,越来越引起商家的关注。工业上甲醇的合成途径多种多样。现在实验室中模拟甲醇合成反应,在2L密闭容器内,400℃时发生反应CO(g)+2H2(g)CH3OH(g),体系中n(CO)随时间的变化如表:
时间/s
0
1
2
3
5
n(CO)/mol
0.020
0.011
0.008
0.007
0.007
(1)、图甲中表示CH3OH的变化的曲线是(填字母)。 (2)、下列措施不能提高反应速率的有(填字母,下同)。
(2)、下列措施不能提高反应速率的有(填字母,下同)。a.升高温度 b.加入催化剂
c.减小压强 d.及时分离出CH3OH
(3)、下列叙述能说明反应达到平衡状态的是。a.CO和H2的浓度保持不变
b.v(H2)=2v(CO)
c.CO的物质的量分数保持不变
d.容器内气体密度保持不变
e.每生成1molCH3OH的同时有2molH-H断裂
(4)、现有如下两个反应:A.NaOH+HCl=NaCl+H2O,B.Cu+2Ag+=2Ag+Cu2+。①根据上述两反应的本质,能设计成原电池的是(填字母)。
②将上述反应中能设计成原电池的反应设计成原电池。
I.写出负极的电极反应式 , 反应类型为。
II.画出装置图并标明电极材料与名称、电解质溶液、电子流向。

-
3、现有金属A、B、C,化合物D、E、F、G、H和气体甲、乙、丙,其转化关系如图所示。
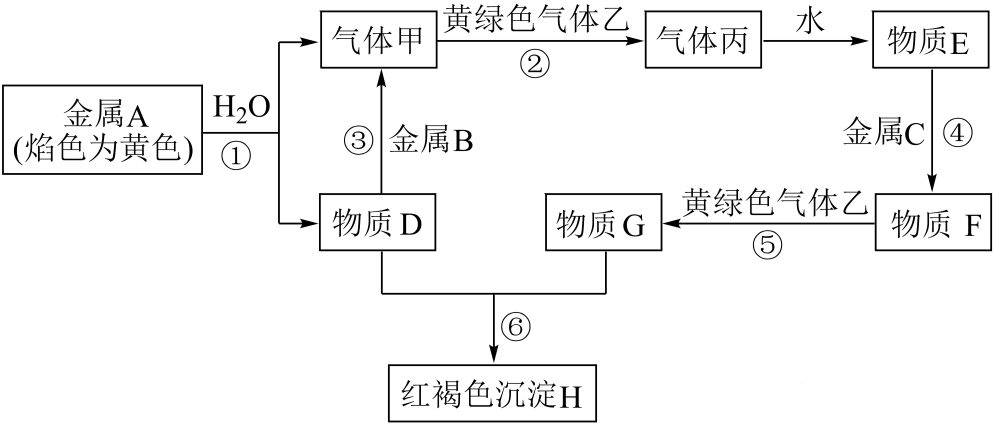
请回答下列问题:
(1)、丙的电子式为。(2)、反应①的离子方程式为 , 每生成0.5mol的甲时,转移电子数为。(3)、向F溶液中滴加NaOH溶液的现象是 , 写出其中属于氧化还原反应的化学方程式。(4)、G溶液常用于腐蚀覆盖同印刷电路板,请写出相关反应的离子方程式。 -
4、如表列出了9种元素在元素周期表(元素周期表中给出部分)中的位置。

请回答下列问题:
(1)、考古工作者利用某元素的一种核素测定一些文物的年代,这种核素的符号是。(2)、画出元素⑧形成的简单离子的结构示意图:。(3)、元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物反应的离子方程式为。(4)、元素②③④⑤⑧⑨与元素①形成的最简单化合物中稳定性最强的是(填化学式)。(5)、元素⑦和⑧形成化合物的化学键类型为。(6)、用电子式表示元素⑥和⑨形成化合物的过程。 -
5、某学习小组在实验室制备氯化铁并配制其溶液,过程如下。
【制备无水FeCl3】无水FeCl3是一种常见的化工原料,易升华,在空气中极易吸水,可利用以下实验装置制备。
 (1)、按气流方向,连接顺序为a→→j→k→f→g→b→c(填仪器连接口的字母编号)。(2)、装置B的作用是。(3)、A中发生的离子反应为。(4)、【配制FeCl3溶液】
(1)、按气流方向,连接顺序为a→→j→k→f→g→b→c(填仪器连接口的字母编号)。(2)、装置B的作用是。(3)、A中发生的离子反应为。(4)、【配制FeCl3溶液】配置100mL0.5mol/LFeCl3溶液,需用量筒量取5.0mol/LFeCl3溶液mL,还需要的仪器有烧杯、玻璃棒、。
(5)、下列实验操作对所配制的FeCl3溶液物质的量浓度有何影响?(填“偏大”“偏小”或“无影响”)①定容时,俯视刻度线:。
②未洗涤烧杯及玻璃棒:。
-
6、下列实验中,对应的操作、现象以及结论都正确的是( )
选项
操作
现象
结论
A
干燥氯气通入装有鲜花的集气瓶中
鲜花褪色
氯气有漂白性
B
将KI溶液滴加到酸性KMnO4溶液中,边加边振荡
溶液褪色
KI具有还原性
C
向某溶液中先加入BaCl2溶液,再加入稀硝酸
产生白色沉淀
该溶液中一定含有SO
D
向某溶液中加入NaOH溶液
产生气泡
该溶液中一定含有NH
A、A B、B C、C D、D -
7、下列离子方程式不正确的是( )A、Cl2与H2O反应:Cl2+H2OH++Cl-+HClO B、Na2O2溶于足量水中:2Na2O2+2H2O=4Na++4OH-+O2↑ C、Cu与FeCl3反应:Cu+2Fe3+=2Fe2++Cu2+ D、稀HNO3与过量Fe反应:Fe+4H++NO=Fe3++NO↑+2H2O
-
8、硅是带来人类文明的重要元素之一,科学家也提出硅是“21世纪的能源”。这主要是由于硅及其化合物对社会发展所起的巨大促进作用。下列关于硅及其化合物的说法中错误的是( )A、传统无机非金属材料是指玻璃、水泥、陶瓷等硅酸盐材料 B、高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” C、陶瓷、玻璃、水泥容器均不能贮存氢氟酸 D、传统无机非金属材料和新型无机非金属材料的主要成分都是硅酸盐
-
9、室温下,下列各组离子在指定溶液中能大量共存的是( )A、使酚酞试液变红的溶液:Na+、Cl-、SO、Fe3+ B、碳酸氢钠溶液:K+、SO、Cl-、H+ C、加入铝粉放出H2的溶液:K+、Na+、SO、Cl- D、硫酸溶液:NH、Na+、MnO、Cl-
-
10、下列各组气体中均能用如图装置进行喷泉实验的是( )
 A、HCl和CO2 B、NH3和CO C、O2和CO2 D、NO2和NO
A、HCl和CO2 B、NH3和CO C、O2和CO2 D、NO2和NO -
11、设NA为阿伏加德罗常数的值,则下列说法正确的是( )A、0.2mol•L-1的Na2SO4溶液中含Na+数目为0.4NA B、在氧化还原反应中,反应掉1molCl2时转移电子数目一定为2NA C、标况下,2.24L水中含有的电子数目为NA D、常温常压下,22g二氧化碳中含有的原子数目为1.5NA
-
12、下列物质的分类组合正确的是( )
A
B
C
D
化合物
HCl
NaOH
Cu2(OH)2CO3
FeSO4·7H2O
氧化物
H2O
Na2O
CO
Fe3O4
电解质
浓盐酸
纯碱晶体
胆矾溶液
铁
A、A B、B C、C D、D -
13、C、N、S的氧化物中许多是工业上重要的化工原料,但是当它们分散到空气中时,会带来很多环境问题。下列有关这些元素的氧化物说法不正确的是( )A、开发太阳能、水能、风能、氢能等新能源将有利于减少这些元素的氧化物的产生 B、N与S的某些氧化物能直接危害人的身体健康,引发呼吸道疾病 C、“温室效应”与二氧化碳的排放有着直接的关系 D、这些氧化物使雨水的 , 我们把的雨水称之为酸雨
-
14、下列化学用语不正确的是( )A、的原子结构示意图是:
 B、的电子式是:
B、的电子式是: C、的分子结构模型是:
C、的分子结构模型是: D、的形成过程是:
D、的形成过程是:
-
15、2023年10月1日,天安门广场举行庆祝中华人民共和国成立74周年升旗仪式。下列说法不正确的是( )A、天安门城楼所涂的红色颜料,主要成分为 B、清晨第一缕阳光光芒万丈,该现象为丁达尔效应 C、庆祝节日燃放了五彩的烟花,其色彩来自碱金属及锶、钡等金属元素的焰色 D、国旗杆材料是高碳钢无缝钢管,属于金属材料
-
16、下列古诗文或记载中隐含化学变化且不属于氧化还原反应的是( )A、熬胆矾铁釜,久之亦化为铜 B、爆竹声中一岁除,春风送暖入屠苏 C、凡炉中炽铁用炭,煤炭居十七,木炭居十三 D、千锤万凿出深山,烈火焚烧若等闲
-
17、化合物M(奥司他韦)是目前治疗流感的最常用药物之一,其合成路线如下:

已知:的结构简式为

回答下列问题:
(1)、M中不含氧的官能团的名称是。(2)、有机物C的结构简式为。(3)、E与NaOH溶液共热的化学方程式为。(4)、的核磁共振氢谱有组峰。(5)、G→H的反应类型是。(6)、B有多种同分异构体,同时满足下列条件的同分异构体共有种(不考虑立体异构)。a.分子结构中含有
b.能与溶液发生反应产生气体
(7)、参照上述合成路线,以和 为原料设计合成
为原料设计合成 的路线(其它试剂任选)。
的路线(其它试剂任选)。 -
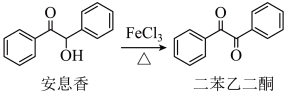
18、实验室由安息香制备二苯乙二酮的反应式如下:
相关信息列表如下:
物质
性状
熔点/℃
沸点/℃
溶解性
安息香
白色固体
133
344
难溶于冷水
溶于热水、乙醇、乙酸
二苯乙二酮
淡黄色固体
95
347
不溶于水
溶于乙醇、苯、乙酸
冰乙酸
无色液体
17
118
与水、乙醇互溶
装置示意图如下图所示,实验步骤为:
①在圆底烧瓶中加入10mL冰乙酸、5mL水及9.0g FeCl3∙6H2O,边搅拌边加热,至固体全部溶解。②停止加热,待沸腾平息后加入2.0g安息香,加热回流45~60min。
③加入50mL水,煮沸后冷却,有黄色固体析出。
④过滤,并用冷水洗涤固体3次,得到粗品
⑤粗品用75%的乙醇重结晶,干燥后得淡黄色结晶1.6g。

回答下列问题:
(1)、仪器A中应加入(填“水”或“油”)作为热传导介质。(2)、仪器B的名称是;冷却水应从(填“a”或“b”)口通入。(3)、实验步骤②中,安息香必须待沸腾平息后方可加入,其主要目的是。(4)、在本实验中,FeCl3为氧化剂且过量,其还原产物为;某同学尝试改进本实验:采用催化量的FeCl3并通入空气制备二苯乙二酮。该方案是否可行?简述判断理由。(5)、若粗品中混有少量未氧化的安息香,可用少量洗涤的方法除去(填标号)。若要得到更高纯度的产品,可用重结晶的方法进一步提纯。a.热水 b.乙酸 c.冷水 d.乙醇
(6)、本实验的产率最接近于(填标号)。a.85% b.80% c.75% d.70%
-
19、某工厂采用辉铋矿(主要成分为 , 含有、杂质)与软锰矿(主要成分为)联合焙烧法制备和 , 工艺流程如下:

已知:①焙烧时过量的分解为 , 转变为;
②金属活动性:;
③相关金属离子形成氢氧化物的范围如下:
开始沉淀
完全沉淀
6.5
8.3
1.6
2.8
8.1
10.1
回答下列问题:
(1)、为提高焙烧效率,可采取的措施为。a.进一步粉碎矿石
b.鼓入适当过量的空气
c.降低焙烧温度
(2)、在空气中单独焙烧生成 , 反应的化学方程式为。(3)、“酸浸”中过量浓盐酸的作用为:①充分浸出和;②。(4)、滤渣的主要成分为(填化学式)。(5)、生成气体A的离子方程式为。(6)、加入金属的目的是。 -
20、绿水青山就是金山银山。燃烧煤的烟气含有SO2和NOx , 直接排放会造成环境污染,排放前需要进行处理。试回答下列问题:(1)、某实验小组设想利用CO还原SO2。已知S和CO的燃烧热分别是296.0kJ·mol-l、283.0kJ·mol-l , 试写出CO还原SO2生成CO2和S(s)的热化学方程式。(2)、采用Na2SO3溶液吸收法处理SO2 , 25℃时用1mol·L-1的Na2SO3溶液吸收SO2 , 当溶液pH=7时,溶液中各离子浓度的大小关系为。(已知25℃时:H2SO3的电离常数Kal=l.3×10-2 , Ka2=6.2×10-8)(3)、采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在脱硫、脱硝过程中,反应器中一直维持下列条件:温度为298K,pH=12,NaClO2溶液浓度为5×10-3mol·L-1。通入含有SO2和NO的烟气,则反应一段时间后溶液中离子浓度的分析结果如下表。
离子
Cl-
c/(mol·L-1)
8.35×10-4
6.87×10-6
1.5×10-4
l.2×10-5
3.4×10-3
在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。

①写出NaClO2溶液脱硫过程中主要反应的离子方程式。脱硫、脱硝反应的△H0(填“<”“>”或“=”)。
②已知脱硝主要反应为;4NO+3+4OH-=4+3Cl-+2H2O。由实验结果可知,脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是(写出其中一个原因)。欲提高烟气中NO的脱硝反应速率,可以采用的措施是(写出其中一条措施)。
③脱硝主要反应的平衡表达式为: , 其中pe(NO)为平衡分压。结合题目信息,计算298K时脱硫过程主要反应的化学平衡常数:K=(只列算式代入数据,不作运算)
(4)、如果采用Ca(ClO)2替代NaClO2 , 能得到更好的烟气脱硫效果,其原因是。