-
1、Knoevenagel反应是指羰基化合物和活泼亚甲基化合物在弱碱性胺催化下缩合制备a,β—不饱和羰基化合物的反应。某Knoevenagel反应如下,有关说法正确的是( )
 A、A具有手性 B、若B的分子量为132,则R表示乙基 C、在一定条件下,C能发生水解反应 D、D的分子式为H2O2
A、A具有手性 B、若B的分子量为132,则R表示乙基 C、在一定条件下,C能发生水解反应 D、D的分子式为H2O2 -
2、用下列装置(夹持与加热装置已略去)进行实验,不能达到实验目的的是( )
A
B
C
D
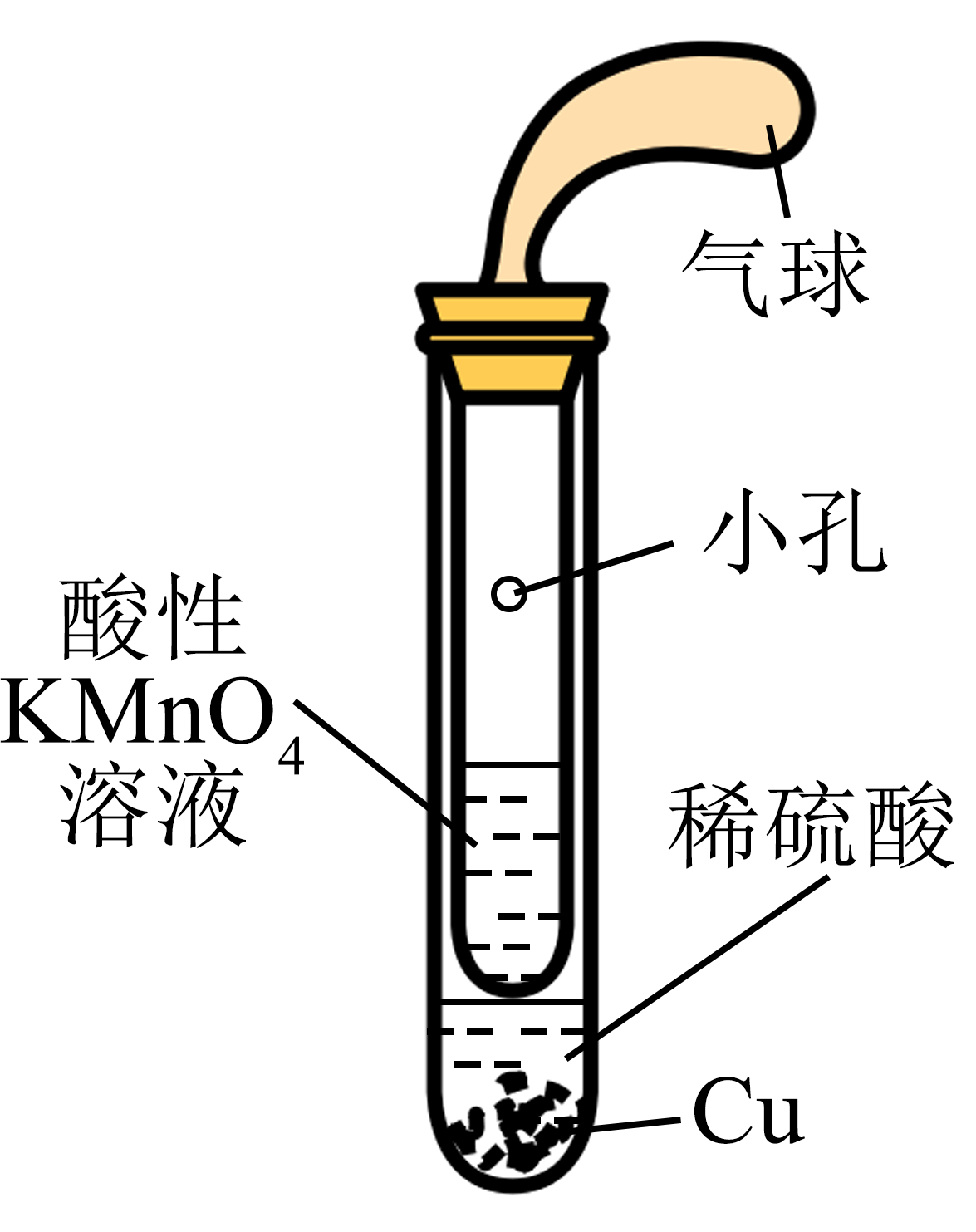



制取SO2 , 并验证其还原性
从茶叶中提取咖啡因
制备Cl2
制备苯甲酸乙酯
A、A B、B C、C D、D -
3、与在一定条件下反应可生成两种单质,在生命活动中也可生成亚硝基硫醇(HSNO)。下列有关说法错误的是( )A、NO为极性分子 B、H2S的VSEPR模型为三角锥形 C、HSNO的结构式为 D、NO与H2S反应生成的两种单质为S、N2
-
4、出土的文物竹简需经历浸泡释污、脱水加固、干燥定形、粘接修复等步骤。文物竹简中的被氧化为后,会与竹材中的木质素(多酚类物质)发生络合反应而变黑,变色竹简需用溶液、乙二胺四乙酸和草酸的混合试剂进行脱色处理,最后再经过蒸馏水清洗,即可恢复原色。下列说法错误的是( )A、纤维素水解的最终产物为果糖 B、还原性较强,起到还原作用 C、脱色过程中,乙二胺四乙酸和草酸主要作配位剂 D、维生素C也可用于竹简脱色
-
5、反应可用于制备火箭推进剂的燃料。下列化学用语表示正确的是( )A、中N为杂化 B、的电子式为
 C、溶液俗称漂白液
D、食盐的分子式为
C、溶液俗称漂白液
D、食盐的分子式为
-
6、2023年诺贝尔化学奖颁发给MoungiG.Bawendi、LouisE.Brus和AlexeyI.Ekimov,以表彰他们在发现和合成量子点方面的贡献。量子点是非常微小的纳米粒子,它们的大小决定了其性质。在20世纪80年代初,AlexeyI.Ekimov成功地在有色玻璃中创造出依赖于尺寸的量子效应,玻璃颜色来自氯化铜纳米颗粒。下列有关说法错误的是( )A、普通玻璃属于晶体 B、分散在玻璃中的氯化铜纳米微小颗粒就是量子点 C、纳米颗粒越小,吸附能力越强 D、氯化铜纳米颗粒的大小决定添加该颗粒的玻璃颜色
-
7、高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,同时在化工制备和电池材料等方面具有广泛的应用前景。某实验小组制备高铁酸钾并探究其性质。

资料:K2FeO4可溶于水、微溶于浓KOH溶液,具有强氧化性,在碱性溶液中较稳定;在酸性或中性溶液中快速产生O2。
(1)、 K2FeO4中铁元素的化合价。(2)、装置B中的试剂为 , 作用。(3)、装置C中制备K2FeO4时,发生反应的化学方程式为 , 每得到1mol K2FeO4 , 理论上消耗Cl2的物质的量为mol。(4)、高铁酸钾与水反应其中一种产物为Fe(OH)3 (胶体),则离子方程式为 , 高铁酸钾作为水处理剂起到的作用是。(5)、制备 K2FeO4可以采用干式氧化法,初始反应为 , 该反应中每消耗6molNa2O2时转移电子数为。 -
8、下表列出了九种元素在周期表中的位置:
周期
族
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
2
a
b
3
c
d
e
f
g
h
4
i
请回答下列问题:
(1)、i元素与h元素形成化合物的电子式是 , 高温灼烧该化合物时,火焰呈色。(2)、b、c、g三种元素的简单离子半径由大到小的顺序是(填离子符号);b、f、g三种元素对应简单氢化物的热稳定性由强到弱的顺序是(填化学式)。(3)、元素的单质与氢氧化钠溶液反应的离子方程式为。(4)、c元素氢化物与发生反应的化学方程式为 , 所得溶液的7.(5)、由a、h组成的一种化合物,分子中a、h原子最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,该化合物的结构式为。 -
9、我国科学家侯德榜发明了联合制碱法。以氯化钠、氨及二氧化碳为原料,同时生产纯碱和氯化铵两种产品,又称“侯氏制碱法”,对世界制碱工业作出了卓越贡献。根据要求回答下列问题:(1)、I、用纯净的碳酸钠固体配制溶液。
用托盘天平称取固体的质量是(2)、本实验中需要用到的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管和。(3)、下列说法中,正确的是____(填字母)。A、定容时仰视刻度线,会导致配制的溶液浓度偏小 B、定容时如果加水超过刻度线,要用滴管吸出 C、摇匀后发现凹液面下降,再加水至刻度线 D、转移时溶液倒出容量瓶外,要重新配制溶液(4)、II、生成纯碱的流程如下:
工业生成纯碱的第一步是除去饱和食盐水中的、、 , 依次加入的试剂是 、 、 、过滤、 。备用的除杂试剂有:①足量溶液;②足量溶液;③适量稀盐酸;④足量的溶液。则正确的试剂添加顺序(填字母)。
A、①②③④ B、②①④③ C、②④①③ D、④②①③(5)、已知:溶解度(20℃)
36.0
21.7
9.6
37.2
写出装置I中反应的化学方程式:。
(6)、制出的纯碱中只含有杂质 , 下列实验方案中,不能测定出混合物中质量分数的是____(填字母)。A、取混合物充分加热,质量减少 B、取混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到固体 C、取混合物与足量溶液充分反应,沉淀经过滤、洗涤、干燥得到固体 D、取混合物与足量稀盐酸充分反应,逸出气体经干燥后用碱石灰吸收,质量增加(7)、将碳酸钠和碳酸氢钠的混合物 , 加热到质量不再变化时,剩余物质的质量 , 则混合物中碳酸钠的质量分数(精确到0.1)。 -
10、掌握电解质和非电解质的概念,能熟练判断一种物质是否是电解质,是了解电解质的性质、研究离子反应的前提。
有以下十种物质:①Cl2②C2H5OH ③Fe(OH)3胶体 ④盐酸 ⑤FeSO4 ⑥K2Cr2O7 ⑦Ca(HCO3)2⑧NaOH ⑨CO2 ⑩Na2CO3。请按要求填空。
(1)、属于电解质的是 , 属于非电解质的是(填序号)。(2)、制备③的化学方程式。(3)、向⑤溶液中滴入⑧溶液的实验现象为。(4)、向④中滴入少量⑩溶液的离子方程式为。(5)、⑦的溶液中加入过量的NaOH溶液的离子方程式为。 -
11、有一质量为11.76g的Fe、CuO、Fe2O3混合固体,完全溶解在200mL2mol/L稀盐酸中,然后向溶液中加铁粉,剩余固体质量与加入铁粉质量的关系如图所示。下列说法正确的是( )
 A、0~m1阶段发生反应为Fe+2H+=Fe2++H2↑ B、混合固体中的质量为0.01mol C、5.04~m2阶段发生反应为2Fe3++Fe=3Fe2+ D、图中m2=5.6
A、0~m1阶段发生反应为Fe+2H+=Fe2++H2↑ B、混合固体中的质量为0.01mol C、5.04~m2阶段发生反应为2Fe3++Fe=3Fe2+ D、图中m2=5.6 -
12、A、B、C、X均为中学常见的物质,它们之间有如下转化关系(其它产物已略去):。下列说法错误的是( )A、若是 , 则可能是 B、若是 , 则可能是 C、若是金属单质,则、中的化合价可能是 D、若是 , 则与可能反应生成
-
13、X、Y、Z、W为原子序数依次增大的短周期主族元素。
①X的一种核素无中子
②Z的单质可以在Y的单质中燃烧,燃烧时火焰为黄色
③X的单质可与Y的单质化合生成 , 在常温下为液体
④W的单质溶于中,所得溶液具有漂白性
下列说法错误的是( )
A、化合物ZYX与ZWY的化学键类型完全相同 B、Y的简单气态氢化物为同主族中最稳定的 C、简单离子半径Z大于W D、Z的最高价氧化物对应水化物的碱性是短周期中最强的 -
14、下列除杂试剂选用正确的是( )
被提纯物质
杂质
除杂试剂
A
FeCl3
CuCl2
Fe
B
CO2
HCl
饱和Na2CO3
C
NaHCO3
Na2CO3
过量盐酸
D
Cl2
HCl
饱和食盐水
A、A B、B C、C D、D -
15、如图所示,在处通入未经干燥的氯气。当关闭处的阀门时,处的红布条看不到明显现象;当打开处的阀门后,处的红布条逐渐褪色。则瓶中盛放的试剂可能是( )

①浓硫酸②浓溶液③④饱和溶液⑤浓溶液⑥浓溶液
A、①②⑤⑥ B、①②④⑤⑥ C、①②③④⑥ D、①②④⑤ -
16、某溶液中可能含有下表中的若干种离子:
阳离子
、、、
阴离子
、、
某同学现取三份各溶液进行如下实验,下列说法正确的是( )
①向第一份中加入溶液,有白色沉淀产生;
②向第二份中加入足量溶液后加热,收集到气体(标准状况);
③向第三份中加入足量溶液,得到沉淀 , 沉淀经足量盐酸洗涤后,剩余。
A、实验①中生成沉淀的离子方程式为 B、原溶液中一定含有、、 , 一定没有 C、原溶液中可能含有 , 可通过焰色试验来确定有无 D、原溶液中一定含有 , 且 -
17、下列关于铁及其化合物的说法正确的是( )A、检验 FeCl2溶液中的Fe2+ , 可将酸性KMnO4溶液滴加到该溶液中,若酸性KMnO4溶液褪色,证明含有Fe2+ B、Fe3O4中铁的化合价有+2和+3价,是一种混合物 C、为探究某食品包装袋内一小包脱氧剂中的还原铁粉是否变质,应取少量样品溶于盐酸,滴加KSCN溶液,若溶液未变红,说明铁粉未变质 D、FeCl3溶液腐蚀铜板的离子方程式为2Fe3++Cu=2Fe2++Cu2+
-
18、已知酸性: , 氧化性:。下列有关叙述中正确的是( )A、向溶液中滴加少量氯水,反应的离子方程式为 B、向溶液中滴加的离子方程式为 C、向氯水中加入足量氯化亚铁溶液,混合溶液变为无色 D、的溶液中,、、、能大量共存
-
19、实验室利用以下反应可以快速制取少量氯气: , 关于该反应的说法正确的是( )A、由该反应判断氧化性:KMnO4>Cl2 B、氧化剂与还原剂的物质的量之比为1:8 C、可以用饱和NaHCO3溶液除去Cl2中混有的HCl D、1 mol Cl2与足量的NaOH溶液充分反应制备“84”消毒液,转移电子的物质的量为2 mol
-
20、工业废水中含有的重铬酸根离子有毒,必须处理达标后才能排放。工业上常用绿矾做处理剂,若恰好与的溶液发生氧化还原反应,若对应氧化产物为 , 则元素在还原产物中的化合价是( )A、 B、 C、 D、