-
1、下列实验方案中元素价态转化正确的是( )
选项
实验方案
同元素不同价态之间转化
A
向粉末中滴加70%硫酸,将气体通入氯水
S:+6→+4→+6
B
向稀硝酸中加入少量铁粉,再加入过量铜粉
Fe:0→+3→+2
C
加热和混合物,将气体通入浓硫酸中
N:-3→0→+4
D
在中加入浓盐酸,将气体通入KI淀粉溶液中
Cl:-1→0→+5
A、A B、B C、C D、D -
2、短周期主族元素X、Y、Z、W的原子序数依次增大,Z和W位于同主族,X、Y的原子序数之和等于Z的原子序数,化合物是一种净水剂,且、的VSEPR模型均为正四面体形。下列叙述正确的是( )A、原子半径:W>X>Z B、简单氢化物沸点:Z>Y C、第一电离能:W>Y>Z D、分子为极性分子
-
3、阅读下列材料,完成问题。(1)、污水中N、P过高会造成水体富营养化,脱N、P的常见方法有两种:
化学法。在含和的废水中加入石灰,生成和;也可以加铝盐或铁盐除磷。
生物法。生物脱氦是由硝化和反硝化两个生化过程完成的。污水先在耗氧池进行硝化使含氦有机物被细菌分解成氨,氨进一步转化成硝态氦;被氧化成 , 进而氧化成。在缺氧池中进行反硝化,硝态氦还原成氦气逸出。
已知: ,
下列叙述正确的是( )
A、是直线形离子 B、和中心原子杂化类型不同 C、的键角为120° D、N的电负性大于P,故氧化性比强(2)、污水中N、P过高会造成水体富营养化,脱N、P的常见方法有两种:化学法。在含和的废水中加入石灰,生成和;也可以加铝盐或铁盐除磷。
生物法。生物脱氦是由硝化和反硝化两个生化过程完成的。污水先在耗氧池进行硝化使含氦有机物被细菌分解成氨,氨进一步转化成硝态氦;被氧化成 , 进而氧化成。在缺氧池中进行反硝化,硝态氦还原成氦气逸出。
已知: , 。
下列离子方程式错误的是( )
A、在含的废水中依次加入和 , 可能发生反应: B、生物法—耗氧池中: , C、生物法—缺氧池中: D、化学法中,可能发生反应: -
4、最新研究表明:反式不饱和脂肪酸反油酸(9-trans)及其脂肪酸活化酶ACSL5促进肿瘤抗原呈递,在癌症免疫中发挥独特功能,反油酸的结构如图所示。下列叙述错误的是( )
 A、顺油酸与反油酸互为同分异构体 B、1mol 9-trans最多能消耗2mol C、9-trans能使酸性溶液褪色 D、9-trans能发生加聚、取代反应
A、顺油酸与反油酸互为同分异构体 B、1mol 9-trans最多能消耗2mol C、9-trans能使酸性溶液褪色 D、9-trans能发生加聚、取代反应 -
5、下列有关物质用途及性质都正确但是二者不匹配的是( )
选项
用途
性质
A
做豆腐时加卤水“点卤”
卤水能使蛋白质聚沉
B
口服小苏打水可缓解服用阿司匹林引发的酸中毒
能与酸反应
C
脲醛塑料(电玉,UF)作电器开关和插座
UF绝缘性好、耐溶剂性好
D
丁基羟基菌香醚(BHA)作脂肪制品的抗氧化剂
BHA具有可燃性
A、A B、B C、C D、D -
6、化学中广泛存在哲学中“量变引起质变”规律。下列变化过程不符合这一规律的是( )A、铁粉和硝酸反应 B、Al和NaOH溶液反应 C、石灰乳吸收废气中 D、向溶液中滴加氨水
-
7、“地标”是湖北名片。下列建筑材料成分变化不属于氧化还原反应的是( )A、“黄鹤楼”中的钢材在潮湿空气中生锈 B、将“武当山”香炉表面铜绿转化成Cu C、“三峡大坝”使用的高标号水泥中加入石膏调节凝固速率 D、“武汉长江大桥”的钢梁采用牺牲阳极法进行保护
-
8、延胡索乙素具有镇痛及催眠作用,其中间体E的合成路线如图。回答下列问题:
 (1)、B的结构简式为;中键与键的个数比为。(2)、已知为六元环状结构,核磁共振氢谱显示为1组峰,则其结构简式为。(3)、C中含氧官能团的名称为。(4)、写出C→D反应的化学方程式: , 该反应的反应类型为。(5)、已知化合物F是
(1)、B的结构简式为;中键与键的个数比为。(2)、已知为六元环状结构,核磁共振氢谱显示为1组峰,则其结构简式为。(3)、C中含氧官能团的名称为。(4)、写出C→D反应的化学方程式: , 该反应的反应类型为。(5)、已知化合物F是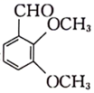 的芳香族同分异构体,则符合下列条件的F的结构有种;其中核磁共振氢谱显示有6组氢(氢原子数之比为)的结构简式为。
的芳香族同分异构体,则符合下列条件的F的结构有种;其中核磁共振氢谱显示有6组氢(氢原子数之比为)的结构简式为。①苯环上只有2个取代基
②能与溶液发生显色反应
③能发生水解反应
-
9、GaN是研制高温大功率电子器件和高频微波器件的重要材料。以废旧太阳能电池(主要成分为)为原料制备GaN的流程如图。请根据所学知识回答问题。

已知: , 。
(1)、在315℃开始凝华成有光泽的针状结晶,试推测该结晶的晶体类型:。(2)、“酸浸氧化”时,温度不宜超过50℃,原因为。(3)、加氨水调pH的目的是除铜,该步骤中分两步进行,第一步: , 第二步是生成的溶解于氨水。①根据所给信息,计算第一步反应的平衡常数。
②写出溶解于氨水的离子方程式:。
(4)、“回流过滤”中,(一种液态化合物,遇水易发生水解)与反应的化学方程式为;该工序分离和利用的原理是。(5)、气体在270℃左右以二聚物存在,请写出该二聚物的结构:。(6)、“高温气相沉积”需要将蓝宝石基板(温度高达1000℃)放在沉积炉内,然后以很低的流速将氮化镓气体从上面吹入炉内。研究发现平放基板时氮化镓分子无法稳定沉积到基板上,而将基板按倾角斜放,却获得了非常均匀的氮化镓结晶,试分析其原因:。 -
10、、(主要指和)是大气主要污染物之一、有效去除大气中的、是环境保护的重要课题。
已知:
反应1:
反应2:
反应3:
反应4:
回答下列问题:
(1)、计算 , 已知反应3的 , 则该反应自发进行的最高温度为(取整数)K。(2)、已知反应4在某催化剂作用下的反应历程如图。
①(填“”或“”)0.
②该反应历程的决速步骤为。
③可提高该反应中平衡转化率的措施有(填两条)。
(3)、向密闭容器中充入一定量的和 , 保持总压为 , 发生反应4.当时的平衡转化率随温度以及下NO的平衡转化率随投料比的变化关系如图:
①能表示此反应已经达到平衡状态的是(填标号)。
A.气体的密度保持不变
B.的浓度不变
C.
②表示时的平衡转化率随温度的变化关系曲线是(填“"或“II"),理由是。
③a、d两点对应的平衡常数大小比较为(填“>”“<”或“=”)。
④b点对应条件下的压强平衡常数(为用分压表示的平衡常数,分压=总压×物质的量分数,列出计算式即可)。
-
11、氧钒(Ⅳ)碱式碳酸铵晶体{化学式为 , }是一种难溶于水的化合物,它是制备热敏材料VO2的原料。实验室以V2O5为原料,通过还原、转化、沉淀等步骤合成该晶体的流程如下:
溶液氧钒(Ⅳ)碱式碳酸铵晶体
已知:+4价钒在弱酸性条件下具有还原性。
回答下列问题:
(1)、N2H4为二元弱碱,其在水中的电离过程与NH3类似,其第一步电离方程式为 , 第二步电离方程式为;N2H4与液氧接触能自燃,产物对环境无污染,写出发生反应的化学方程式:。(2)、步骤ii可通过如图装置完成。
①装置的优点为 , 检查其气密性的操作为。
②实验开始时,先打开(填“K1”或“K2”)。
③盛装NH4HCO3溶液的仪器名称为。
(3)、测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度。实验步骤:粗产品wg再重复实验两次。
已知:。
①滴入NaNO2溶液的目的是除去KMnO4 , 写出其反应的离子方程式:。
②若平均消耗cmol/L(NH4)2Fe(SO4)2标准溶液的体积为amL,则氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度为。
③若其他操作均正确,但NaNO2的加入量不足,会引起测定结果(填“偏大”“偏小”或“无影响”)。
-
12、羟醛缩合反应是一种常用的增长碳链的方法。一种合成目标产物
 (图中物质⑦)的反应机理如图所示。下列说法错误的是( )
(图中物质⑦)的反应机理如图所示。下列说法错误的是( ) A、物质②和⑤均易溶于水 B、物质③→④的过程中,N的杂化方式未发生改变 C、⑥→⑦的过程中没有非极性键的断裂和生成 D、化合物
A、物质②和⑤均易溶于水 B、物质③→④的过程中,N的杂化方式未发生改变 C、⑥→⑦的过程中没有非极性键的断裂和生成 D、化合物 为该反应的催化剂,能降低反应的活化能
为该反应的催化剂,能降低反应的活化能
-
13、重整反应: ;该反应可制备合成气(和CO)。向一密闭容器中充入一定量的和 , 实验测得平衡转化率随反应温度和压强的变化关系如图所示。下列说法错误的是( )
 A、X表示温度 B、L代表的物理量大小关系: C、平衡常数: D、正反应速率:
A、X表示温度 B、L代表的物理量大小关系: C、平衡常数: D、正反应速率: -
14、常温下,将溶液滴入三元酸溶液中,混合溶液中随的变化关系如图所示。下列说法正确的是( )
 A、曲线表示随的变化关系 B、当时,混合溶液中 C、常温下,溶液中: D、当时,
A、曲线表示随的变化关系 B、当时,混合溶液中 C、常温下,溶液中: D、当时, -
15、用于陶瓷业及半导体工业中的某含铅化合物的晶胞结构如图。已知晶胞参数为apm,为阿伏加德罗常数的值。下列说法错误的是( )
 A、晶体中Pb与S个数比为 B、晶胞中与Pb最近且等距离的Pb有12个 C、每个晶胞中由S围成的正八面体有8个 D、晶体的密度为
A、晶体中Pb与S个数比为 B、晶胞中与Pb最近且等距离的Pb有12个 C、每个晶胞中由S围成的正八面体有8个 D、晶体的密度为 -
16、我国某大学科研团队通过超快电脉冲热还原法开发了一种新型碳载钌镍合金纳米催化剂(),并基于此催化剂制备出一种极具竞争力的高能量镍氢气电池,其工作原理如图所示。下列说法错误的是( )
 A、放电时,向电极移动 B、放电一段时间后,溶液的浓度增大 C、放电时, D、外电路中每转移 , 理论上电极上消耗
A、放电时,向电极移动 B、放电一段时间后,溶液的浓度增大 C、放电时, D、外电路中每转移 , 理论上电极上消耗 -
17、利用光触媒处理甲醛等有机物的示意图如图。下列说法错误的是( )
 A、与均为非极性分子 B、干冰与冰中分子的配位数相同 C、甲醛的空间结构为平面三角形 D、与甲醛的反应为
A、与均为非极性分子 B、干冰与冰中分子的配位数相同 C、甲醛的空间结构为平面三角形 D、与甲醛的反应为 -
18、下列各组物质的鉴别试剂选择错误的是( )
选项
物质
鉴别试剂
A
苯酚稀溶液和酒精溶液
溶液
B
粉末和CaO粉末
水
C
乙烯气体和乙烷气体
溴水
D
C粉和氧化铜粉末
稀盐酸
A、A B、B C、C D、D -
19、某离子液体,由原子序数依次增大的短周期主族元素X、Y、Z、W组成,其结构如图。X、Y元素的原子序数之和与Z元素的相等,Y的最外层电子数是内层电子总数的2倍,W的单质可用于自来水的消毒。下列说法正确的是( )
 A、原子半径: B、电负性: C、键角: D、W的最高价氧化物的水化物为强酸
A、原子半径: B、电负性: C、键角: D、W的最高价氧化物的水化物为强酸 -
20、正高碘酸(H5IO6)是白色结晶性粉末,可溶于水,主要用作氧化剂和分析试剂。由NaI制取H5IO6的实验流程如图所示:

下列相关步骤对应的离子方程式或化学方程式错误的是( )
A、“反应1”中: B、“反应2”中: C、“反应3”中: D、“反应4”中: