-
1、的回收和利用是实现“碳中和”的有效途径。在一恒容密闭反应器中充入体积之比为的和 , 发生反应:① , ②。在相同时间内,的转化率、的选择性[的选择性]与温度的关系如图所示。下列叙述错误的是( )
 A、温度高于时,主要发生反应② B、温度低于时,的选择性随温度升高而增大 C、平衡时,再充入和 , 再次达到平衡时,的物质的量增大 D、下反应达到平衡时,、、的浓度之比为
A、温度高于时,主要发生反应② B、温度低于时,的选择性随温度升高而增大 C、平衡时,再充入和 , 再次达到平衡时,的物质的量增大 D、下反应达到平衡时,、、的浓度之比为 -
2、钛酸亚铁常用于制备磁芯、磁盘和传感器等,它属于立方晶系,晶胞结构如图所示。下列叙述错误的是( )

已知:晶胞参数为a nm,为阿伏加德罗常数的值。
A、的分数坐标为 B、晶胞中位于所形成的正八面体的体心 C、和之间的最短距离为等 D、钛酸亚铁晶体密度为 -
3、硫代硫酸钠主要用于照相时作定影剂,也可用作氰化物的解毒剂,下列离子方程式书写错误的是( )A、用过量的溶液除去底片上的时有生成: B、久置空气中的溶液变质: C、用溶液吸收工业尾气中足是的: D、向溶液中滴加稀硫酸:
-
4、我国某大学科研团队通过超快电脉冲热还原法开发了一种新型碳载钌镍合金纳米催化剂(RuNi/C),并基于此催化剂制备出一种极具竞争力的高能量镍氢气()电池,其工作原理如图所示。下列说法错误的是( )
 A、放电时,向电极b移动 B、放电一段时间后,KOH溶液的浓度增大 C、放电时,电极a上的电极反应式为
A、放电时,向电极b移动 B、放电一段时间后,KOH溶液的浓度增大 C、放电时,电极a上的电极反应式为D 外电路中每转移2mol , 理论上电极b上消耗2g
-
5、下列实验操作正确或操作规范且能达到实验目的的是( )
选项
操作
目的
A
取适量晶体溶于浓硝酸中,加水稀释到指定刻度
配制一定物质的量浓度的溶液
B
用碱式滴定管盛装标准溶液并滴定草酸溶液
测定草酸溶液浓度
C
向的酒精中加入钠粒
证明的酒精中含水
D
向溶液中先滴加少量溶液
振荡后再滴加少量溶液
明:
A、A B、B C、C D、D -
6、水热法制备的实验流程如图,下列叙述正确的是( )
 A、本实验使用托盘天平称取固体 B、调pH为2的目的是促进水解 C、溶解步骤中,NaCl作反应的氧化剂 D、用红外光谱仪可检验固体是否为晶体
A、本实验使用托盘天平称取固体 B、调pH为2的目的是促进水解 C、溶解步骤中,NaCl作反应的氧化剂 D、用红外光谱仪可检验固体是否为晶体 -
7、以相应的卤代酸酯为原料,利用Gabriel法合成天冬氨酸,其中一种中间产物的结构如图所示,下列有关该有机物的说法正确的是( )
 A、存在分子中含有两个苯环且可发生银镜反应的同分异构体 B、分子中不含有手性碳原子 C、1mol该有机物最多与7mol的发生加成反应 D、分子中所有的碳原子共平面
A、存在分子中含有两个苯环且可发生银镜反应的同分异构体 B、分子中不含有手性碳原子 C、1mol该有机物最多与7mol的发生加成反应 D、分子中所有的碳原子共平面 -
8、设为阿伏加德罗常数的值,下列说法正确的是( )A、1mol乙醛中含有σ键的数目为6 B、1L pH=3的稀溶液中氢离子的数目为0.002 C、等物质的量的和气体中所含中子数均为16 D、标准状况下,11.2L 中含有的分子数目为0.5
-
9、某离子液体,由原子序数依次增大的短周期主族元素X、Y、Z、W组成,其结构如图,X、Y元素的原子序数之和与Z元素的相等,Y的最外层电子数是内层电子总数的2倍,W的单质可用于自来水的消毒,下列说法正确的是( )

A 第一电离能:
A、Y、W组成的化合物易溶于水 B、最简单氢化物的键角: C、的最高价氧化物的水化物为强酸 -
10、下列有关仪器的名称、示意图与用途或使用操作的叙述均正确的是( )

坩埚

蒸馏烧瓶
A.可用于对固体进行高温加热
B.可用于制备蒸馏水

碱式滴定管

球形干燥管
C.赶出碱式滴定管乳胶管中的气泡
D.洗气除杂实验中将气体从小口通入
A、A B、B C、C D、D -
11、下列物质性质和原理分析相匹配的是( )
选项
物质性质
原理分析
A
超分子冠醚能识别钾离子
超分子具有自组装的特征
B
的酸性比的强
的摩尔质量大于
C
甲酸的沸点高于二甲醚()
甲酸的范德华力大于二甲醚
D
冰醋酸不导电,醋酸溶液能导电
冰醋酸中没有能自由移动的离子,醋酸溶液中有能自由移动的离子
A、A B、B C、C D、D -
12、亚氨基化硫()的制备原理:。下列化学用语表述正确的是( )A、基态S原子的价层电子排布式: B、的VSEPR模型:
 C、的电子式:
C、的电子式: D、的结构式:
D、的结构式:
-
13、“挖掘文物价值,讲好中国故事。”下列文物在潮湿空气中易发生电化学腐蚀的是( )


A.先锋煲(陶)
B.曜变天目碗(瓷)


C.铁足大铜鼎
D.六棱柱形水晶穿珠
A、A B、B C、C D、D -
14、磺胺嘧啶为预防、治疗脑膜炎球菌性脑膜球菌性脑膜炎(流行性脑膜炎)的首选用药,合成路线如下:

回答下列问题:
(1)、C的名称为;H中所含官能团有碳碳双键、。(2)、F的结构简式为 , 由B生成C的反应类型为。(3)、G→H可以看作为两步反应完成,其中第二步为氧化反应,试写出第一步反应的化学方程式:。(4)、化合物K是H的同系物,最大质荷比为99,满足下列条件的K的同分异构体有种(不考虑立体异构)。a.红外光谱显示有结构
b.氨基与碳碳双键相连
其中核磁共振氢谱有3组峰,且峰面积之比为6∶2∶1的结构简式为(写一种)。
(5)、已知: 。对氨基苯甲酰-丙氨酸是重要的医药中间体,结构简式为:
。对氨基苯甲酰-丙氨酸是重要的医药中间体,结构简式为: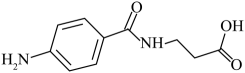 , 试以甲苯和-丙氨酸()为原料,设计对氨基苯甲酰-丙氨酸的合成路线(无机试剂任选):。
, 试以甲苯和-丙氨酸()为原料,设计对氨基苯甲酰-丙氨酸的合成路线(无机试剂任选):。 -
15、研究含氮元素物质的反应对生产、生活、科研等方面具有重要的意义。
. 回答下列问题。
(1)、汽车在行驶过程中有如下反应发生:写出表示CO燃烧热的热化学方程式为。
(2)、空燃比是机动车内燃机气缸通入空气与燃料质量的比值。[设汽油的成分为辛烷(),空气的平均相对分子质量为29,氧气在空气中的体积分数为21%]计算汽油的最佳空燃比为(保留三位有效数字)。若实际空燃比大于此值,则该汽车尾气的主要污染物为。(3)、在汽车上安装三元催化转化器可实现反应: <0,减少汽车尾气污染。T℃时,在恒容的密闭容器中通入一定量的CO和NO,能进行上述反应,测得不同时间的CO和NO的浓度如表:时间/s
0
1
2
3
4
5
6
1.50
1.15
0.75
0.62
0.55
0.50
0.50
3.00
2.65
2.25
2.12
2.05
2.00
2.00
该反应在1~4s内的平均反应速率为。反应达平衡时压强为100kPa,求压强平衡常数。(用平衡分压代替平衡浓度,分压=总压×物质的量分数)
(4)、 . 工业合成氨以铁触媒作催化的反应机理如图(*表示吸附态,中间部分表面反应过程未标出):
已知:的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
研究表明,合成氨的速率与相关物质的浓度关系为 , k为速率常数。以下说法正确的是____。
A、合成氨的反应在任意温度下都能自发进行 B、增大、或的浓度都能提高合成氨速率 C、若反应气中混有水蒸气,Fe催化剂可能中毒 D、使用催化剂可提高单位时间内原料气的转化率(5)、实际工业生产中,原料气中和物质的量之比按1∶2.8加入。请说明原料气中过量的理由:(从两种不同的角度分析)。(6)、在氨气催化氧化制硝酸过程中,发现(<0)反应的速率随温度的升高而减小。某化学小组查阅资料得知该反应的反应历程分两步:①(快)
②(慢)
根据化学反应原理解释升高温度该反应速率减小的原因可能是。
-
16、辉铜矿是一种重要的铜矿石,主要含有硫化亚铜(),还有、及一些不溶性杂质;软锰矿主要成分是 , 还含有、等杂质。一种以辉铜矿石和软锰矿为原料制备超细铜粉和碳酸锰的工艺流程如下:
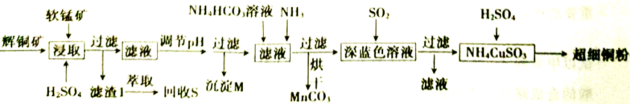
已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0计算)。
离子
开始沉淀的pH
沉淀完全的pH
1.1
3.2
8.3
9.8
4.4
6.4
回答下列问题:
(1)、浸取后得到的浸出液中含有、 , 写出浸取时产生、反应的化学方程式。(2)、滤渣1中含有的主要化合物有。(3)、pH的调节范围为。(4)、生成沉淀的离子方程式为。(5)、由深蓝色溶液生成的离子方程式为。(6)、现用滴定法测定碳酸锰产品中锰的含量。实验步骤:称取4.000g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中完全转化为(其中转化为);加入稍过量的硫酸铵,发生反应以除去;加入稀硫酸酸化,再加入60.00mL 0.500硫酸亚铁铵溶液,发生的反应为;用5.00mL 0.500酸性溶液恰好除去过量的。①酸性溶液与的反应中还原剂与氧化剂的物质的量之比为。
②碳酸锰产品中锰的质量分数为(保留三位有效数字)。
-
17、俗称海波,水处理中常用作还原剂除氯、冶金中常用作络合剂,摄影中常用作定影剂。遇酸、受热都易分解。工业上常用以下两种方法制备:(1)、亚硫酸钠法:
①需用除氧蒸馏水配制亚硫酸钠溶液。研细硫粉,用润湿后加入溶液中,水浴加热后再经重结晶精制。
②若未用除氧蒸馏水配制亚硫酸钠溶液,导致产品中存在的杂质为 , 证明含有该杂质的方法是。
(2)、硫化钠法:选用以下必要的装置,利用与、的混合溶液反应制备。
①按气体流向从左到右的导管连接顺序:。
②丁装置中与、混合液反应生成的化学方程式:。
③实验过程中,丁中的澄清溶液先变浑浊后变澄清,此时生成大量的 , 一段时间后,丁中再次出现少量浑浊,此时须立刻停止通入 , 用离子方程式解释立刻停止通入的原因:。
④简述检验丁装置中导出气体中含有的方法:。
(3)、的用途:做冶金工业络合剂。黄金(Au)浸取工艺:将金矿石浸泡在、的混合溶液中,并通入。其中作为催化剂参与反应,方程式为: , 则浸金总反应的离子方程式为:。
-
18、碳酸钙是常见难溶物,将过量碳酸钙粉末置于水中达到溶解平衡:。
已知:i.图中曲线表示体系中各含碳粒子的物质的量分数与pH的关系。

ii.。
下列有关说法不正确的是( )
A、上层清液中含碳微粒最主要以形式存在 B、向上层清液中通入气体,碳酸钙溶解平衡正移 C、若将过量的碳酸钙固体置于0.1碳酸钠溶液中达到溶解平衡时,溶液中大于 D、若0.1的溶液pH=8.3,则该溶液中 -
19、钠离子电池比锂离子电池更稳定,造价更低。2023年星恒电源发布了第一代钠电池“超钠F1”结构如图,已知该电池电极材料为(普鲁士白)和(嵌钠硬碳),反应为:。下列说法中错误的是( )
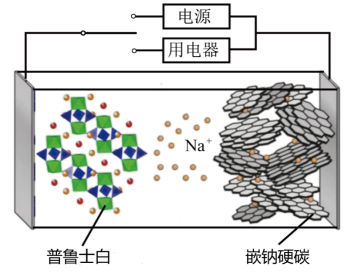 A、钠离子电池比锂离子电池内阻大,所以短路时发热少,升温慢,安全性更高 B、放电时,正极电极反应为 C、充电时,普鲁士白极接电源的正极,阴极质量减小 D、电池充电时,移向硬碳并嵌入其中
A、钠离子电池比锂离子电池内阻大,所以短路时发热少,升温慢,安全性更高 B、放电时,正极电极反应为 C、充电时,普鲁士白极接电源的正极,阴极质量减小 D、电池充电时,移向硬碳并嵌入其中 -
20、某温度下,向恒容密闭容器中充入等物质的量浓度的X(g)和Y(g),同时发生两个反应:① , ②。反应①的速率可表示为 , 反应②的速率可表示为(、为速率常数)。反应体系中组分X(g)、W(g)的物质的量浓度c随时间的变化情况如图所示。下列说法正确的是( )
 A、10min时,Y(g)的反应速率为0.025 B、体系中W和M的浓度之比保持不变,说明反应已平衡 C、平衡时,反应②的平衡常数 D、反应②的活化能比反应①的活化能更大
A、10min时,Y(g)的反应速率为0.025 B、体系中W和M的浓度之比保持不变,说明反应已平衡 C、平衡时,反应②的平衡常数 D、反应②的活化能比反应①的活化能更大