-
1、室温下,下列溶液中一定能大量共存的离子组是A、强碱性溶液:、、、 B、加入铝粉有氢气产生的溶液:、、、 C、中性溶液:、、、 D、强酸性溶液:、、、
-
2、高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,工业上制备高铁酸钠的其中一种化学原理为: , 下列说法不正确的是(设为阿伏加德罗常数的值)A、反应中电子转移数目为时,生成的质量为166 g B、NaClO是还原剂,是氧化剂 C、根据该原理可得Na2FeO4在碱性环境中能稳定存在 D、NaCl是还原产物
-
3、下列表示正确的是A、的名称:2-乙基丁烷 B、气态BeCl2的空间结构名称为:V形 C、的能量最低时的价层电子排布图可能为:
 D、用电子式表示HCl的形成过程:
D、用电子式表示HCl的形成过程:
-
4、回收铝制饮料罐得到铝与从铝土矿制铝相比,前者能耗仅为后者的3%-5%,下列说法不正确的是A、铝制饮料罐的回收再利用可以节约大量能源,缓解能源紧张的问题 B、铝表面容易生成一层致密的氧化铝保护膜 C、硬铝的硬度大但强度较小,不适合制造飞机的外壳 D、电解熔融Al2O3时加入冰晶石,目的是降低Al2O3的熔化温度
-
5、下列物质溶于水能导电但属于非电解质的是A、HCl B、Cl2 C、CaCO3 D、NH3
-
6、单液流电池属于沉积型电池,它不带要隔膜或离子交换膜,从而大幅降低了电池成本和电池设计的复杂性,一种单液流电池工作原理如图所示,下列说法错误的是
 A、放电时,储液罐中溶液的不断增大 B、充电时,电极与电源的正极相连 C、放电时,正极反应式为 D、充电时,若电极增重 , 电解质溶液增加离子数为
A、放电时,储液罐中溶液的不断增大 B、充电时,电极与电源的正极相连 C、放电时,正极反应式为 D、充电时,若电极增重 , 电解质溶液增加离子数为 -
7、二水四氯合钴酸铵的制备反应为 , 下列说法正确的是A、基态原子核外电子的空间运动状态有27种 B、键角: C、该反应中所涉及的元素位于p区的有4种 D、中含有离子键、配位键、键等
-
8、马钱苷酸作为秦艽的药用活性成分,应用于痛风定片和骨刺消痛胶囊等药物当中,结构简式如图所示。下列说法正确的是
 A、马钱苷酸分子中一定含有平面环状结构 B、马钱苷酸最多消耗的物质的量之比为 C、马钱苷酸能使酸性溶液和溴水褪色且原理相同 D、马钱苷酸能发生消去、酯化、加成等反应
A、马钱苷酸分子中一定含有平面环状结构 B、马钱苷酸最多消耗的物质的量之比为 C、马钱苷酸能使酸性溶液和溴水褪色且原理相同 D、马钱苷酸能发生消去、酯化、加成等反应 -
9、中华文化源远流长,下列有关说法错误的是A、“斜月沉沉藏海雾,碣石潇湘无限路”,诗中的“海雾”可发生丁达尔效应 B、“大邑烧瓷轻且坚,扣如哀玉锦城传”,诗中的“瓷”属于传统无机非金属材料 C、“以曾青涂铁,铁赤色如铜”,句中的“曾青”为氢氧化铜 D、“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也”。句中的“法”指蒸馏
-
10、某小组探究的催化氧化,实验装置如图,③中气体颜色无明显变化,④中收集到红棕色气体,一段时间后产生白烟。

下列分析正确的是
A、①中固体药品可用代替,②中固体药品可为与 B、③、④中现象说明③中的反应是 C、④中白烟的主要成分是 D、一段时间后,⑤中溶液可能变蓝 -
11、有机物Ⅰ结构对称,是一种优良的抗菌药成分,其合成路线如下。

已知:
①
②

回答下列问题:
(1)、化合物A的分子式为。(2)、反应①中,化合物A与气体x反应,生成化合物B,原子利用率100%。x为。(3)、芳香族化合物M为B的同分异构体,其能够发生银镜反应、水解反应,且在核磁共振氢谱上只有4组峰,则M的结构简式为 , 其含有的官能团名称为。(4)、关于由D→E的说法中,不正确的是________。A、反应过程中,有C-O单键的断裂和C=C双键的形成 B、HCHO为平面结构,分子中存在由p轨道“头碰头”形成的π键 C、化合物D中含有氧原子,能与水形成氢键,因此其易溶于水 D、化合物E中,碳原子采取、杂化,但不存在顺反异构(5)、根据化合物E的结构特征,分析预测其可能的化学性质,完成下表。序号
反应试剂、条件
反应形成的新结构
反应类型
a
的溶液
b
水解反应
(6)、以甲苯、乙醛为含碳原料,利用反应③和④的原理,合成化合物W( )。基于自己设计的合成路线,回答下列问题:
)。基于自己设计的合成路线,回答下列问题:(a)最后一步反应中,有机反应物为(写结构简式)。
(b)相关步骤涉及到芳香烃制卤代烃,其化学方程式为(注明反应条件)。
-
12、氰化物是指含有氰基或氰根离子的一类化合物,广泛应用于工业与农业中。(1)、工业上以甲烷和氨气为原料在高温和催化剂的作用下发生反应Ⅲ制备HCN。
反应Ⅰ:
反应Ⅱ:
则反应Ⅲ:
(2)、在一定温度条件下,向1L恒容密闭容器中加入2mol和2mol发生反应Ⅲ,10min时反应达到平衡, 此时体积分数为30%。①0~10min内用表示的平均反应速率为。若保持温度不变,再向容器中加入和各1mol,则此时(填“>”“=”或“<”)。
②由实验得到的关系可用如图甲表示。当x点升高到某一温度后,反应重新达到平衡,则x点将移动到图甲中的点(填字母标号)。
(3)、可做氧化废水中的催化剂,氧化过程中总氰化物(、HCN等)去除率随溶液初始pH变化如图乙所示。当溶液初始pH>10时,在一段时间内总氰化物去除率下降的原因可能是。 (4)、常温下(-溶液体系中存在平衡关系:;;; , 平衡常数依次为、、、。含Cd物种的组分分布分数δ、平均配位数与的关系如图所示。
(4)、常温下(-溶液体系中存在平衡关系:;;; , 平衡常数依次为、、、。含Cd物种的组分分布分数δ、平均配位数与的关系如图所示。
已知:(过程中HCN浓度几乎不变),; , , , ;平均配位数 , 其中M代表中心离子,L代表配体。
①曲线Ⅱ代表的含Cd微粒为。
②的平衡常数为。
③下列有关说法中,正确的是。
A.降低pH,有利于生成
B.pH=7时,
C.平衡后加水稀释,与的浓度之比增大
④a点时,。(写出计算过程,结果保留2位有效数字)。
-
13、五氧化二饥广泛用于冶金、化工等行业。某废钒催化剂主要含有、、CaO、、、等,采取如下工艺流程回收其中的钒制备;

已知:溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子
开始沉淀时()的pH
12.4
3.7
2.2
7.5
沉淀完全时()的pH
13.8
4.7
3.2
9.0
回答下列问题:
(1)、基态V原子的价电子轨道表示式为。(2)、浸出渣的主要成分是 , “酸浸还原”中;和均转化为 , 写出转化为反应的离子方程式为。(3)、“氧化”中被氧化的元素主要有(填元素符号)。(4)、“调pH”中有沉淀生成,写出生成沉淀反应的离子方程式。(5)、“沉钒”中需要加入过量 , 其原因是。晶体未经洗涤直接进行“煅烧”,将导致产品中混有杂质。(6)、工艺中可循环利用的物质有。(7)、一定温度下,溶解在NaOH溶液中,可得到偏钒酸钠。偏钒酸钠阴离子呈现如图1所示的无限链状结构。碳化钒主要用于制造钒钢及碳化物硬质合金添加剂,其晶胞结构如图2所示。
①偏钒酸钠的化学式为。
②碳化钒晶胞中与碳原子距离最近且相等的碳原子个数为。
③若碳化钒合金的密度为 , 阿伏加德罗常数值为 , 则晶胞参数nm。
-
14、铁氰化钾()是一种氰配合物,易溶于水,可检验。某研究性学习小组拟制备铁氰化钾并探究其性质。(1)、制备铁氰化钾。用氧化制备 , 装置如图所示。
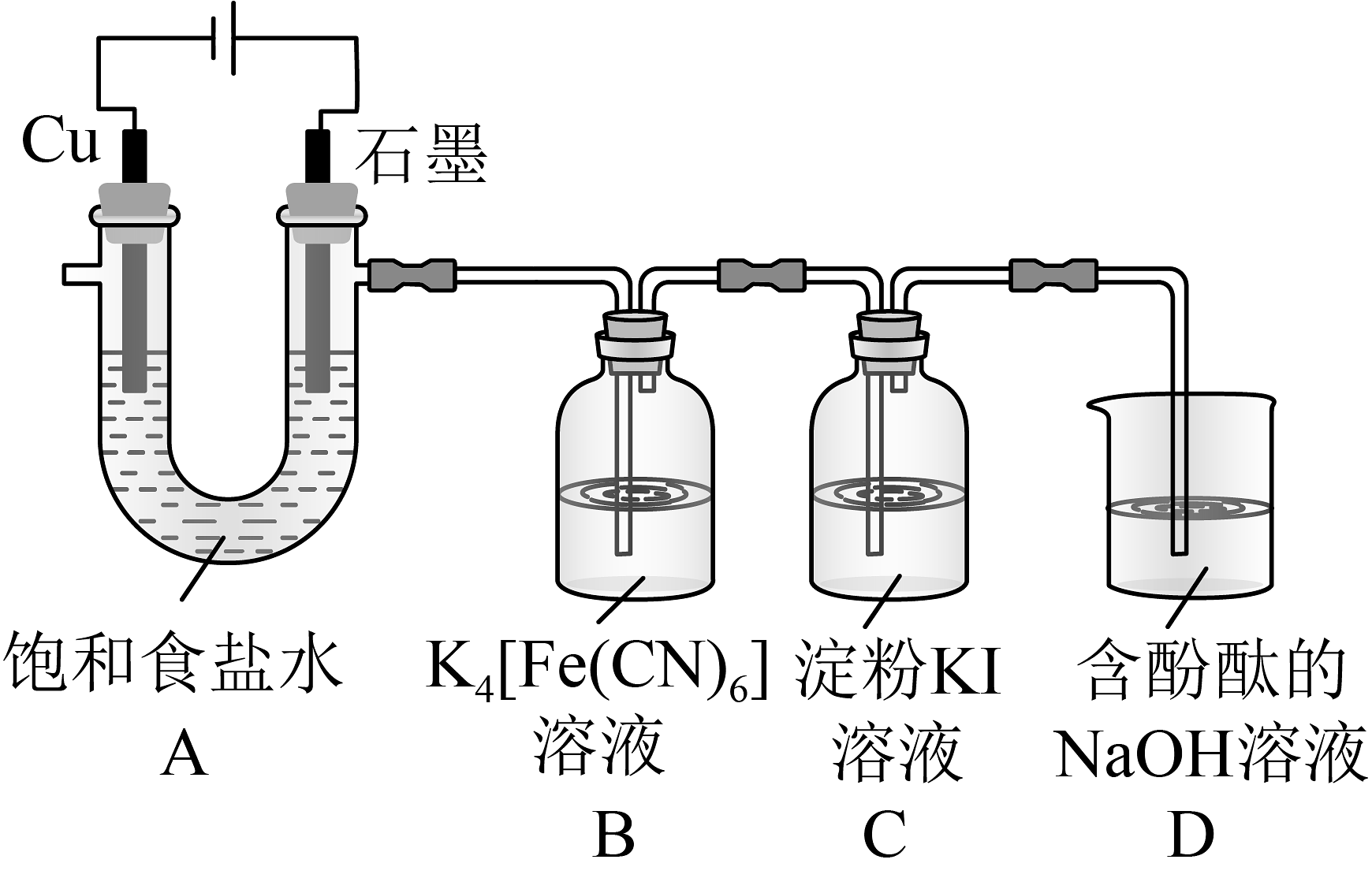
①装置A中Cu电极上的电极反应为。实验测得石墨电极上生成的体积小于Cu电极上生成气体的体积,其原因可能是。
②装置B中发生反应的化学反应方程式为。
(2)、探究铁氰化钾的性质。查阅资料,提出猜想:猜想1:具有氧化性;
猜想2:溶液中存在化学平衡。
设计如下实验展开探究(本实验所用蒸馏水均已除氧:已知)。
实验
实验操作
实验现象
Ⅰ
向2mL饱和KI溶液中滴加5~6滴溶液,振荡,再滴加几滴淀粉溶液
无明显现象
Ⅱ
向2mL溶液中滴加5~6滴饱和KI溶液,振荡,再滴加几滴淀粉溶液
溶液变成蓝色
Ⅲ
溶液中滴入几滴KSCN溶液,再向溶液中加入少量浓盐酸
滴入KSCN溶液,无明显现象,加入盐酸后,溶液变红
Ⅳ
向浓度均为、的混合溶液中放入一根无锈铁丝
产生蓝色沉淀
Ⅴ
向溶液中放入一根无锈铁丝(与实验Ⅳ铁丝相同)
产生蓝色沉淀
①铁氰化钾晶体中各种微粒间的相互作用不包括(填编号)。
a.离子键 b.共价键 c.配位键
d.金属键 e.键 f.范德华力
②实验Ⅱ可以证明猜想1成立。实验Ⅰ中滴加淀粉溶液后不变蓝的原因可能是。
③利用平衡移动原理解释实验Ⅲ中加入浓盐酸后溶液变为红色的原因:。
④由实验Ⅲ、Ⅳ、Ⅴ的信息,小组同学认为猜想2成立。实验Ⅳ、Ⅴ中判断猜想2成立的依据是。
(3)、铁氰化钾可用于测定硫酸钴晶体中的钴含量。取mg硫酸钴晶体样品,加水配成200mL溶液,取20mL待测液于锥形瓶中,加入mLcmol/L铁氰化钾标准液,将Co(Ⅱ)氧化为Co(Ⅲ),充分反应后,用质量浓度为ρg/L的Co(Ⅱ)标准液滴定剩余的铁氰化钾,消耗Co(Ⅱ)标准液mL。反应的方程式为。样品中钴的含量(以钴的质量分数ω计)(4)、铁盐或亚铁盐应用广泛,写出其中一种的化学式并写出该盐的一种用途。 -
15、1,3-丁二烯与HBr发生加成反应机理如图。反应Ⅰ和反应Ⅱ都经过同一中间体,进一步发生基元反应②和基元反应③得到两种不同的加成产物。下列说法错误的是
 A、基元反应①△H>0,基元反应②△H<0 B、基元反应③相对于基元反应②为慢反应 C、同一条件下,反应Ⅱ的倾向性比反应Ⅰ的倾向性大 D、反应过程中,升高温度,1,2-加成产物的产率明显增加
A、基元反应①△H>0,基元反应②△H<0 B、基元反应③相对于基元反应②为慢反应 C、同一条件下,反应Ⅱ的倾向性比反应Ⅰ的倾向性大 D、反应过程中,升高温度,1,2-加成产物的产率明显增加 -
16、下列方案设计、现象和结论均正确且具有因果关系的是
选项
方案设计
现象和结论
A
室温下,用pH计测定0.1mol/L的、两种溶液的pH
溶液的pH较大,则电负性:F>Cl
B
向盛有0.2mol/L溶液的试管中加入0.1mol/L的溶液
试管口出现红棕色气体,则被还原为
C
将注射器充满气体,再往里推活塞压缩体积
气体颜色加深,则加压平衡向生成气体的方向移动
D
2mL0.1mol·L-¹的溶液中滴加2滴同浓度NaOH的溶液,再滴加4滴同浓度的
白色沉淀转化为红褐色沉淀,则
A、A B、B C、C D、D -
17、X原子不含中子,Y元素位于第四周期且基态原子中有5个未成对电子,基态W原子的s能级与p能级的电子总数相等,ZW与氮气分子具有相同的电子数,四种元素形成的配合物XY(ZW)5、结构如下图所示。下列说法不正确的是
 A、电负性:W>Z>X>Y B、简单氢化物的沸点:W>Z C、同周期中第一电离能大于W的有3种 D、和的空间结构均为三角锥形
A、电负性:W>Z>X>Y B、简单氢化物的沸点:W>Z C、同周期中第一电离能大于W的有3种 D、和的空间结构均为三角锥形 -
18、以黄铜矿(主要成分为 , 能导电)为原料,用(溶液作浸取剂提取的原理示意图如下。(结构式为
 )下列说法正确的是
)下列说法正确的是 A、中O全部为-2价 B、负极的电极反应式为: C、一段时间后,的浸出速率显著变小,可能是致密硫膜阻碍了电子转移 D、溶解黄铜矿反应的离子方程式为:
A、中O全部为-2价 B、负极的电极反应式为: C、一段时间后,的浸出速率显著变小,可能是致密硫膜阻碍了电子转移 D、溶解黄铜矿反应的离子方程式为: -
19、表示阿伏加德罗常数的值,有关反应的叙述正确的是A、1LpH=1的溶液中含有的数目为 B、1mol与足量NaOH溶液反应转移电子数为 C、标准状况下,22.4L与充分反应,生成物的分子数为 D、1mol与足量NaOH溶液反应, 所得溶液中数为
-
20、宏观辨识与微观探析是化学学科核心素养之一,下列离子方程式能完全表示相应事实的是A、向溶液中滴加过量的氨水: B、将还原性铁粉加入过量的稀硝酸中: C、向溶液中加入溶液: D、模拟侯氏制碱法制备晶体: