-
1、羟基自由基具有极强的氧化能力,它能有效地氧化降解废水中的有机污染物。在直流电源作用下,利用双极膜电解池产生羟基自由基处理含苯酚废水和含甲醛废水,原理如图所示。已知:双极膜中间层中的解离为和。下列说法错误的是
 A、M极为阴极,电极反应式: B、双极膜中解离出的透过膜a向N极移动 C、每处理甲醛,理论上有透过膜b D、通电一段时间后,理论上苯酚和甲醛转化生成物质的量之比为6∶7
A、M极为阴极,电极反应式: B、双极膜中解离出的透过膜a向N极移动 C、每处理甲醛,理论上有透过膜b D、通电一段时间后,理论上苯酚和甲醛转化生成物质的量之比为6∶7 -
2、某溶液中含有较大量的Cl-、、OH-三种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来。下列实验操作的操作顺序中,正确的是
①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液
A、①②④②③ B、④②①②③. C、①②③②④ D、④②③②① -
3、《新修本草》是我国古代中药学著作之一,记载药物844种,其中有关于“青矾”的描述为“本来绿色,新出窟未见风者,正如琉璃……烧之赤色……”据此推测,“青矾”的主要成分为A、 B、 C、 D、
-
4、由下列实验操作及现象能得出相应结论的是
实验操作
现象
结论
A
将溴丁烷与氢氧化钠的乙醇溶液共热,将产生的气体通入酸性高锰酸钾溶液中
酸性高锰酸钾溶液褪色
可证明产生的气体中有烯烃
B
在物质X柱面上滴一滴熔化的石蜡,用一根红热的铁针刺中凝固的石蜡
石蜡熔化呈椭圆形
说明物质X为非晶体
C
碳与二氧化硅在高温下反应
有单质生成
非金属性:
D
向盛有固体的试管中加入溶液
白色固体溶解
促进的沉淀溶解平衡向溶解方向移动
A、A B、B C、C D、D -
5、利用离子液体可电沉积还原金属Ge,其中的结构如图所示。下列有关说法错误的是
 A、该离子液体能导电 B、的空间构型为正四面体形 C、该物质中碳原子的杂化类型为 D、电解沉积金属时,金属在阴极析出
A、该离子液体能导电 B、的空间构型为正四面体形 C、该物质中碳原子的杂化类型为 D、电解沉积金属时,金属在阴极析出 -
6、室温下,在P和Q浓度相等的混合溶液中,同时发生反应①P+Q=X+Z和反应②P+Q=Y+Z,反应①和②的速率方程分别是v1=k1c2(P)、v2=k2c2(P)(k1、k2为速率常数)。反应过程中,Q、X的浓度随时间变化情况如图所示。下列说法错误的是
 A、反应开始后,体系中X和Y的浓度之比保持不变 B、45min时Z的浓度为0.4mol·L-1 C、反应①的活化能比反应②的活化能大 D、如果反应能进行到底,反应结束时,有40%的P转化为Y
A、反应开始后,体系中X和Y的浓度之比保持不变 B、45min时Z的浓度为0.4mol·L-1 C、反应①的活化能比反应②的活化能大 D、如果反应能进行到底,反应结束时,有40%的P转化为Y -
7、溴酸钠和氯化钠的溶解度(S)曲线如图所示。下列各组物质分离提纯方法错误的是

选项
待分离提纯的物质
分离提纯方法
A
分离苯和水
分液
B
除去溴酸钠中的少量氯化钠
重结晶
C
除去乙炔中的少量气体
用溶液洗气
D
除去苯中的少量苯酚
过滤
A、A B、B C、C D、D -
8、油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄褪色的主要原因是发生了以下两种化学反应:

下列说法正确的是
A、和的空间结构都是正四面体形 B、反应Ⅰ和Ⅱ中,元素和S都被氧化 C、反应Ⅰ和Ⅱ中,参加反应的:Ⅰ<Ⅱ D、反应Ⅰ和Ⅱ中,氧化转移的电子数之比为3∶7 -
9、丙烯腈(
 )是合成橡胶及合成树脂等工业中的重要原料,以
)是合成橡胶及合成树脂等工业中的重要原料,以 为原料合成丙烯腈的反应过程如下:
为原料合成丙烯腈的反应过程如下:反应Ⅰ:

反应Ⅱ:

科学家通过计算得出反应Ⅱ的历程包含p、q两步,其中p步反应的化学方程式为:
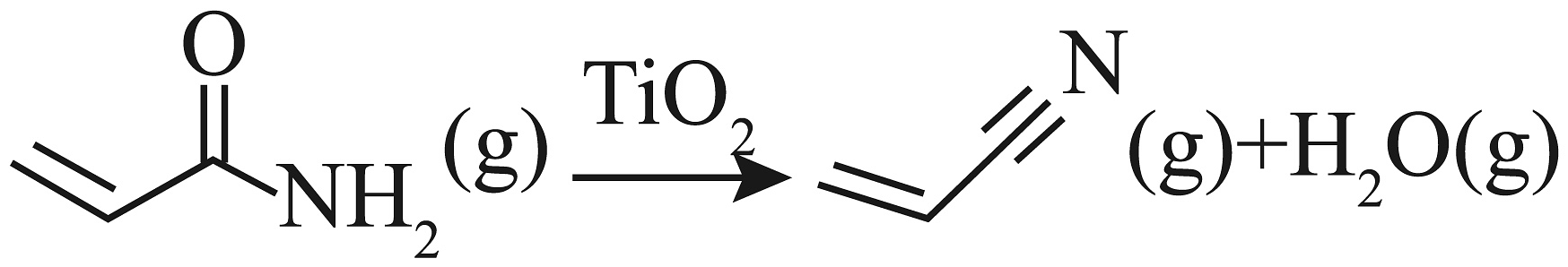
已知:部分化学键键能如下表所示:
化学键
键能(kJ·mol-1)
413
463
389
348
305
615
351
745
891
(1)、q步反应的热化学方程式为。(2)、在盛有催化剂、压强为的恒压密闭容器中按体积比充入 和NH3发生反应,通过实验测得平衡体系中含碳物质(乙醇除外)的物质的量分数随温度的变化如下图所示。
和NH3发生反应,通过实验测得平衡体系中含碳物质(乙醇除外)的物质的量分数随温度的变化如下图所示。
①0(填“>”“<”)。
②含碳物质检测过程中,未检测出
 , 反应活化能相对大小应为pq(填“>”或“<”)。
, 反应活化能相对大小应为pq(填“>”或“<”)。③M点时,体系中的体积分数(保留三位有效数字)。
④N点时,反应Ⅱ的压强平衡常数(保留三位有效数字);范围内,物质的量分数表示的平衡常数的相对大小:反应Ⅰ反应Ⅱ(填“>”“<”或“=”)。
⑤上述条件下丙烯腈的平衡产率不高,实际生产中会向反应器中再充入一定量(不参与反应),请解释该操作的目的并说明理由。
-
10、某研究小组通过下列路线合成药物西地那非。

已知:Mc为甲基(—CH3),Et为乙基(—CH2CH3),Pr为正丙基(—CH2CH2CH3);化合物I中不存在一个氮原子与两个羰基直接相连的结构。
请回答:
(1)、化合物A的含氧官能团的名称是。(2)、试剂Y的结构简式是。(3)、下列说法正确的是___________。A、D→E的反应条件X为浓硝酸、浓硫酸并适当加热 B、化合物I→J的反应主要经历了加成和消去的过程 C、保持其它条件不变,若将B→C中的CH3I改为CH3Cl,则该反应速率将变快 D、可通过测定K的质谱图来确定J→K中ClSO3H参与反应的是Cl原子还是OH基团(4)、写出F与过量NH3反应生成G的化学方程式。(5)、有机玻璃是一种重要的塑料( ),可通过化合物W(
),可通过化合物W( ),聚合得到。设计以丙酮和甲醇为原料合成W的路线(用流程图表示,无机试剂任选)。 (6)、写出同时符合下列条件的化合物C的同分异构体的结构简式。
),聚合得到。设计以丙酮和甲醇为原料合成W的路线(用流程图表示,无机试剂任选)。 (6)、写出同时符合下列条件的化合物C的同分异构体的结构简式。①分子中含有苯环;
②1H-NMR谱和IR谱检测表明:分子中共有4种不同化学环境的氢原子,有氮氧键,无氧氢键和氧氧键;
③分子中没有两个甲基连在同一个碳原子上。
-
11、一种燃煤烟气中CO2的捕集和资源再利用技术可通过图转化过程实现。
 (1)、以过渡金属作催化剂,利用图所示装置可实现“转化”。写出阴极表面的电极反应方程式。
(1)、以过渡金属作催化剂,利用图所示装置可实现“转化”。写出阴极表面的电极反应方程式。 (2)、CO2可以被NaOH溶液捕获。若所得溶液 , 则溶液中含碳微粒(①H2CO3、②、③)的浓度由大到小的顺序为(填序号)。(室温下,的;)(3)、在催化剂下,CO2氧化C2H6可获得C2H4.其主要化学反应为:
(2)、CO2可以被NaOH溶液捕获。若所得溶液 , 则溶液中含碳微粒(①H2CO3、②、③)的浓度由大到小的顺序为(填序号)。(室温下,的;)(3)、在催化剂下,CO2氧化C2H6可获得C2H4.其主要化学反应为:反应I.
反应Ⅱ.
反应Ⅲ.
将4 mol C2H6和6 mol CO2的混合气体置于1.0L恒容密闭容器中反应,乙烷的平衡转化率、乙烯的选择性与温度关系如图所示(C2H4的选择性。

①=。
②M点反应I的平衡常数为(保留两位有效数字)。
③C2H4选择性随温度升高而下降的原因可能是。
(4)、用Fe3(CO)12/ZSM-5催化CO2加氢合成乙烯,所得产物含C3H6、C4H8等副产物,反应过程如图。
催化剂中添加Na、K、Cu助剂后可改变反应的选择性。在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如表所示:
助剂
CO2转化率/%
各产物在所有产物中的占比/%
C2H4
C3H6
其他
Na
42.5
35.9
39.6
24.5
K
27.2
75.6
22.8
1.6
Cu
9.8
80.7
12.5
6.8
下列说法正确的是。
A.催化剂助剂主要在第Ⅰ步起作用
B.在Fe3(CO)12/ZSM-5中添加K助剂时,合成乙烯的效果最好
C.添加助剂不同,CO2加氢合成乙烯的平衡常数不同
D.Fe3(CO)12为簇状超分子,可活化CO
-
12、光盘金属层含有Ag(其它金属微量忽略不计),可以进行资源回收利用,下图为从光盘中提取Ag的工业流程:

已知:①气体A、气体D是空气的主要组成气体。
②配离子的形成是分步进行的: 。
③AgCl的 , 。
请回答:
(1)、已知Ag位于周期表的第五周期IB族,Ag的原子序数为;气体A的化学式为 , 写出溶液C中所有的阳离子。(2)、反应Ⅲ的离子方程式为。(3)、是一个可逆反应。①结合相关数据说明上述反应是可逆反应;
②设计实验验证上述反应是可逆反应。
-
13、氮、碳、硼元素形成的化合物具有独特的结构。请回答:(1)、固态的N2O5为离子晶体(阴阳离子中所含原子个数均不超过4个),其阳离子的空间结构名称为 , 阴离子中氮原子的杂化方式为。(2)、比较酸性强弱:(填“>”、“<”),请说明理由。(3)、当石墨被过量的K处理后(未反应的金属被汞洗出),K+离子在石墨层间嵌入,K+层在石墨层的投影如图所示。该钾石墨晶体的化学式是 , 晶体类型是。
 (4)、石墨与F2在450℃反应,石墨层间插入F得到层状结构化合物(CF)x , 该物质仍具润滑性,其单层局部结构如图所示。下列关于该化合物的说法不正确的是___________。
(4)、石墨与F2在450℃反应,石墨层间插入F得到层状结构化合物(CF)x , 该物质仍具润滑性,其单层局部结构如图所示。下列关于该化合物的说法不正确的是___________。 A、与石墨相比,(CF)x导电性增强 B、与石墨相比,(CF)x抗氧化性增强 C、(CF)x中C—F的键长比C—C短 D、1mol(CF)x中含有2x mol共价单键(5)、硼砂与NaOH的混合溶液中加入H2O2可以制备 , 已知X的阴离子只有一种化学环境的B原子,且B和O原子最外层都达到8电子稳定结构,写出X阴离子的结构式。
A、与石墨相比,(CF)x导电性增强 B、与石墨相比,(CF)x抗氧化性增强 C、(CF)x中C—F的键长比C—C短 D、1mol(CF)x中含有2x mol共价单键(5)、硼砂与NaOH的混合溶液中加入H2O2可以制备 , 已知X的阴离子只有一种化学环境的B原子,且B和O原子最外层都达到8电子稳定结构,写出X阴离子的结构式。 -
14、根据下列有关实验方案设计和现象,所得结论不正确的是
选项
实验方案
现象
结论
A
将打磨过的铁铜合金放在氨水中一段时间
溶液变为深蓝色
可能是铜在氨水中发生吸氧腐蚀
B
向FeCl3溶液中滴加KSCN溶液,再加入少量Cu粉
溶液先变成血红色,加入Cu粉后,血红色变浅
与SCN-的配位能力:
C
将和NH4NO3固体混合并用玻璃棒快速搅拌
有刺激性气味的气体产生,并伴随降温
该反应能发生的主要原因是熵增
D
用精密pH试纸测定溶液的pH值
测得pH为7.8
A、A B、B C、C D、D -
15、常温常压下,H2S气体在水中的饱和浓度约为 , 已知: , ;。下列说法不正确的是A、饱和H2S溶液中存在 B、向溶液中加几滴浓盐酸,使其浓度达到 , 此时溶液中约为 C、向溶液中通入H2S气体直至饱和,溶液中有FeS沉淀生成 D、的平衡常数为
-
16、在葡萄糖水溶液中,链状结构与环状结构的平衡关系及百分含量如下:


下列说法不正确的是
A、链状葡萄糖成环是-OH与-CHO发生加成反应的结果 B、链状葡萄糖成环反应的 , C、链状葡萄糖成环后,分子中多了一个手性碳原子 D、水溶液中,吡喃葡萄糖比吡喃葡萄糖稳定 -
17、如图所示装置中,C1、C2是石墨电极。A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3的混合溶液。当连接开关K,并向B中滴加浓盐酸时,发现灵敏电流计G的指针向右偏转。一段时间后,当电流计指针回到中间“0”位置时,再向B中滴加过量浓NaOH溶液,可观察到电流计指针向左偏转。下列说法正确的是
 A、电流计G的指针向右偏转时,化学能转变为电能;向左偏转时,电能转变为化学能 B、电流计G的指针向右偏转时,C1电极反应为: C、电流计G的指针向左偏转时,C2电极反应为: D、由上述实验现象可知,氧化性:
A、电流计G的指针向右偏转时,化学能转变为电能;向左偏转时,电能转变为化学能 B、电流计G的指针向右偏转时,C1电极反应为: C、电流计G的指针向左偏转时,C2电极反应为: D、由上述实验现象可知,氧化性: -
18、姜黄素X(
 )的合成路线如下:
)的合成路线如下:
下列说法不正确的是
A、A的键线式为 B、B有5种化学环境不同的氢原子
C、有机物C能发生银镜反应
D、X分子中有4种官能团
B、B有5种化学环境不同的氢原子
C、有机物C能发生银镜反应
D、X分子中有4种官能团
-
19、下列化学反应与方程式不相符的是A、少量FeCl3固体加入到KI浓溶液中: B、Cu和浓HNO3反应: C、Al2(SO4)3溶液与Na[Al(OH)4]溶液反应: D、少量甲醛与新制Cu(OH)2反应:
-
20、下列装置能达到实验目的的是




A.熔化Na2CO3
B.验证SO2氧化性
C.实验室制CO2
D.实验室保存液溴
A、A B、B C、C D、D