-
1、黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。四方晶系CuFeS2晶胞结构如图1所示。晶胞中Fe的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。已知图1中原子1的坐标分数为。下列说法错误的是( )
 A、S的配位数为4 B、原子2的分数坐标为 C、Cu核外电子有29种空间运动状态 D、该晶胞密度为
A、S的配位数为4 B、原子2的分数坐标为 C、Cu核外电子有29种空间运动状态 D、该晶胞密度为 -
2、盐酸羟胺(NH2OH·HCl)是一种常见的还原剂和显像剂,工业可采用如下电化学方法制备,其装置和正极反应机理如下图所示。下列有关说法不正确的是( )
 A、X为H+ , Y为NH3OH+ B、含Fe电极只起到导电作用 C、Pt电极上的反应: D、消耗1molNO,有3molH+通过交换膜
A、X为H+ , Y为NH3OH+ B、含Fe电极只起到导电作用 C、Pt电极上的反应: D、消耗1molNO,有3molH+通过交换膜 -
3、Na2B4O7·10H2O俗称硼砂,其部分结构如下图所示。下列说法正确的是( )
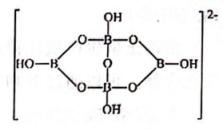 A、硼砂中Na+与结晶水分子的个数比为1:4 B、硼砂阴离子是一个平面结构 C、硼砂中B与O的杂化方式都相同 D、硼砂中存在离子键、共价键、氢键等化学键的相互作用
A、硼砂中Na+与结晶水分子的个数比为1:4 B、硼砂阴离子是一个平面结构 C、硼砂中B与O的杂化方式都相同 D、硼砂中存在离子键、共价键、氢键等化学键的相互作用 -
4、下列有关物质的结构与性质的说法错误的是( )A、冠醚的空穴大小不同,可用于识别碱金属离子 B、F—F键长小于Cl—Cl键长,故F—F键能大于Cl—Cl键能 C、离子键的强度远大于分子间作用力,所以AlF3的熔点远高于AlCl3 D、NaHCO3晶体结构中存在氢键,所以NaHCO3的溶解度比Na2CO3小
-
5、由实验操作及现象,可得出相应结论的是( )
实验操作
现象
结论
A
将乙醇与浓硫酸混合液加热到170℃,将产生的气体通入酸性KMnO4溶液
酸性KMnO4溶液褪色
乙醇发生了消去反应
B
向碳酸钠溶液中滴加醋酸,将产生的气体通入苯酸钠浓液中
溶液变浑浊
酸性:碳酸>苯酚
C
向CuSO4溶液中加入少量NaCl固体,振荡
溶液由蓝色变为黄绿色
配位键的稳定性:[CuCl4]2->[Cu(H2O)4]2+
D
分别测定浓度为0.1mol/L的NaHCO3和CH3COONH4溶液的pH
前者大于后者
水解常数:
A、A B、B C、C D、D -
6、壳聚糖是最丰富的天然高分子多糖之一,可由甲壳素在碱性溶液中煮沸制得,其转化关系如图所示。
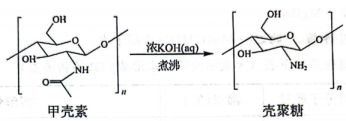
下列有关说法正确的是( )
A、电负性: B、水溶性:壳聚糖>甲壳素 C、壳聚糖均既有酸性又有碱性 D、1mol甲壳素与足量浓KOH(aq)反应,消耗KOH的物质的量为 -
7、我国屠呦呦等科学家使用乙醚从中药中提取并用柱色谱分离得到抗疟有效成分青蒿素。青蒿素为无色针状晶体,在乙醇、乙醚、石油醚中可溶解,在水中几乎不溶。实验室模拟操作流程如下:

已知:步骤③为柱色谱分离
以上实验步骤中不需要用到的装置是( )
A
B
C
D
实验装置



 A、A B、B C、C D、D
A、A B、B C、C D、D -
8、化学之美随处可见。下列化学之美与涉及的化学知识不符的是( )
化学之美
化学知识
A
日照香炉生紫烟
胶体的丁达尔效应
B
瑶池米酒遗凡香
酒香中含有酯类物质
C
东风夜放花千树,更吹落、星如雨
电子跃迁,以光的形式释放能量
D
水晶帘动微风起,满架蔷薇一院香
水晶是熔融态SiO2快速冷却形成
A、A B、B C、C D、D -
9、方程式是物质转化的符号表征形式。下列符号表征错误的是( )A、热碱去油污: B、碱性锌锰电池的正极反应: C、FeSO4溶液中加入H2O2产生沉淀: D、牙膏中添加氟化物预防龋齿:
-
10、腈纶织物广泛用作衣物、床上用品。腈纶由丙烯腈聚合而成。丙烯腈的其中一种制备方法如下:

。设为阿伏加德罗常数的值,下列说法错误的是( )
A、26.5g 分子中含有的键数目为
B、0.1mol
分子中含有的键数目为
B、0.1mol 分子中sp3杂化的原子数目为
C、4.2g
分子中sp3杂化的原子数目为
C、4.2g 和环丁烷的混合物中含有的极性键数目为
D、反应中消耗标准状况下11.2LNH3 , 转移电子数目为
和环丁烷的混合物中含有的极性键数目为
D、反应中消耗标准状况下11.2LNH3 , 转移电子数目为
-
11、蕲艾应用于中医的针灸和熏蒸。艾叶的主要成分之一为崖柏桐,其结构简式如图所示。下列有关该物质的说法错误的是( )
 A、不能使溴水因发生化学反应而褪色 B、分子式为C10H16O C、该分子的一氯代物有7种 D、该分子中的碳原子可能全部共平面
A、不能使溴水因发生化学反应而褪色 B、分子式为C10H16O C、该分子的一氯代物有7种 D、该分子中的碳原子可能全部共平面 -
12、下列有关化学用语表示正确的是( )A、四氯化碳分子空间充填模型:
 B、反-2-丁烯的结构简式:
B、反-2-丁烯的结构简式: C、HCl中σ键的电子云图:
C、HCl中σ键的电子云图: D、基态硒原子的核外电子排布式:[Ar]4s24p4
D、基态硒原子的核外电子排布式:[Ar]4s24p4
-
13、钢是用量最大、用途最广的一种铁碳合金。下列说法错误的是( )A、铁元素位于周期表的d区 B、钢的硬度比纯铁大,熔点比纯铁低 C、人体如果缺乏铁离子,会造成缺铁性贫血 D、不锈钢是最常见的合金钢,它的合金元素主要是Cr和Ni
-
14、化学与生产、生活和科技密切相关。下列说法正确的是( )A、工业上可用石膏调节水泥硬化速度 B、盐卤中含有的氯化镁、硫酸钙是制作豆腐时的营养强化剂 C、用于制作密封材料和人造血管的硅橡胶属于新型无机非金属材料 D、高压法聚乙烯得到高密度聚乙烯(HDPE),可用于生产瓶、桶、管等
-
15、高聚物G是一种合成纤维,以A(邻二甲苯)与E为原料制备J和G的一种合成路线如图所示(部分生成物已略去):

已知:化合物E的键线式为
 。
。回答下列问题:
(1)、A的分子式为。(2)、C的结构简式为。(3)、1molD与足量的金属钠反应最多可生成。(4)、D→H的化学方程式为(5)、H中所含官能团的名称为。(6)、下列有关化合物I和J的说法正确的是(填标号)。a.均可发生氧化反应 b.两者互为同分异构体
c.I→J的反应类型为取代反应 d.含量最高的元素均为氧元素
(7)、某有机物R的分子式为 , R的同分异构体有多种,其中满足下列条件:①除含苯环外不含其他环,且环上只有2个取代基、②含有。满足条件的R的同分异构体种类有( )
A、3种 B、6种 C、9种 D、12种 -
16、乙酸乙酯可用淀粉或纤维素为原料进行制备,合成路线如图所示。
 (1)、M是一种单糖,M的分子式为。(2)、乙酸的官能团名称为。(3)、下列试剂中,能用来检验乙醇已被氧化成乙酸的是____。A、紫色石蕊溶液 B、稀硫酸 C、碳酸钙固体 D、饱和食盐水(4)、反应IV的化学方程式为 , 该反应的反应类型为。(5)、某同学用如图装置制取乙酸乙酯,其中饱和溶液的作用是。
(1)、M是一种单糖,M的分子式为。(2)、乙酸的官能团名称为。(3)、下列试剂中,能用来检验乙醇已被氧化成乙酸的是____。A、紫色石蕊溶液 B、稀硫酸 C、碳酸钙固体 D、饱和食盐水(4)、反应IV的化学方程式为 , 该反应的反应类型为。(5)、某同学用如图装置制取乙酸乙酯,其中饱和溶液的作用是。 (6)、工业上用某烃X和水加成制备乙醇,该加成反应的化学方程式为。
(6)、工业上用某烃X和水加成制备乙醇,该加成反应的化学方程式为。 -
17、Ⅰ、任何化学反应都伴随着能量的变化,通过化学反应,化学能可转化为热能、电能等不同形式的能量。(1)、H2可用于工业合成氨气,已知拆开1molH—H、1molN≡N分别需要吸收的能量为436kJ、946kJ,形成1molN-H会放出能量391kJ,则在反应N2+3H22NH3中,每生成2molNH3放出热量kJ。(2)、电化学法处理SO2是目前研究的热点。利用过氧化氢吸收SO2可消除SO2污染,设计装置如图所示。

①正极的电极反应式为。
②若11.2L(标准状况)SO2参与反应,则迁移H+的物质的量为。
(3)、Ⅱ、已知反应aA(g)+bB(g)cC(g),某温度下,在2L密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。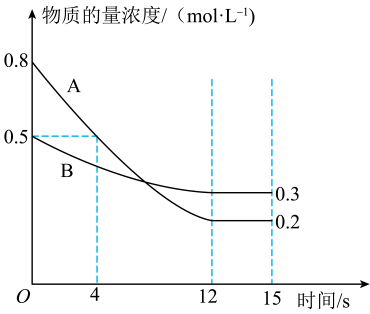
从反应开始到12s时,用A的浓度变化表示的反应速率为。
(4)、经测定,前4s内v(C)=0.05mol•L-1•s-1 , 则该反应的化学方程式为。(5)、在密闭容器里,通入amolA(g)、bmolB(g)、cmolC(g),发生上述反应,当改变下列条件时,反应速率会减小的是____(填字母)。A、降低温度 B、加入催化剂 C、增大容器容积 D、减小容器容积(6)、反应达到平衡时,B的转化率是。(7)、能说明此反应在恒温恒容的密闭容器中达到平衡状态的是。①单位时间内生成amolA的同时生成bmolB
②单位时间内生成amolA的同时生成cmolC
③用A、B、C表示的反应速率之比为a:b:c
④混合气体的密度不再改变
⑤气体B的体积分数不变
⑥混合气体的质量不再改变
-
18、硅、硫、氮等非金属元素在化工生产中扮演着重要角色。(1)、下列物品或设施:①陶瓷餐具②门窗玻璃③水晶镜片④硅太阳能电池⑤光导纤维⑥手机芯片。直接使用了二氧化硅的是(用序号填空)。(2)、写出实验室用Cu制备的化学方程式:(3)、下列五种有色溶液与作用均能褪色
①品红溶液②酸性溶液③溴水④滴有酚酞的NaOH溶液⑤淀粉-碘溶液
体现了还原性的是(用序号填空)。
(4)、如图包含气体发生装置和收集装置(部分装置的夹持仪器已省略)。①实验室制备并收集NO,制备原理为(用化学方程式表示);
应选择的装置是(填字母)。

②选用图B制备的化学反应方程式: , 干燥氨气使用的试剂为(填名称)。
-
19、用和催化合成乙烯的反应原理为: , 向1L恒容密闭的催化反应器中充入和 , 测得温度对的平衡转化率和催化剂催化效率的影响如图。下列说法正确的是( )
 A、容器内气体密度不变可以作为判断反应达到平衡状态的标志 B、生成乙烯的速率:M点一定大于N点 C、250℃时,反应5min后达到平衡状态,则5min内 D、升高温度,催化剂的催化效率降低
A、容器内气体密度不变可以作为判断反应达到平衡状态的标志 B、生成乙烯的速率:M点一定大于N点 C、250℃时,反应5min后达到平衡状态,则5min内 D、升高温度,催化剂的催化效率降低 -
20、将等物质的量的A、B混合于2L的密闭容器中,发生下列反应: , 经2min后测得D的浓度为0.5mol/L, , 以C表示的平均速率 , 下列说法正确的是( )A、反应速率 B、该反应方程式中, C、2min时,A的物质的量为1.5mol D、2min时,A的转化率为60%