-
1、将下列反应产生的气体通入如图所示的装置,所选试剂不能达到实验目的的是

选项
操作
目的
试剂a
试剂b
A
往电石中滴加饱和食盐水
验证乙炔的性质
溶液
酸性溶液
B
混合苯、液溴、铁粉
验证苯的取代反应
无
溶液
C
加热1-溴丁烷与的乙醇溶液
验证反应产生了烯烃
无
溴的溶液
D
往中滴加醋酸
验证酸性:碳酸>苯酚
饱和溶液
苯酚钠溶液
A、A B、B C、C D、D -
2、阿莫西林是常见的抗生素,其结构如图所示,下列说法错误的是
 A、阿莫西林与溶液共热时最多可消耗 B、阿莫西林的分子式为 C、阿莫西林与反应时最多消耗 D、阿莫西林能与浓溴水反应
A、阿莫西林与溶液共热时最多可消耗 B、阿莫西林的分子式为 C、阿莫西林与反应时最多消耗 D、阿莫西林能与浓溴水反应 -
3、设为阿伏加德罗常数值.下列有关叙述正确的是A、甲烷中的氢原子被氯原子完全取代,需要氯气分子数为 B、甘油(丙三醇)中含有羟基数为 C、乙烯和丙烯混合气体中的氢原子数为 D、标准状况下,含有的共价键数为
-
4、自从第一次合成稀有气体元素的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等。如图甲为XeF4的结构示意图,图乙为XeF2晶体的晶胞结构图。下列有关说法正确的是
 A、XeF4是极性分子 B、XeF2晶体属于离子晶体 C、一个XeF2晶胞中实际拥有2个XeF2 D、XeF2晶体中距离最近的两个XeF2之间的距离为a(a为晶胞边长)
A、XeF4是极性分子 B、XeF2晶体属于离子晶体 C、一个XeF2晶胞中实际拥有2个XeF2 D、XeF2晶体中距离最近的两个XeF2之间的距离为a(a为晶胞边长) -
5、下列说法正确的是A、
 的一溴代物和
的一溴代物和 的一溴代物都有4种(不考虑立体异构)
B、等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
C、按系统命名法,化合物
的一溴代物都有4种(不考虑立体异构)
B、等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
C、按系统命名法,化合物 的名称是2,3,4一三甲基-2-乙基戊烧
D、
的名称是2,3,4一三甲基-2-乙基戊烧
D、 和
和 互为同系物
互为同系物
-
6、石棉具有高度耐火性、电绝缘性和绝热性,是重要的防火、绝缘和保温材料,其化学式为 , 其组成也可写成余化物形式:。下列说法正确的是A、组成元素均位于元素周期表的p区 B、的熔点比的高 C、ⅣA族元素单质的晶体类型相同 D、基态硅原子核外电子有8种不同的空间运动状态
-
7、下列说法正确的是A、基态Cr原子的价层电子:3d54s1 , 违反能量最低原理 B、基态C原子的电子排布式:1s22s22px12pz1 , 违反能量最低原理 C、基态C原子的价层电子排布图:
 ,违反泡利原理
D、基态Fe3+的3d电子排布图:
,违反泡利原理
D、基态Fe3+的3d电子排布图: ,违反洪特规则
,违反洪特规则
-
8、溶于浓溶液中可得到配合物。下列说法错误的是A、提供空轨道 B、中心离子的配位数是4 C、含有键数目为 D、向溶液中逐滴滴加浓溶液至过量,先形成蓝色沉淀,后沉淀溶解
-
9、依据元素周期律,下列判断不正确的是A、原子半径:Mg<Na<K B、第一电离能:Li<Be<B C、电负性:N<O<F D、热稳定性:SiH4<PH3<HCl
-
10、下列关于水合氢离子的说法错误的是A、含有极性键 B、空间构型为三角锥形 C、键角: D、和中氧原子均为杂化
-
11、下列化学用语表示正确的是A、中子数为10的氧原子: B、的空间结构:(直线型) C、二甲基甲酰胺的结构简式:
 D、的电子式:
D、的电子式:
-
12、人类对核外电子运动的认知不断进步。下列说法正确的是A、电子在线性轨道上绕核运行 B、电子从激发态跃迁到基态时能产生吸收光谱 C、、、轨道相互平行、能量相等 D、轨道比轨道大,其空间包含了轨道
-
13、下列关于有机化合物的说法不正确的是
A
B
C
D



木糖醇()是一种天然甜味剂,属于糖类化合物
聚乙烯由线型结构转变为网状结构能够增加材料的强度
DNA分子复制过程中存在氢键的断裂和形成
烷基磺酸钠(表面活性剂)在水中聚集形成的胶束属于超分子
A、A B、B C、C D、D -
14、下列实验操作对应的现象预测正确或能达到有关实验目的的是
 A、①可比较、的稳定性 B、②焰色试验检验K元素 C、③分离氯化铁溶液和氢氧化铁胶体 D、④制备氢氧化铁胶体
A、①可比较、的稳定性 B、②焰色试验检验K元素 C、③分离氯化铁溶液和氢氧化铁胶体 D、④制备氢氧化铁胶体 -
15、下列关于物质的结构或性质及解释都正确的是
选项
物质的结构或性质
解释
A
金属活动性:Mg>Al
第一电离能:Mg>Al
B
熔点:SiO2>CO2
相对分子质量:SiO2大于CO2
C
酸性:HCOOH>CH3COOH
O-H的极性:HCOOH强于CH3COOH
D
熔点:Cl2<Br2<I2
键能:Cl-Cl>Br-Br>I-I
A、A B、B C、C D、D -
16、钴的一种化合物的晶胞结构如图所示,已知A点的原子坐标参数为(0,0,0),B点的为 , 晶胞边长为anm,下列说法中不正确的是
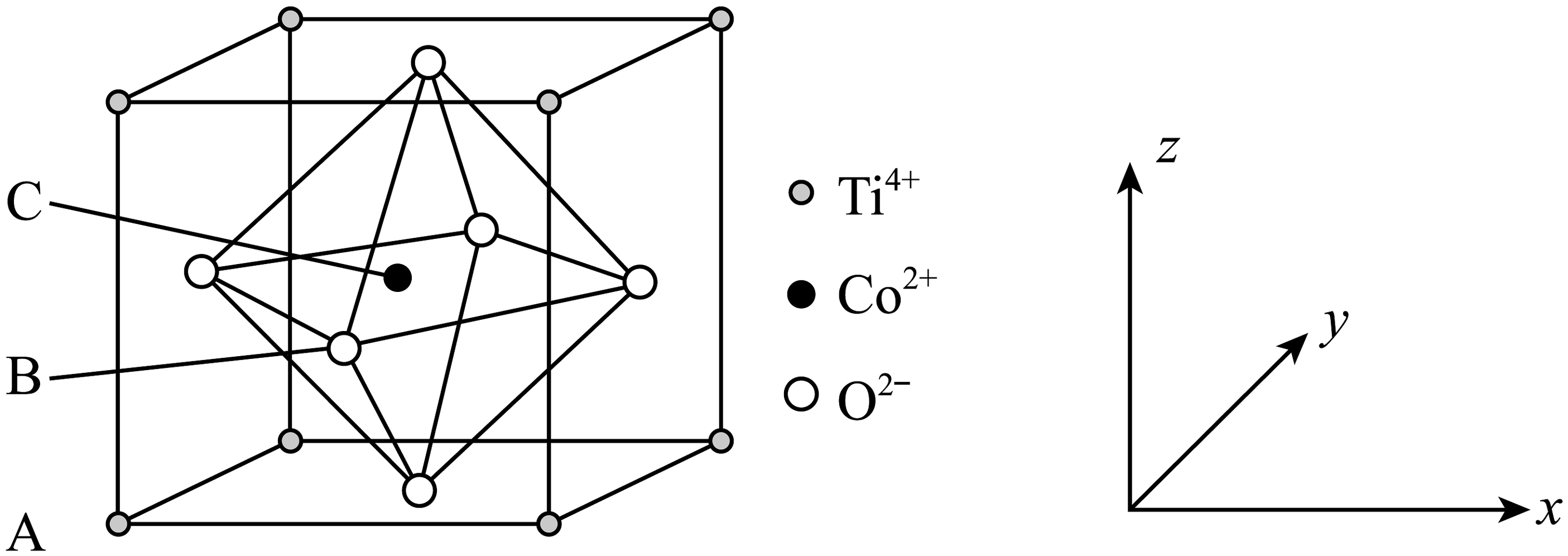 A、与之间的最短距离为 B、距离最近且等距的的数量为6 C、C点的原子坐标数为 D、该物质的化学式为
A、与之间的最短距离为 B、距离最近且等距的的数量为6 C、C点的原子坐标数为 D、该物质的化学式为 -
17、由化合物X、Y为起始原料可合成药物Z。下列说法正确的是( )
 A、X分子中所有碳原子可处于同一平面 B、X、Z分子中均含有2个手性碳原子 C、1molZ最多只能与2molBr2发生反应 D、X、Y、Z均可与NaOH稀溶液发生反应
A、X分子中所有碳原子可处于同一平面 B、X、Z分子中均含有2个手性碳原子 C、1molZ最多只能与2molBr2发生反应 D、X、Y、Z均可与NaOH稀溶液发生反应 -
18、下列陈述Ⅰ和陈述Ⅱ均正确且有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
的非金属性比Si强
溶液中滴加盐酸产生白色浑浊
B
的孤电子对数多于
的键角小于
C
共价键键能小于
晶体沸点高于
D
分子稳定性高于分子
分子间有氢键
A、A B、B C、C D、D -
19、有一份含镁、铝的合金粉末样品,将其分为两等份,向第一份样品中加入过量的氢氧化钠溶液,得到336mLH2(标准状况),向第二份样品中加入100mL1mol/L的盐酸,完全反应后,得到672mLH2(标准状况)。试计算:(1)、原样品中铝的物质的量为。(2)、该合金中镁、铝的物质的量之比为。(3)、为将第二份样品反应后的溶液中的镁、铝元素完全分开,至少需加入1mol/L的NaOH溶液mL。
-
20、氨的催化氧化:是工业生产硝酸的重要步骤。某化学活动小组设计了如下装置模拟该实验过程,并检验产物性质(部分固定装置略去)。

请回答:
(1)、装置A发生的反应有浓氨水的分解,还有(用化学方程式表示)。(2)、装置B的名称为 , B中的药品X为(填选项)。A.浓硫酸 B.胆矾 C.碱石灰 D.碳酸钙
(3)、反应后,装置E中除存在较多的、外,还可能存在的一种阳离子是 , 试设计实验证明这种离子的存在。(4)、E中产生的离子反应方程式是。