-
1、硫酸渣是黄铁矿制备硫酸过程中得到的焙烧渣,主要含、等,工业上可用硫酸渣生产四氧化三铁。

已知:“还原”时,发生反应;与不反应。
请回答:
(1)、滤渣的主要成分是。(2)、溶于足量盐酸的离子方程式为。(3)、下列有关说法不正确的是___________。A、“酸溶”时适当提高硫酸浓度可加快反应速率 B、滤液经结晶过滤可得副产品芒硝 C、可由或铁粉替代 D、“还原”时氧化产物与还原产物的物质的量之比为(4)、“氧化”的条件为高温,写出该反应的化学方程式。 -
2、土豆丝放入水中浸泡,水变浑浊并产生白色沉淀,其主要成分是有机物A,A遇碘会变蓝。以A为原料获得有机物E的转化关系如下图,已知E是有香味的无色油状液体。F含有甲基,且与乙酸、乙醇均能发生酯化反应。

请回答:
(1)、B所含官能团的名称为。(2)、写出F的结构简式。(3)、下列说法正确的是___________。A、检验反应是否进行完全,可取样加入溶液碱化后,再加入新制氢氧化铜悬浊液并加热,看是否产生砖红色沉淀 B、用碳酸钠溶液可以鉴别C、D和E C、有机物C、D、F都能与金属钠反应 D、两分子F可发生酯化反应生成环状的酯(4)、G是F的同分异构体,与乙酸、乙醇也均能发生酯化反应。写出G与乙酸发生酯化反应的方程式。 -
3、请回答:(1)、蔗糖的分子式是;的电子式是。(2)、向溶液中滴加溶液,可观察到 , 最终变成红褐色沉淀。(3)、浓硫酸与木炭加热时的化学反应方程式是。
-
4、根据实验操作和现象得出的结论正确的是
选项
实验操作和现象
结论
A
向某钠盐中加入稀盐酸,产生能使澄清石灰水变浑浊的气体
说明该盐一定是碳酸盐或碳酸氢盐
B
向某溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成
该溶液中一定含
C
向某溶液中滴加少量NaOH溶液,没有产生能使湿润红色石蕊试纸变蓝的刺激性气体
该溶液中不含
D
向Al(OH)3沉淀中滴加NaOH溶液,沉淀溶解
铝有一定的非金属性
A、A B、B C、C D、D -
5、、、三种固体溶于水得溶液M,部分离子的物质的量浓度如图甲所示。取200mL混合溶液加水稀释,测得随溶液体积的变化如图乙所示。下列说法正确的是
 A、Y离子可能是 B、 C、溶液M中物质的量浓度为0.10mol/L D、固体溶解时,与物质的量之比为1:1
A、Y离子可能是 B、 C、溶液M中物质的量浓度为0.10mol/L D、固体溶解时,与物质的量之比为1:1 -
6、溶液可用于脱除烟气中的有害气体 , 其原理如图所示。下列说法不正确的是
 A、“反应Ⅱ”中还原剂为 B、“反应Ⅰ”的离子方程式为: C、反应一段时间后,溶液中不变 D、反应每脱除消耗的体积为5.6L(体积均为标准状况)
A、“反应Ⅱ”中还原剂为 B、“反应Ⅰ”的离子方程式为: C、反应一段时间后,溶液中不变 D、反应每脱除消耗的体积为5.6L(体积均为标准状况) -
7、某小组以石膏()为主要原料制备的流程如下:

下列说法不正确的是
A、气体A是 , 气体B是 B、甲乙的过程中应通入过量气体B C、操作I用的主要玻璃仪器为烧杯、玻璃棒、普通漏斗 D、整个过程的总反应方程式为 -
8、下列说法不正确的是A、工业生产活泼金属可采用电解的方式,如电解氯化镁溶液生产镁单质 B、加工面包和饼干时,可加入一些膨松剂,如碳酸氢钠、碳酸氢铵等 C、化学反应
 的原子利用率为100%
D、包装上有“OTC”标示的是非处方药,无需医生处方可自行购买和使用
的原子利用率为100%
D、包装上有“OTC”标示的是非处方药,无需医生处方可自行购买和使用
-
9、一定温度下,在2 L容积不变的密闭容器中发生反应:。反应过程中的部分数据如下表所示,下列说法不正确的是
物质的量/mol
时间/min
n(CO2)
n(H2)
n(CH3OH)
n(H2O)
0
2
8
0
0
3
1
1
6
0.5
1.5
9
3.5
A、0~3内,H2的平均反应速率为0.5 mol/(L·min) B、保持恒容,若通入He使容器内压强增大,反应速率保持不变 C、6~9 min内, D、若容器内的压强不再发生变化,说明反应已达平衡 -
10、为阿伏加德罗常数的值。下列说法不正确的是A、一定量与足量氧气发生催化氧化反应生成 , 转移电子数为 B、标准状况下,11.2L氯仿中含有键的数目为 C、20g重水()分子中含有的中子数为 D、28g乙烯和丙烯的混合物完全燃烧时,产生的分子数目为
-
11、如图为发光二极管连接柠檬电池的装置,下列说法正确的是
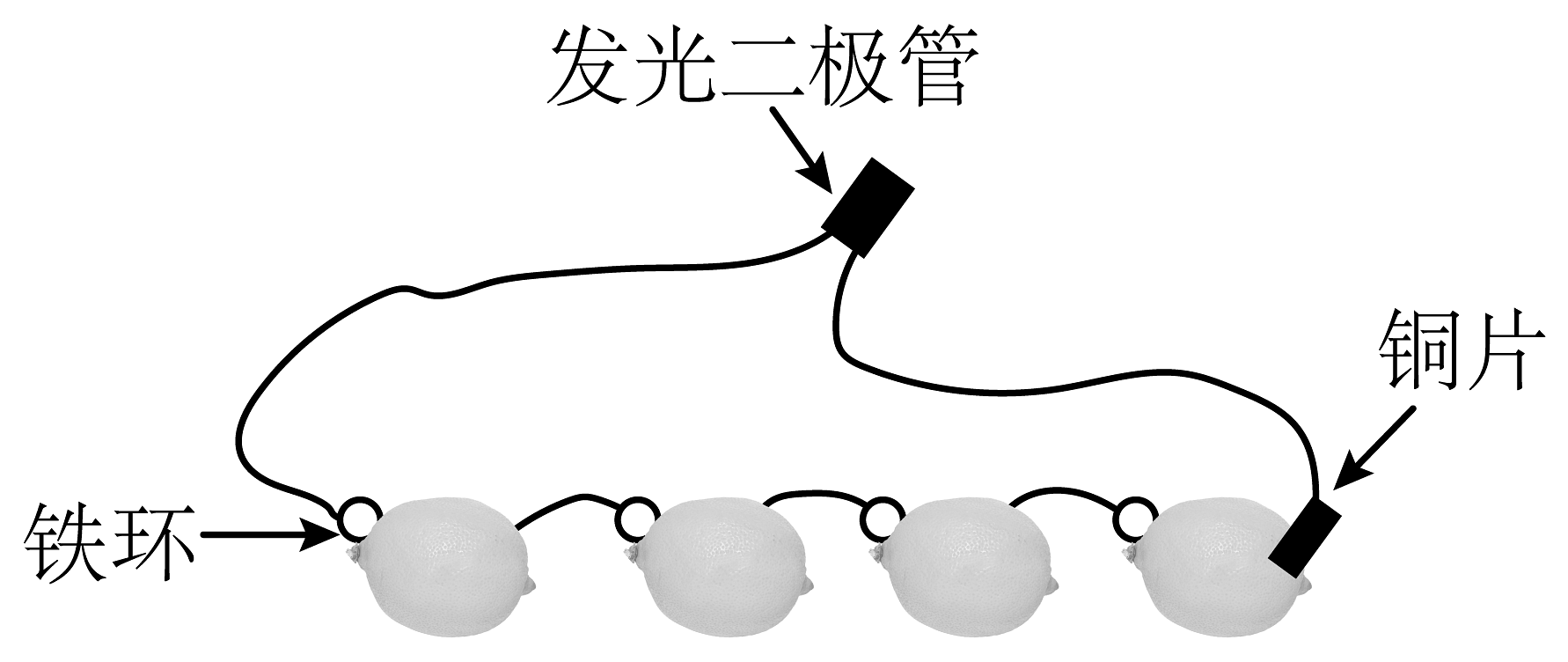 A、电子由铁环经发光二极管流向铜片 B、铜片作柠檬电池的正极,发生氧化反应 C、负极的电极反应式为 D、可将柠檬换成盛有葡萄糖溶液的装置
A、电子由铁环经发光二极管流向铜片 B、铜片作柠檬电池的正极,发生氧化反应 C、负极的电极反应式为 D、可将柠檬换成盛有葡萄糖溶液的装置 -
12、化学反应的能量变化如图所示,则下列说法中不正确的是
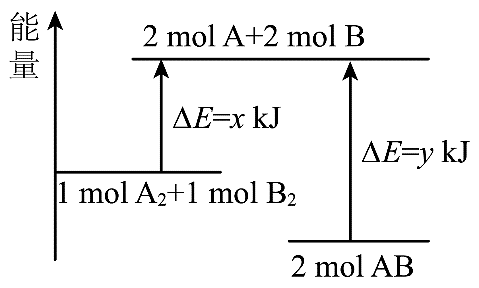 A、上述反应是放热反应 B、和总能量高于总能量 C、断开化学键消耗的总能量大于形成化学键释放的总能量 D、若反应生成液态AB,放出的热量大于
A、上述反应是放热反应 B、和总能量高于总能量 C、断开化学键消耗的总能量大于形成化学键释放的总能量 D、若反应生成液态AB,放出的热量大于 -
13、下列物质既有极性键,又有非极性键的是A、CaCl2 B、Na2O2 C、CH3OH D、C2H4
-
14、下列有关实验的描述正确的是A、甲烷与乙烯混合物可通过溴的四氯化碳溶液分离 B、配制一定物质的量浓度的溶液,定容时俯视读数,则所配溶液浓度偏大 C、向某溶液中滴加氯,再滴加溶液,溶液变红,可证明原溶液含 D、乙醇与金属钠能反应,且在相同条件下比水与金属钠的反应更剧烈
-
15、下列说法不正确的是A、苯(
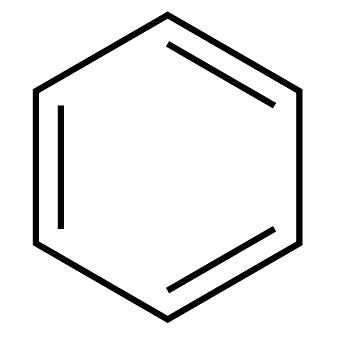 )属于芳香烃,其一溴代物只有一种
B、高级脂肪酸甘油酯在碱性条件下可发生水解反应,又称为皂化反应
C、乙醇分子中含有-OH,能和盐酸发生中和反应
D、食醋可清除水壶中的少量水垢,说明乙酸的酸性强于碳酸
)属于芳香烃,其一溴代物只有一种
B、高级脂肪酸甘油酯在碱性条件下可发生水解反应,又称为皂化反应
C、乙醇分子中含有-OH,能和盐酸发生中和反应
D、食醋可清除水壶中的少量水垢,说明乙酸的酸性强于碳酸
-
16、下列有关实验的叙述正确的是


A.实验室制取氨气
B.A处通入氯气,C处布条不褪色,推测B处可能盛放饱和NaCl溶液


C.除去乙烯中混有的SO2
D.除去CO2气体中的氯化氢杂质
A、A B、B C、C D、D -
17、下列化学用语书写正确的是A、钠与乙酸反应的离子方程式: B、碳酸氢钠溶液中滴入澄清石灰水: C、用电子式表示的形成过程:
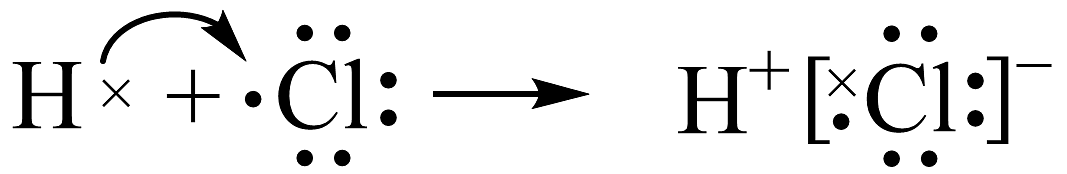 D、用足量氢氧化钠溶液吸收氯气的离子方程式:
D、用足量氢氧化钠溶液吸收氯气的离子方程式:
-
18、下表是元素周期表的一部分,①~⑥代表6种短周期主族元素,已知③原子的最外层电子数是其内层电子总数的3倍。
①
②
③
④
⑤
⑥
⑦
下列说法不正确的是
A、原子半径的大小顺序:④⑤①② B、最高价氧化物对应水化物酸性:①② C、③和④可形成含共价键的离子化合物 D、气态氢化物热稳定性:⑥③ -
19、下列说法不正确的是A、干燥的氯气能使鲜花褪色 B、二氧化硅可用于制作光学玻璃、集成电路和光导纤维 C、二氧化硫可用作蜜饯、干果等食品的添加剂 D、工业上可用铁或铝制容器来储运浓硫酸和浓硝酸
-
20、下列说法不正确的是A、CH4和C8H18互为同系物 B、石墨和石墨烯互为同素异形体 C、正戊烷和异戊烷互为同分异构体 D、和互为同位素