-
1、废旧三元锂电池的正极材料含有、、、、、 , 一种综合回收利用的工艺流程如图所示:

已知:①“高温热解还原”后镍、钴以单质的形式存在,锂以的形式存在,锰以的形式存在,常温下的溶解度比小;
②该废旧三元锂电池中的物质的量分数远大于的物质的量分数;
③相关金属离子沉淀的pH范围如表所示(当溶液中剩余离子浓度小于等于时,认为沉淀完全):
离子
开始沉淀时的pH
1.5
3.6
均
沉淀完全时的pH
2.8
4.7
/
回答下列问题:
(1)、基态Ni原子的价层电子排布式为 .(2)、“高温热解还原”是通入将、、还原,其与T的关系如图所示:
镍钴锰金属氧化物在气氛下的关系图
①将还原的化学方程式为;
②在以下不能将还原成单质的原因是;
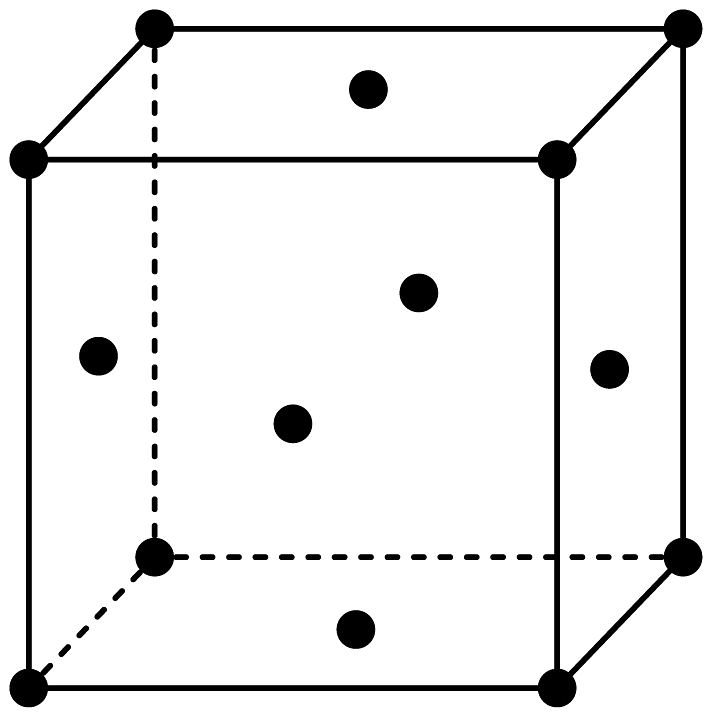
(3)、若“水浸”时间过长,会降低锂的浸出率,其可能原因是;“滤液1”中的主要离子有(填离子符号);(4)、“酸解氧化”过程中最宜加入的氧化剂化学式为;(5)、“水解”时用溶液调节溶液pH的范围为;(6)、镍是较为稀缺的战略性金属,一种的立方晶胞结构如图所示,与Ni原子距离最近且相等的O原子有个;下列视图中,该晶胞的俯视图为(填图示字母);
A.
 B.
B. C.
C. D.
D.
-
2、某小组进行电解溶液的实验探究.
回答下列问题:
(1)、配制溶液。①下列仪器不需要用到的是(填选项字母);
A.
 B.
B. C.
C. D.
D.
②配好的溶液需加入少量铁粉防止氧化变质,其原理是(用离子方程式表示);
(2)、甲小组用如图所示的装置电解不同pH条件下的溶液(电压为1.5V),记录现象如表所示:
实验编号
溶液pH
阳极
阴极
试纸颜色
溶液变化
取电极附近溶液滴加KSCN溶液
是否有气泡
电极是否有镀层
1
4.91
不变
黄绿色,浑浊
盐酸酸化后变红
无
有
2
2.38
不变
黄绿色,少量浑浊
无需酸化变红
无
有
3
不变
黄绿色,无浑浊
无需酸化变红
有
难形成
①为减少其他干扰,应用(填试剂名称)调节溶液的pH;
②实验1电解结束后阳极表面附有少量红褐色固体,则阳极的电极反应式为;
③实验1~3说明,随pH的降低,阳极的主要产物最终变为(填离子符号),请根据实验现象描述随pH的变化,阴极主要产物的变化为;
(3)、乙小组同学发现上述三个实验中阳极均无生成,小组利用上述装置和试剂设计了如下实验进一步探究,记录现象如表所示:实验编号
溶液pH
电压/V
阳极
阴极
试纸颜色
溶液变化
取电极附近溶液滴加KSCN溶液
是否有气泡
电极是否有镀层
4
c
1.5
不变
缓慢变黄绿色
盐酸酸化才变红
无
约
5
3
不变
缓慢变黄绿色
盐酸酸化才变红
极少
约
6
4.5
长时间后稍变蓝
黄绿色
红色
少量
迅速
7
6
明显变蓝
很快变黄绿色
暗红色
大量
迅速
①;
②实验4~7说明,电压增大后,阳极附近溶液生成 , 实验6、7中使KSCN溶液变红色的物质可能由(用离子方程式表示)反应产生
-
3、向甲、乙均为1L的恒容密闭容器中均充入和 , 在恒温或绝热的条件下仅发生反应 , 测得压强随时间变化的曲线如图所示.下列说法错误的是
 A、 B、乙容器中的反应条件为恒温 C、a,b两点对应容器中气体的总物质的量相等 D、乙容器中内
A、 B、乙容器中的反应条件为恒温 C、a,b两点对应容器中气体的总物质的量相等 D、乙容器中内 -
4、乙烯在酸催化下与水反应生成乙醇的能量变化与反应历程的关系如图所示.下列说法正确的是
 A、反应历程中的决速步骤为放热反应 B、1mol乙烯和1mol水的总键能比1mol乙醇总键能大 C、第一步反应只断裂非极性键 D、反应历程中中间体②比中间体①更稳定
A、反应历程中的决速步骤为放热反应 B、1mol乙烯和1mol水的总键能比1mol乙醇总键能大 C、第一步反应只断裂非极性键 D、反应历程中中间体②比中间体①更稳定 -
5、利用化学知识解决问题,下列应用涉及反应的离子方程式书写正确的是A、用盐酸除水壶的水垢(): B、“海水提镁”中用石灰乳沉镁: C、利用覆铜板制作印刷电路板: D、侯氏制碱法:
-
6、下列陈述Ⅰ与陈述Ⅱ均正确且具有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
利用铝热反应焊接铁轨
是分子晶体
B
一些含钾物质可用于制作紫色烟花
钾原子核外电子从高能级跃迁到低能级产生紫光
C
将煤气化生成水煤气
煤的气化属于物理变化
D
用pH试纸测新制氯水的pH
新制氯水是酸性的
A、A B、B C、C D、D -
7、部分含Cl物质的分类与化合价之间的关系如图所示.下列推断错误的是
 A、①与⑥反应可制得② B、②、③都可以用于自来水消毒 C、⑤暴露在空气中可生成④ D、⑥的阴离子VSEPR模型为三角锥形
A、①与⑥反应可制得② B、②、③都可以用于自来水消毒 C、⑤暴露在空气中可生成④ D、⑥的阴离子VSEPR模型为三角锥形 -
8、利用如图所示的微型实验装置制取并探究其性质.下列说法正确的是
 A、锥形瓶中的反应体现了硫酸的氧化性和酸性 B、a处布条和c处棉花都褪色,均体现了的漂白性 C、一段时间后,b处产生黄色浑浊 D、若将b处溶液换成溶液,则会产生白色沉淀
A、锥形瓶中的反应体现了硫酸的氧化性和酸性 B、a处布条和c处棉花都褪色,均体现了的漂白性 C、一段时间后,b处产生黄色浑浊 D、若将b处溶液换成溶液,则会产生白色沉淀 -
9、没食子酸有广谱抗菌、抗病毒和抗肿瘤的作用,其结构简式如图所示。下列关于没食子酸的说法错误的是
 A、能发生加成反应 B、最多能与等物质的量的反应 C、分子中C原子有和两种杂化方式 D、能与氨基酸中的氨基反应
A、能发生加成反应 B、最多能与等物质的量的反应 C、分子中C原子有和两种杂化方式 D、能与氨基酸中的氨基反应 -
10、下列校本课程中涉及的劳动项目与化学知识没有关联的是
选项
劳动项目
化学知识
A
帮厨活动:煎鱼时同时加酒和醋
生成有香味的酯类物质
B
家务劳动:油锅起火时不能用水灭火
油脂可发生水解反应
C
学农活动:用大豆酿制酱油
蛋白质水解生成氨基酸
D
环保行动:用除去废水中的
溶度积:
A、A B、B C、C D、D -
11、以二氧化铪()为原料,通过电解脱氧法可制得杂质含量很低的铪,其工作原理如图所示.下列说法错误的是
 A、电极b与电源负极相连 B、电极a的电极反应式为 C、电解时移向电极a D、电极b发生氧化反应
A、电极b与电源负极相连 B、电极a的电极反应式为 C、电解时移向电极a D、电极b发生氧化反应 -
12、衣食住行皆化学.下列说法错误的是A、用四氯乙烯干洗剂除去衣服上油污,发生的是物理变化 B、向葡萄酒中添加适量 , 可起到杀菌抗氧化的作用 C、用84消毒液或双氧水消毒住宅可减少病毒滋生 D、蒸馏“地沟油”可获得“生物柴油”,“生物柴油”属于烃类有机物
-
13、乙烯的产量可以衡量一个国家石油化工的发展水平,某小组利用下列装置制备乙烯并进行实验,其中能达到预期目的的是




A.制备乙烯
B.净化乙烯
C.收集乙烯
D.验证乙烯与溴发生反应
A、A B、B C、C D、D -
14、从化学视角了解岭南文化.下列说法错误的是A、湛江湖光岩湖水湛蓝无比,湖水中含有的是正四面体形结构 B、粤剧服装绚丽多彩,丝绸的主要成分是蛋白质 C、“一骑红尘妃子笑,无人知是荔枝来”,荔枝中的果糖与葡萄糖是同分异构体 D、“化州橘红”能润肺止咳,水泡橘红的过程涉及萃取原理
-
15、中国首个自主研制的火星探测器“天问一号”成功实现火星捕获,迈出了中国行星探测的第一步.下列说法正确的是A、航天防热涂层中的酚醛树脂是通过加聚反应制得的 B、温控系统中的镁铝合金熔点比纯铝高 C、在探测器“落”“巡”任务中发挥作用的纳米气凝胶能产生丁达尔效应 D、新型铝基碳化硅复合材料中的增强体是分子晶体
-
16、农耕文明是中华文明的重要载体.下列农具的材料属于高分子的是
选项
A
B
C
D
材料




名称
石制碌轴
木制水转筒车
青铜杵臼
汉代铁锄
A、A B、B C、C D、D -
17、黄金按质量分数分级,纯金为。合金的三种晶胞结构如图,Ⅱ和Ⅲ是立方晶胞。下列说法错误的是
 A、I为金 B、Ⅱ中的配位数是12 C、Ⅲ中最小核间距 D、I、Ⅱ、Ⅲ中,与原子个数比依次为、、
A、I为金 B、Ⅱ中的配位数是12 C、Ⅲ中最小核间距 D、I、Ⅱ、Ⅲ中,与原子个数比依次为、、 -
18、化合物Ⅶ是制备抗菌药的中间体,实验室以芳香化合物Ⅰ为原料制备Ⅶ的一种合成路线如下:
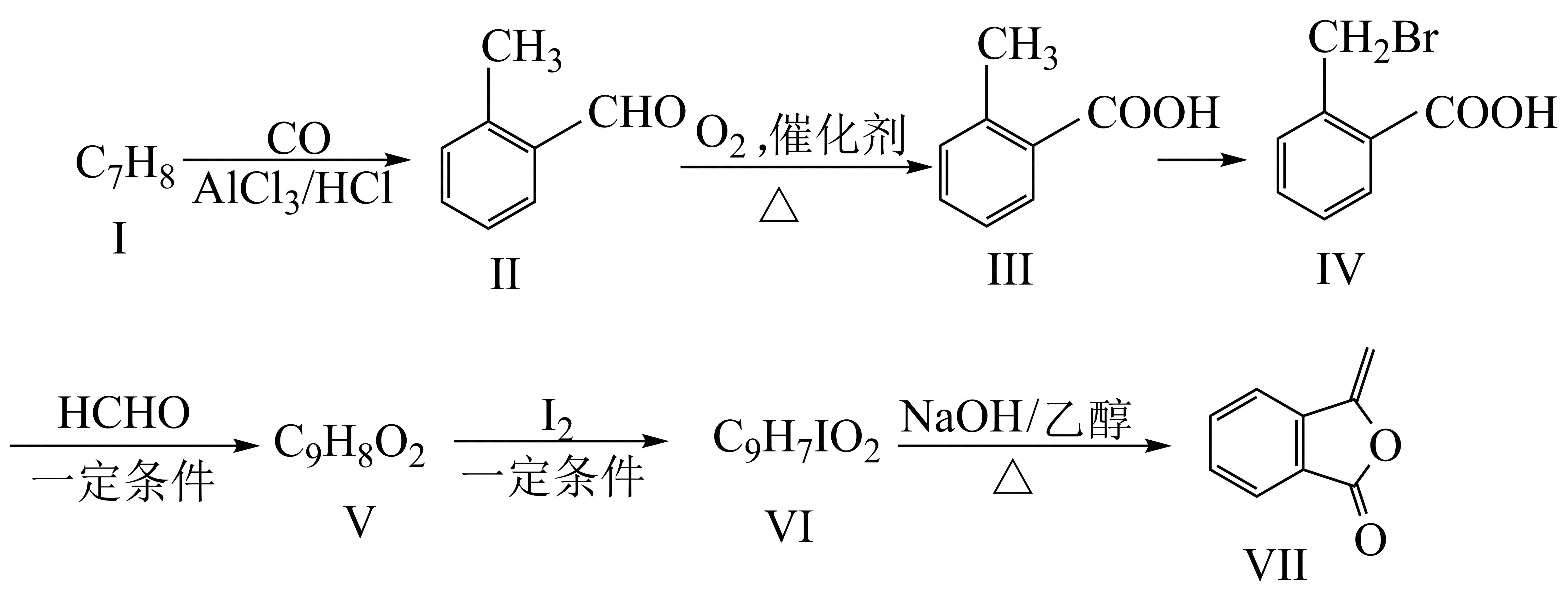
已知:

回答下列问题:
(1)、化合物Ⅰ的名称为;化合物Ⅳ含有的官能团的名称是。(2)、化合物Ⅴ的结构简式为;化合物Ⅵ→化合物Ⅶ的反应类型为。(3)、化合物Ⅱ→化合物Ⅲ的化学方程式为。(4)、芳香化合物Ⅹ是化合物Ⅳ的同分异构体,同时满足如下条件的化合物Ⅹ的结构有种(不考虑立体异构);条件:a)含有的官能团的种类和数目与化合物Ⅳ的相同;b)苯环上有两个取代基
其中,核磁共振氢谱有四组峰的结构简式(任写一种)。
(5)、根据上述信息,写出以溴乙烷为原料制备聚-2-丁烯的合成路线 (无机试剂任选,需注明反应条件)。 -
19、2021年全世界前沿新材料领域取得新的进展。推动了高技术产业变革,钛(Ti)被称为“未来世界的金属”,广泛应用于国防、航空航天、生物材料等领域。请回答下列问题:(1)、钛的核外电子排布式是 , 与钛同周期的元素中,基态原子的未成对电子数与钛相同的有种。(2)、钛元素的检验方法如图:

可与形成配离子 , 其原因是。
(3)、二氧化钛()是一种常用的、具有较高催化活性和稳定性的光催化剂,也常用于污水处理。纳米催化的一个实例如图所示:
化合物乙的分子中采取杂化方式成键的原子数目是个。
(4)、氮化钛晶体的晶胞结构如图所示,则氮化钛晶体化学式为 , 该晶体结构中与N原子距离最近且相等的N原子有个;该晶胞的密度 , 则晶胞结构中两个氮原子之间的最近距离为。(为阿伏加德罗常数的数值,只列计算式)
-
20、铁是地球上分布最广泛的金属之一,约占地壳质量的5%,仅次于氧、硅、铝,位居地壳含量第四位。蛋白琥珀酸铁(CaHbOcNdFe)口服液可以用来治疗缺铁性贫血的治疗。请回答以下相关问题:(1)、写出基态铁原子的价层电子排布式。(2)、给出蛋白琥珀酸铁含有的C、N、O三种元素的第一电离能从小到大排序 , 并解释原因。(3)、将C、N、O三种元素最简单氢化物按照键角从大到小排序。(4)、已知O、S、Se、Te在元素周期表中位于同主族,将这四种元素的最简单氢化物按照沸点从大到小排序。(5)、琥珀酸的结构如图所示,写出琥珀酸分子中σ键与π键的个数比。
 (6)、金属羰基化合物在催化反应中有着重要的作用,其本质是金属原子与一氧化碳中的碳原子形成配位键。金属原子在形成最稳定的羰基化合物时要遵守18电子规则,即每个金属原子的价层都满足18电子结构。若金属价层电子数为奇数,则可以通过两个金属原子之间形成共价单键实现价层电子数为偶数。根据以上信息,写出Fe原子最稳定的羰基化合物的分子式。(7)、铁有多种同素异形体,在910-1400℃范围内,铁以面心立方最密堆积存在,如图为面心立方堆积的铁的晶胞。已知铁的摩尔质量为Mg/mol,铁原子的半径为rpm,给出铁晶胞密度的表达式 g•cm-3。
(6)、金属羰基化合物在催化反应中有着重要的作用,其本质是金属原子与一氧化碳中的碳原子形成配位键。金属原子在形成最稳定的羰基化合物时要遵守18电子规则,即每个金属原子的价层都满足18电子结构。若金属价层电子数为奇数,则可以通过两个金属原子之间形成共价单键实现价层电子数为偶数。根据以上信息,写出Fe原子最稳定的羰基化合物的分子式。(7)、铁有多种同素异形体,在910-1400℃范围内,铁以面心立方最密堆积存在,如图为面心立方堆积的铁的晶胞。已知铁的摩尔质量为Mg/mol,铁原子的半径为rpm,给出铁晶胞密度的表达式 g•cm-3。