-
1、符号表征是理解和描述化学反应的基础。下列相关反应的离子方程式正确的是A、与铝粉的固体混合物用于疏通管道: B、用食醋除去水壶中的水垢: C、用溶液刻蚀覆铜板: D、通入石灰乳中制备漂白粉:
-
2、我国科学家研发了一种光催化合成的方法,其原理如图所示。下列说法不正确的是
 A、是该反应的氧化产物 B、反应中有极性键的断裂和生成 C、理论上,每消耗 , 生成 D、反应前后,催化剂的质量和化学性质不变
A、是该反应的氧化产物 B、反应中有极性键的断裂和生成 C、理论上,每消耗 , 生成 D、反应前后,催化剂的质量和化学性质不变 -
3、下列劳动项目与所述的化学知识没有关联的是
选项
劳动项目
化学知识
A
用硫酸铜对游泳池进行消毒
硫酸铜溶液显蓝色
B
用干燥的模具盛装熔融钢水
红热的铁能与水蒸气发生反应
C
回收废弃塑料以减少“白色污染”
大部分塑料在自然环境中难降解
D
用厨余垃圾制肥料
厨余垃圾含等元素
A、A B、B C、C D、D -
4、物质检验是确定物质组成、性质等的重要方法。下列说法不正确的是A、可用银氨溶液检验淀粉的水解是否完全 B、可利用丁达尔效应区分胶体和溶液 C、可用溶液检验溶液是否氧化变质 D、可利用焰色试验检验固体中所含阳离子
-
5、物质的性质决定其用途。下列物质性质与用途具有对应关系的是
选项
性质
用途
A
氨气易液化,液氨汽化时要吸收大量的热
液氨可用作制冷剂
B
氧化铁能与酸反应
氧化铁可用作油漆颜料
C
油脂易溶于有机溶剂
油脂可用于生产甘油
D
可与碱反应
小苏打可用作食品膨松剂
A、A B、B C、C D、D -
6、乙烯是石油化工重要的基本原料。以乙烯为原料合成环氧乙烷、聚乙烯的路线如图所示,下列说法正确的是
 A、环氧乙烷属于烃 B、反应①的原子利用率为 C、乙烯是聚乙烯的链节 D、聚乙烯能使酸性高锰酸钾溶液褪色
A、环氧乙烷属于烃 B、反应①的原子利用率为 C、乙烯是聚乙烯的链节 D、聚乙烯能使酸性高锰酸钾溶液褪色 -
7、在实验室进行的制备、除杂、性质检验及尾气处理实验(“→”表示气流方向)。下列装置不能达到实验目的的是


A.制备
B.除去中混有的


C.验证能否与水发生反应
D.尾气处理
A、A B、B C、C D、D -
8、我国科研工作者研发和反应的新型催化剂,实现了清洁能源的高效生产。下列说法正确的是A、的电子式为
 B、互为同位素
C、该过程发生的反应为
D、燃烧会释放大量的热
B、互为同位素
C、该过程发生的反应为
D、燃烧会释放大量的热
-
9、深中通道的建设推动了粤港澳大湾区城市群融合发展。下列说法不正确的是A、沉管隧道对接使用的定位芯片的主要成分为 B、悬索桥主缆使用的钢丝的硬度比纯铁的大 C、桥面铺装使用的沥青可通过石油分馏获得 D、供电系统使用的太阳能电池工作时将电能转化为化学能
-
10、中国古代器皿暗藏无尽雕塑韵律之美。下列器皿主要由天然有机高分子材料制成的是




A.西周青铜盉
B.西汉玉角杯
C.元朝银槎杯
D.明朝竹根雕杯
A、A B、B C、C D、D -
11、有机太阳能电池利用有机半导体将光能转换为电能。科学家设计了一种新型有机太阳能电池材料,其部分合成路线如下:
 (1)、化合物ii的含氧官能团名称是 , 化合物iii的分子式是。(2)、化合物i的同分异构体中,能发生水解反应的芳香化合物的结构简式为。(3)、根据化合物vi的结构特征,分析预测其可能的化学性质,完成下表。
(1)、化合物ii的含氧官能团名称是 , 化合物iii的分子式是。(2)、化合物i的同分异构体中,能发生水解反应的芳香化合物的结构简式为。(3)、根据化合物vi的结构特征,分析预测其可能的化学性质,完成下表。序号
结构特征
反应试剂、条件
反应形成的新结构
反应类型
a
b
,
取代反应
(4)、由化合物生成化合物iv涉及以下转化过程(未注明反应条件),下列有关叙述正确的有___________。 A、反应②是消去反应 B、反应③中,有C-O键的断裂和生成 C、化合物x中,碳原子均采取杂化 D、化合物ix是手性分子,含有2个手性碳原子(5)、化合物v(
A、反应②是消去反应 B、反应③中,有C-O键的断裂和生成 C、化合物x中,碳原子均采取杂化 D、化合物ix是手性分子,含有2个手性碳原子(5)、化合物v( )可通过频哪醇()和联硼酸[]的脱水反应制备,频哪醇的结构简式是。 (6)、以第(4)问中化合物ii转化为化合物iv的原理为依据,设计以<>
)可通过频哪醇()和联硼酸[]的脱水反应制备,频哪醇的结构简式是。 (6)、以第(4)问中化合物ii转化为化合物iv的原理为依据,设计以<> 和化合物iii(
和化合物iii( )为原料合成化合物xi。
)为原料合成化合物xi。
基于你设计的合成路线,回答下列问题:
(a)最后一步反应中,有机反应物为(写结构简式)。
(b)第一步的化学方程式为(注明反应条件)。
-
12、铜及其合金是人类最早使用的金属材料,铜的化合物在现代生活和生产中有着广泛的应用。(1)、基态铜原子的价电子排布式是。(2)、铜和钙都是金属晶体,铜的熔点比钙的高,其原因是。(3)、如图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为。
 (4)、科学家通过X射线推测,胆矾的结构如下图所示。
(4)、科学家通过X射线推测,胆矾的结构如下图所示。
①胆矾的阳离子中心原子的配位数为 ,
胆矾的化学式用配合物的形式可表示为;
②具有对称的空间构型,中的两个被两个取代,能得到两种不同结构的产物,则的中心离子与配体形成的空间构型是。
A.三角锥形 B.正四面体 C.平面正方形 D.四角锥形
(5)、Cu与Cl构成晶体的晶胞结构如下图所示,该晶体组成的最简式为 , 已知该晶体的密度为4.14g/cm3 , 则该晶胞的边长为pm(列计算式,设为阿伏加德罗常数的值)。若将该物质气化后实验测定其蒸汽的相对分子质量为199,则其气体的分子式为。
-
13、
硼是一种用途广泛的化工原料矿物,主要用于生产硼砂、硼酸和硼的各种化合物。回答下列问题:
I.一种比事光声探针M与配位,可用于小鼠脑内铜(II)的高时空分辨率动态成像。反应如下所示:

已知:“
 ”表示的化学键伸向纸面外,“
”表示的化学键伸向纸面外,“ ”表示的化学键伸向纸面内。
”表示的化学键伸向纸面内。(1)H、C、N、F四种元素电负性由大到小的顺序为________,M中F-B-F键角________中F-B-F键角(填“>”、“<”或“=”)。
II.B的简单氢化物不能游离存在,常倾向于形成较稳定的或与其他分子结合。
(2)分子结构如图,则B原子的杂化方式为________。

Ⅲ.硼酸在电子器件工业和医疗上有重要用途。硼酸是一种片层状结构的白色晶体,层内结构如下图所示:

(3)加热时,硼酸在水中的溶解度增大,主要原因是________。
(4)硼酸在水中电离产生过程为: , 是___________酸。
A. 一元强酸 B. 一元弱酸 C. 三元强酸 D. 三元弱酸 Ⅳ.硼砂是含结晶水的四硼酸钠,请根据模型回答有关问题。
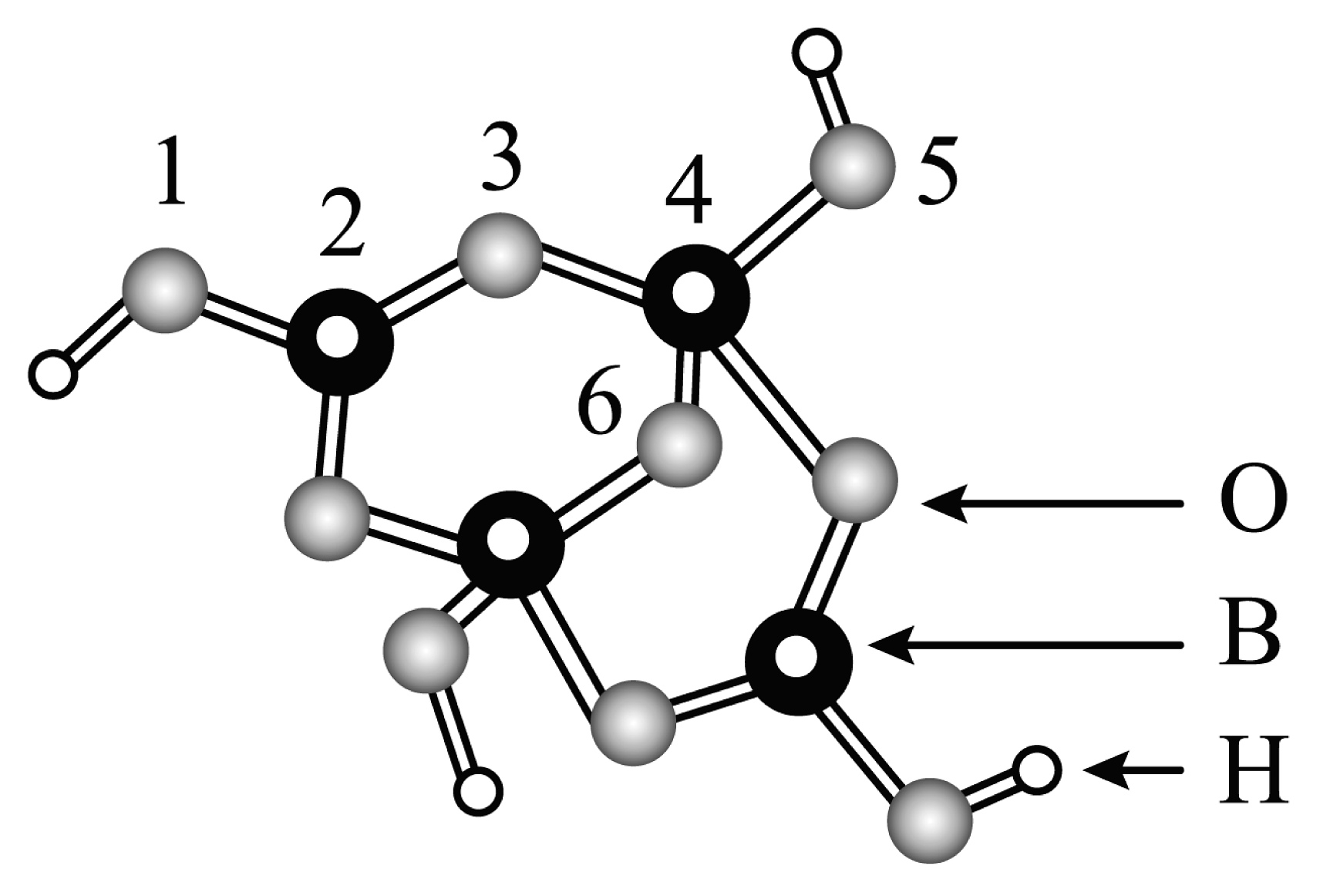
(5)硼砂中阴离子(含B、O,H三种元素)的球棍模型如图所示,则在中,2号硼原子的价层电子对数为________,m=________(填数字)。
(6)和过量NaF作用可生成 , 的空间构型为________,的电子式为________。
-
14、
1,2-二溴乙烷可作汽油抗爆剂的添加剂。某小组同学设想通过乙烯与溴水反应进行制备。已知部分有机化合物的数据如下:
物质
乙醇
1,2-二溴乙烷
2-溴乙醇
溶解性
与水任意比互溶
难溶于水
与水互溶
沸点/℃
78.5
132
149
熔点/℃
-117.3
9
-80
I.乙烯的制备
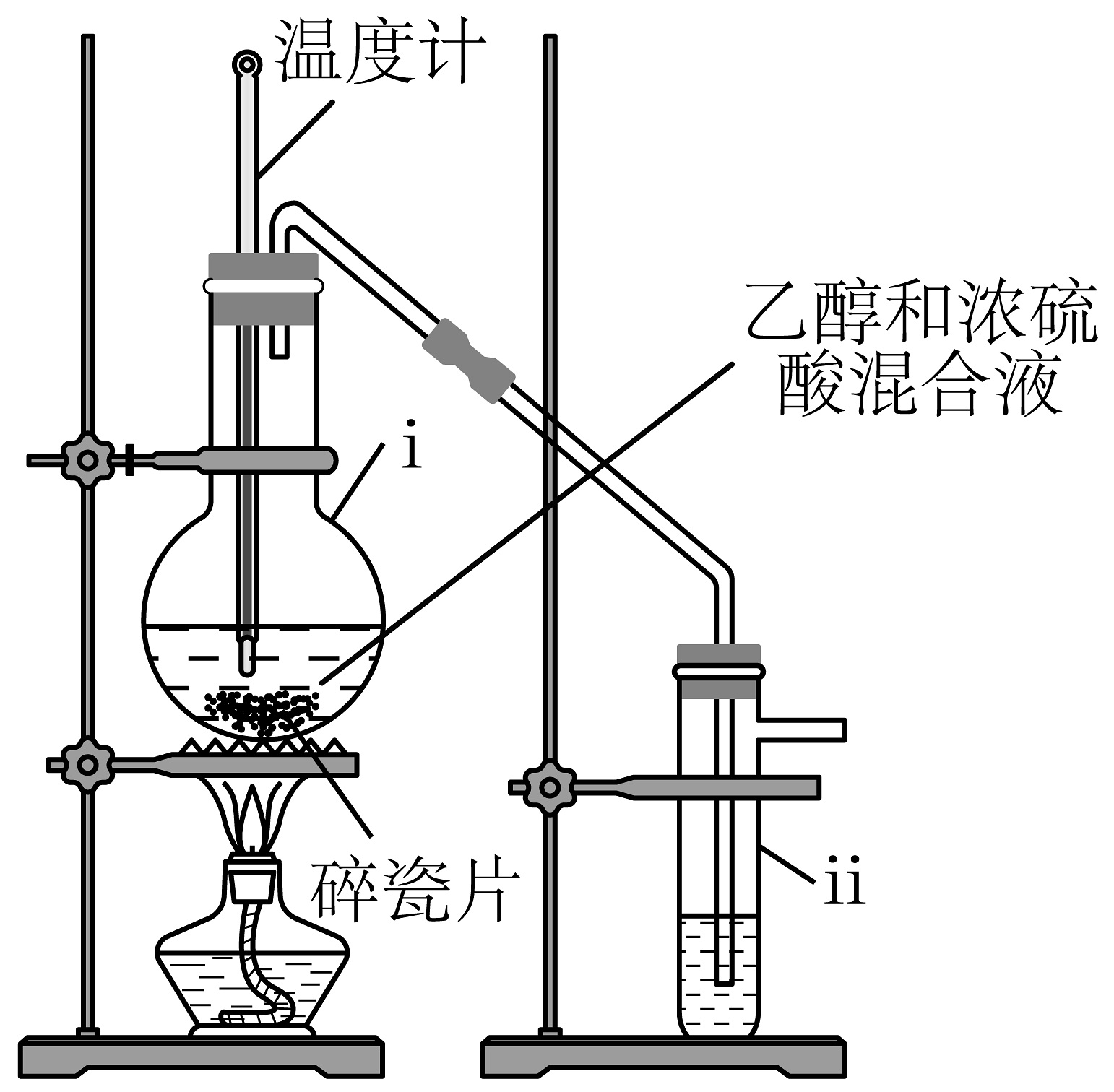
(1)仪器i的名称为;制备乙烯的化学方程式为。
(2)仪器ii的作用是除去乙烯中的和等杂质,应盛放的试剂为。
Ⅱ.1,2-二溴乙烷的制备
(3)仪器iii中是已知浓度与pH的溴水,向其中通入足量已除杂的乙烯气体,充分反应后再测定iii中溶液的pH。

预期实验现象:溴水褪色,溶液的pH变大,溶液分层。
预期产品分离方法:将仪器得到的混合物进行(填分离操作)。
(4)仪器iv中NaOH溶液的作用:。
Ⅲ.探究乙烯与溴水的反应原理
(5)如步骤Ⅱ进行实验,反应后实际观察的现象:澳水褪色,溶液的pH变小,溶液没有明显的分层现象。
查阅资料乙烯与反应生成1,2-二溴乙烷的机理如下图所示:

根据实际观察的现象,结合反应机理,写出乙烯与溴水反应的化学方程式:。
(6)实验结论
结合(5)中现象和机理,实验室制备1,2-二溴乙烷时应在无水环境中进行,可将乙烯气体通入。
(7)写出乙烯在生产生活中的一种应用。
-
15、实验室用乙酸、异戊醇、浓硫酸制备乙酸异戊酯(沸点142℃),并利用环己烷-水的共佛体系(沸点69℃)带出水分。已知体系中沸点最低的有机物是环己烷(沸点81℃),实验装置如图(夹持和水浴加热装置略去)。下列说法不正确的是
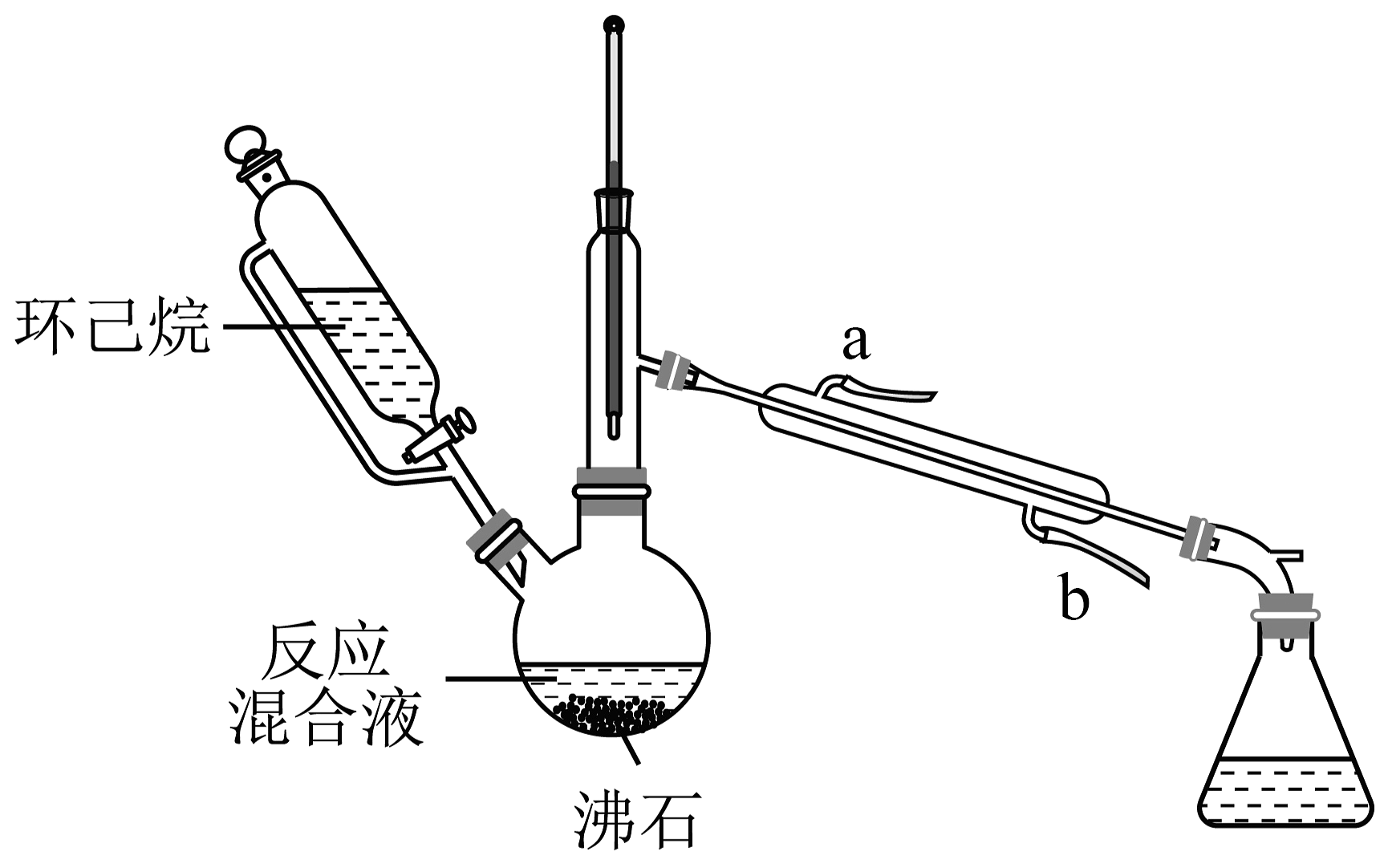 A、以共沸体系带水促使反应正向进行 B、冷凝水从b口进a口出 C、接收瓶中会出现分层现象 D、反应时水浴温度必须控制在69℃
A、以共沸体系带水促使反应正向进行 B、冷凝水从b口进a口出 C、接收瓶中会出现分层现象 D、反应时水浴温度必须控制在69℃ -
16、已知的熔点是890℃,的熔点是190℃,气态常以二聚体形式存在,其结构如下图所示。下列有关说法正确的是
 A、溶于水能导电,故为离子晶体 B、二聚体分子结构中存在配位键 C、二聚体中所有原子均在同一平面 D、和的二者熔点差异大是因为可形成分子间氢键
A、溶于水能导电,故为离子晶体 B、二聚体分子结构中存在配位键 C、二聚体中所有原子均在同一平面 D、和的二者熔点差异大是因为可形成分子间氢键 -
17、如图为甲烷晶体的晶胞结构,下列有关说法不正确的是
 A、晶体熔化时破坏了共价键 B、一个甲烷晶胞中含有4个甲烷分子 C、甲烷晶胞中的每个球体代表一个甲烷分子 D、晶体中1个甲烷分子周围有12个紧邻的甲烷分子
A、晶体熔化时破坏了共价键 B、一个甲烷晶胞中含有4个甲烷分子 C、甲烷晶胞中的每个球体代表一个甲烷分子 D、晶体中1个甲烷分子周围有12个紧邻的甲烷分子 -
18、利用有机分子模拟生物体内“醛缩酶”催化Diels-Alder反应取得重要进展,荣获2021年诺贝尔化学奖。某Diels-Alder反应以1为原料合成V,催化机理如下。下列说法错误的是
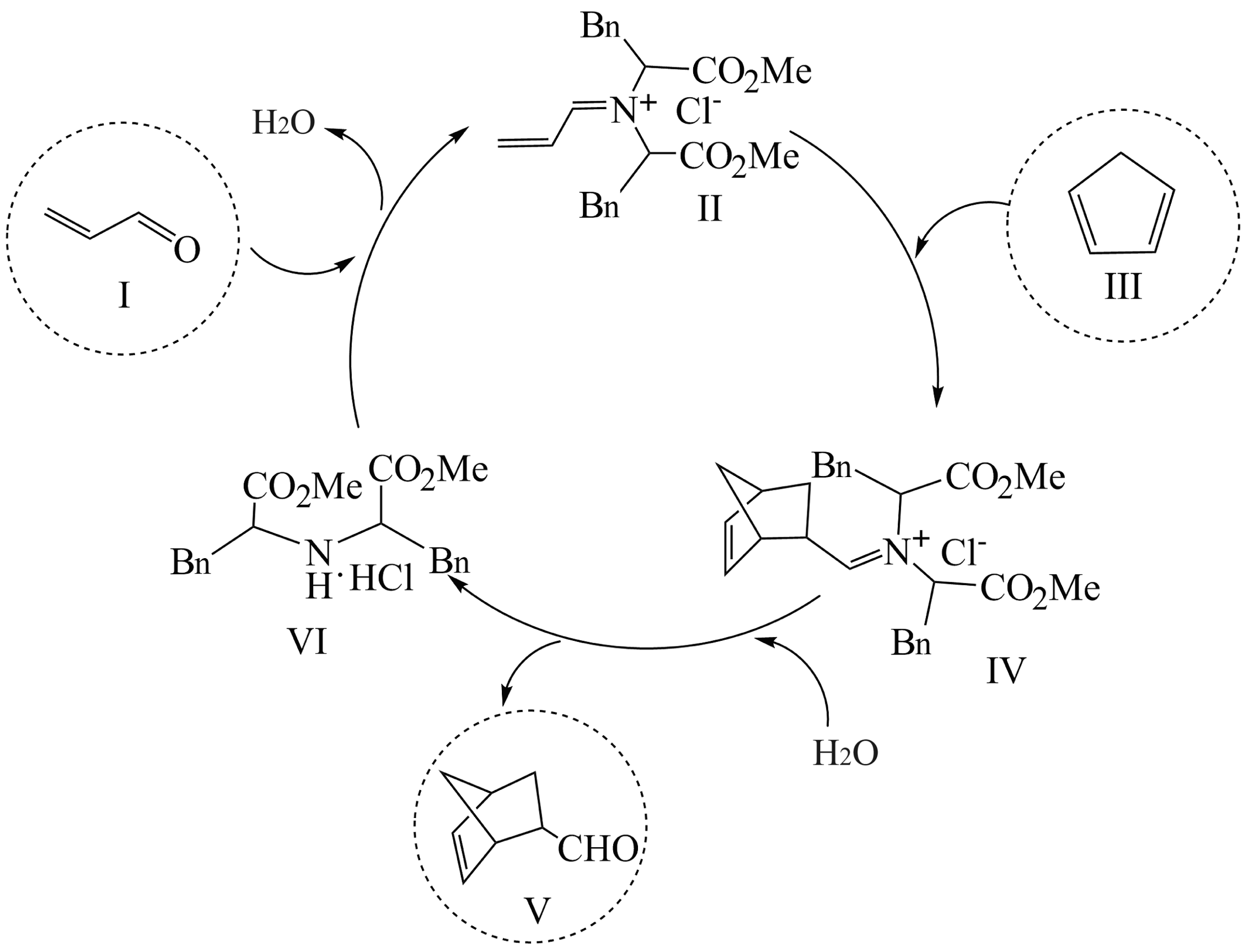 A、V的分子式为 B、总反应是:I+Ⅲ→V C、I和V互为同系物 D、Ⅵ是反应的催化剂
A、V的分子式为 B、总反应是:I+Ⅲ→V C、I和V互为同系物 D、Ⅵ是反应的催化剂 -
19、一种在航空航天、国防军工等领域具有应用前景的液晶聚芳酯G可由如下反应制备,下列说法错误的是
 A、 , 化合物X为乙酸 B、化合物E的核磁共振氢谱上共有4种H C、反应说明化合物F可发生缩聚反应 D、聚芳酯G可与NaOH溶液反应
A、 , 化合物X为乙酸 B、化合物E的核磁共振氢谱上共有4种H C、反应说明化合物F可发生缩聚反应 D、聚芳酯G可与NaOH溶液反应 -
20、下列关于实验操作与预期的现象及结论描述不合理的是
选项
实验操作
预期现象及结论
A
往盛有1mL溴乙烷的试管中滴入2滴溶液
产生浅黄色沉淀,说明溴乙烷在水中能电离出
B
向新制的中滴入少量葡萄糖溶液并加热
产生砖红色沉淀,说明葡萄糖含醛基
C
将少量乙酸乙酯加入NaOH溶液中,加热
出现分层,加热一段时间后酯层消失,说明乙酸乙酯可在碱性条件下水解
D
向盛有2mL鸡蛋清溶液的试管中加入5滴浓硝酸,加热
产生白色沉淀,加热后沉淀变黄色,说明鸡蛋清的蛋白质含有苯环
A、A B、B C、C D、D