-
1、在催化剂作用下,某可逆反应的反应历程如图所示。下列说法正确的是
 A、反应物的总能量小于生成物的总能量 B、活化能:反应ii→iii>反应i→ii C、升高温度可提高反应物的平衡转化率 D、使用催化剂可提高活化分子百分数
A、反应物的总能量小于生成物的总能量 B、活化能:反应ii→iii>反应i→ii C、升高温度可提高反应物的平衡转化率 D、使用催化剂可提高活化分子百分数 -
2、在实验室进行乙炔的制备、净化、收集及检验实验(“→”表示气流方向)。下列装置难以达到实验目的的是




A.制备乙炔
B.除去乙炔中混有的H2S
C.收集乙炔
D.验证乙炔分子中存在不饱和键
A、A B、B C、C D、D -
3、在天然氯化物参与下,化合物I可转化为化合物Ⅱ。下列说法不正确的是
 A、化合物I可发生加聚反应 B、化合物I中所有碳原子共平面 C、化合物Ⅱ中有3种官能团 D、化合物Ⅱ可与NaOH水溶液反应
A、化合物I可发生加聚反应 B、化合物I中所有碳原子共平面 C、化合物Ⅱ中有3种官能团 D、化合物Ⅱ可与NaOH水溶液反应 -
4、劳动创造幸福。下列劳动项目与所述化学知识没有关联的是
选项
劳动项目
化学知识
A
用活性炭去除室内甲醛
活性炭具有还原性
B
用柠檬酸解决花盆中土壤碱化问题
柠檬酸具有酸性
C
用84消毒液对洗手池消毒
NaClO可使蛋白质变性
D
用植物油作原料制肥皂
油脂可发生皂化反应
A、A B、B C、C D、D -
5、“西气东输”力保天然气安全稳定供应。下列对天然气燃烧过程中相关物质的说法正确的是A、CH4分子为含有极性键的非极性分子 B、O2分子中存在由p轨道“头碰头”形成的π键 C、H2O分子的VSEPR模型为V形 D、CO2分子的电子式为

-
6、科学技术是第一生产力。下列说法正确的是A、福建舰甲板复合材料中的碳化硅属于分子晶体 B、嫦娥六号月球车核动力电池中的与互为同位素 C、电动汽车中的锂离子电池工作时将化学能转化为电能 D、深中通道海底沉管混凝土中的Si元素位于元素周期表的d区
-
7、中国古代灯具是艺术和科技融合的结晶。下列灯具的主要材料属于有机高分子的是




A.红木雕刻灯
B.珐琅玻璃灯
C.翡翠龙纹灯
D.青铜长信宫灯
A、A B、B C、C D、D -
8、氯碱工业涉及Cl2、H2、NaOH、NaClO等物质。设NA为阿伏加德罗常数的值,下列说法错误的是A、1 mol NaOH固体中的离子数目为2NA B、1 L1mol/L的NaClO溶液中,ClO-的数目小于NA C、标况下,22.4L的H2和Cl2混合气体,共价键数目为NA D、1 mol Cl2与足量NaOH溶液反应生成NaClO转移电子数为2NA
-
9、部分含Fe或含Cu物质的分类与相应化合价关系如下图所示,下列推断不合理的是
 A、c为黑色固体 B、a与反应只生成d C、g与h均含有σ键 D、可存在a→c→d→h的转化
A、c为黑色固体 B、a与反应只生成d C、g与h均含有σ键 D、可存在a→c→d→h的转化 -
10、骑楼极具岭南特色,其建筑材料主要成分为硅酸盐的是
A
B
C
D




金漆
木雕
陶塑
蚝壳窗
A、A B、B C、C D、D -
11、以甲基丙烯酸苄基酯为单体的聚合产品具有良好的性能,一种合成化合物甲基丙烯酸苄基酯的路线如下(加料顺序、反应条件略):
 (1)、化合物v含有的官能团名称为、。(2)、反应①的条件为和光照,则化合物i的结构简式为。(3)、下列有关说法中,正确的有___________(填标号)。A、反应②中,有键的断裂和键的形成 B、化合物ⅱ中所有原子共平面 C、化合物iii与互为同系物 D、化合物ⅱi能发生氧化反应(4)、根据化合物ⅳ的结构特征,分析预测其可能的化学性质,完成下表。
(1)、化合物v含有的官能团名称为、。(2)、反应①的条件为和光照,则化合物i的结构简式为。(3)、下列有关说法中,正确的有___________(填标号)。A、反应②中,有键的断裂和键的形成 B、化合物ⅱ中所有原子共平面 C、化合物iii与互为同系物 D、化合物ⅱi能发生氧化反应(4)、根据化合物ⅳ的结构特征,分析预测其可能的化学性质,完成下表。序号
反应试剂、条件
反应形成的新结构(有机产物)
反应类型
a

b
置换反应
(5)、化合物X的分子组成比化合物vi的多2个氢原子,且能与溶液反应。则化合物X的结构有种,其结构简式为(任写一种)。(6)、写出化合物vi与发生酯化反应的化学方程式:。 -
12、
汽车尾气系统中均安装了催化转化器以减少尾气污染。
Ⅰ.汽车尾气中含有大量和等有害物质,会对人体健康和环境产生危害。
(1)汽车尾气中产生的原因为________(用化学方程式表示)。Ⅱ.在催化剂作用下,汽车尾气中的和可转化成和 , 其反应为:。
(2)反应过程中的能量变化如图所示,该反应为________(填“吸热”或“放热”)反应。 (3)在恒温恒容密闭容器中发生上述反应,下列情况能说明该反应达到化学平衡的有______(填标号)。
(3)在恒温恒容密闭容器中发生上述反应,下列情况能说明该反应达到化学平衡的有______(填标号)。A. 和的物质的量之比为 B. 单位时间内生成的同时消耗 C. 容器内的压强不再变化 D. 的含量保持不变 (4)在体积相同的三个恒容密闭容器中按下表进行实验,三组实验中随时间t变化的曲线如图所示(已知:其他条件不变时,催化剂的比表面积越大,催化效率越高)。编号
催化剂的比表面积
i
280
80
ii
280
x
iii
360
80

①结合图、表信息,表中x________80(填“>”“<”或“=”)。
②由实验________(填编号,下同)和实验________可得出结论:温度越高,的转化速率越大。
③实验i开始至的平均反应速率为________(用含的代数式表示);
实验iⅱ达到平衡时的转化率为________(已知:转化率是指已被转化的反应物的物质的量与其初始的物质的量之比)。
(5)在催化剂作用下,利用还原也可实现氮氧化物污染的治理,其反应为。在的催化作用下,该反应历程可分两步进行:i);
ii)________(写出该步反应的离子方程式)。
-
13、硼及其化合物在工业上用途广泛。以硼镁矿(主要成分为 , 还含有少量的及等)为原料制备硼酸并得到的工艺流程如下:
 (1)、硼镁矿中硼元素的化合价为。(2)、①为提高“酸浸”速率,可采取的措施有(任写一条)。
(1)、硼镁矿中硼元素的化合价为。(2)、①为提高“酸浸”速率,可采取的措施有(任写一条)。②补充“酸浸”时发生反应的化学方程式:。
(3)、在“氧化”步骤中,化合价发生变化的金属离子是(填离子符号)。(4)、“滤渣3”的主要成分为(填化学式)。(5)、“沉钙”后的滤液,可在该工艺的步骤中循环使用。(6)、具有超导电性。利用受热脱水得到 , 再利用高温下和(物质的量之比为)的反应制得。①分三步脱水,过程如下:
则第ⅱ步的失重率为(已知:失重率为失重前质量,为失重后质量;结果保留两位有效数字)。
②写出利用制备的化学方程式。
-
14、某学习小组探究在不同条件下的氧化性。(1)、基于与稀硝酸的反应(用离子方程式表示),初步得出结论:在酸性条件下体现强氧化性。(2)、为验证(1)中结论,小组同学设计如下实验:
①配制溶液,所需固体的质量为g;配制过程中需要用到的玻璃仪器除量筒、玻璃棒、胶头滴管及烧杯外,还有(填仪器名称)。
②利用如图所示装置进行实验。

实验过程:关闭 , 向装有片的三颈烧瓶内加入溶液,未观察到明显现象。打开 , 通入一段时间后,关闭。再向三颈烧瓶内滴加稀硫酸,观察到铜片溶解,溶液变蓝,并有气泡产生。打开 , 向B中通入(填名称),观察到 , 说明A中反应产生的气体为。
(3)、该小组同学认为的还原性较弱,若用还原性更强的金属,则可以在非酸性条件下体现氧化性。于是,分别取溶液、水于烧杯中,各加入绿豆大小的钠块,观察到两烧杯中实验现象几乎无差别。【提出猜想】小组同学认为可能是浓度较低引起的。
【优化实验】调节溶液中的浓度,探究在非酸性条件下的氧化性。
实验
实验操作
实验现象
i
取溶液于烧杯中,向其中加入① , 再向该溶液中加入绿豆大小的钠块
随即有黄色火花出现,之后燃烧
ii
取溶液于烧杯中,向其中加入固体,再向该溶液中加入绿豆大小的钠块
瞬间即有黄色火花出现,立即剧烈燃烧
【实验分析】小组同学认为实验不足以说明在非酸性条件下体现氧化性。
【查阅资料】在碱性介质中,活泼金属可将还原为在碱性溶液中以还原性为主;在碱性条件下的还原产物通常为(绿色)。
【补充实验】该小组同学通过实验验证还原产物的存在。
②该方案为;可观察到的现象为。由此可得在非酸性条件下可以体现氧化性。
③在非酸性条件下,将氧化的离子方程式为。
-
15、向一个绝热恒容密闭容器中充入和 , 发生反应: , 测得该可逆反应的正反应速率和逆反应速率随时间变化的曲线如图所示(已知:绝热密闭容器的反应体系和外界环境无热交换)。下列说法不正确的是
 A、曲线M代表正反应速率随时间变化的曲线 B、反应在时刻达到化学平衡状态 C、该反应为放热反应 D、时Z的浓度大于时Z的浓度
A、曲线M代表正反应速率随时间变化的曲线 B、反应在时刻达到化学平衡状态 C、该反应为放热反应 D、时Z的浓度大于时Z的浓度 -
16、一种以溶液为电解质溶液的锌镍单液流电池的工作原理如图所示(图中“”表示液体流向),电极上的反应为电极发生反应生成。下列说法正确的是
 A、电极为该电池的负极 B、表面发生的电极反应为 C、电极的质量逐渐减小 D、电池工作一段时间后,溶液中浓度保持不变
A、电极为该电池的负极 B、表面发生的电极反应为 C、电极的质量逐渐减小 D、电池工作一段时间后,溶液中浓度保持不变 -
17、除去粗盐中的杂质离子(及等)的实验流程如下:
下列说法不正确的是
A、“除杂”时,可利用反应除去 B、“除杂”时,应先加溶液再加溶液 C、“调”时,应加入稀硫酸调节溶液至中性 D、“蒸发结晶”时,当蒸发皿中出现较多固体时停止加热,利用余热蒸干 -
18、为原子序数依次增大的短周期元素,X原子L层有5个电子,Y与Z形成的淡黄色化合物甲可用作呼吸面具的供氧剂,R的周期序数与主族序数相等,Q的最高正价与最低负价的代数和为4.下列说法正确的是A、简单离子半径: B、简单氢化物的稳定性: C、的最高价氧化物对应的水化物可两两反应 D、化合物甲中阴、阳离子的个数比为
-
19、氮及其化合物在工业、农业和环境科学中发挥重要作用。设为阿伏加德罗常数的值,下列说法正确的是A、的体积为 B、溶液中的数目为 C、和充分反应转移的电子数目为 D、和的混合物中所含氮原子数目为
-
20、某实验小组利用如图所示装置制备并探究其性质(处均为浸有相应试液的棉花,夹持装置省略)。下列说法不正确的是
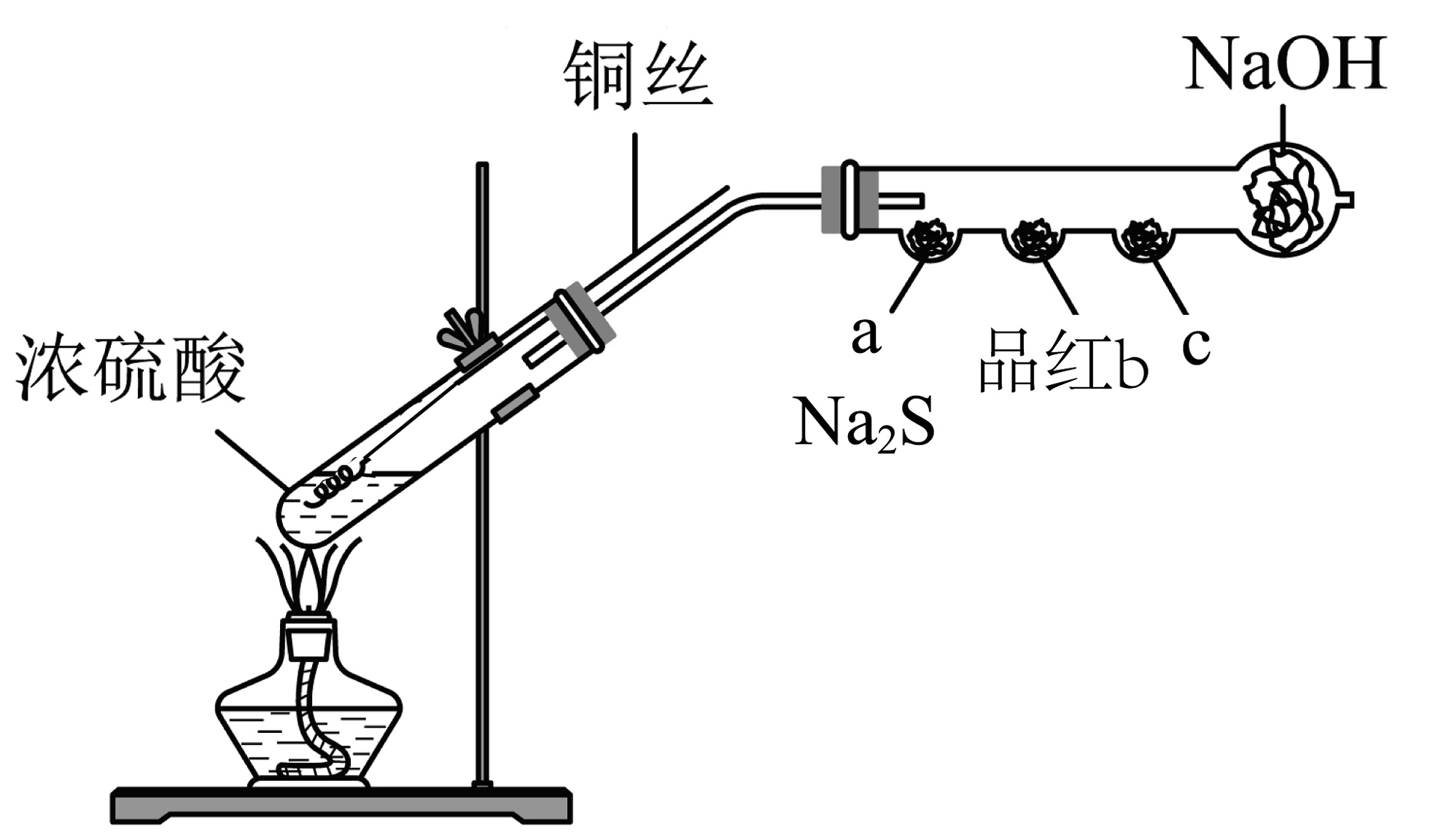 A、制备的反应体现了浓硫酸的强氧化性和酸性 B、a处参与反应的氧化剂与还原剂的物质的量之比为 C、b处褪色,说明具有漂白性 D、为验证的还原性,c处棉花可浸有酸性高锰酸钾溶液
A、制备的反应体现了浓硫酸的强氧化性和酸性 B、a处参与反应的氧化剂与还原剂的物质的量之比为 C、b处褪色,说明具有漂白性 D、为验证的还原性,c处棉花可浸有酸性高锰酸钾溶液