-
1、Ni(CO)4(四羰合镍,沸点43℃,其结构如图所示)是有机化合物羰基化反应的催化剂,也可用于制备高纯镍(镍的晶胞结构类型与铜的相同,为面心立方晶胞,其体积为a3)。下列说法错误的是
 A、图中Ni(CO)4中含有σ键的数目为8 B、Ni(CO)4晶体的类型为分子晶体 C、镍的晶胞中镍原子配位数为8 D、镍的晶胞中镍原子半径为
A、图中Ni(CO)4中含有σ键的数目为8 B、Ni(CO)4晶体的类型为分子晶体 C、镍的晶胞中镍原子配位数为8 D、镍的晶胞中镍原子半径为 -
2、草酸亚铁晶体()呈黄色,难溶于水,具有强还原性。用下列装置制备草酸亚铁晶体。
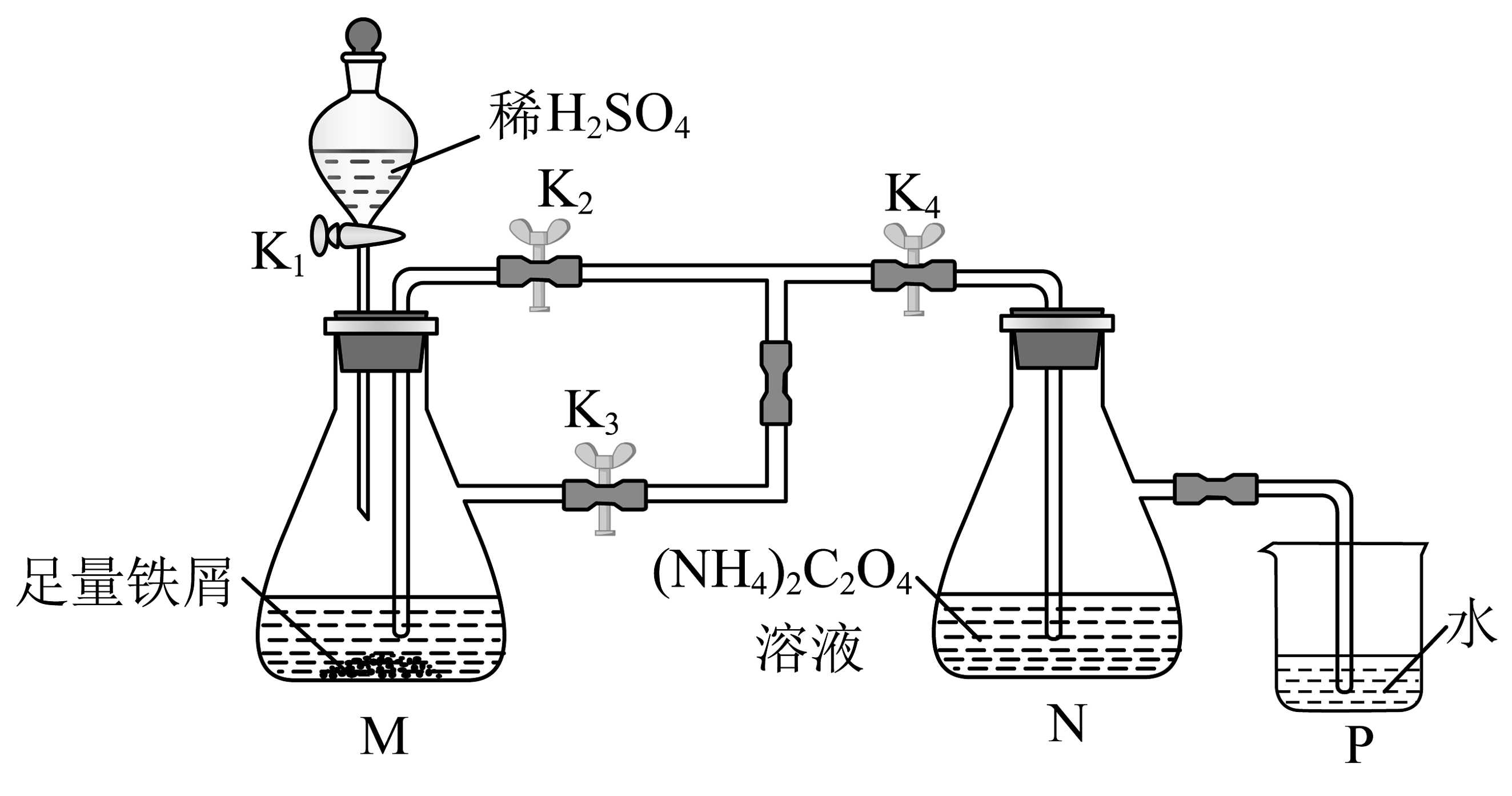
下列操作错误的是
A、配制溶液的蒸馏水需经煮沸后迅速冷却 B、检查气密性后,打开、、 , 关闭 C、P中不再冒出气泡时,打开 , 关闭、 D、反应结束将N中混合物过滤、洗涤、干燥得草酸亚铁晶体 -
3、某离子结构如图所示,W、X、Y、Z是原子半径依次减小的同一短周期主族元素,其中Y在地壳中含量最高。下列说法错误的是
 A、所有原子均满足稳定结构 B、第一电离能:X>W C、键角: D、分子极性:
A、所有原子均满足稳定结构 B、第一电离能:X>W C、键角: D、分子极性: -
4、向溶液中加入以下试剂,反应离子方程式正确的是
试剂
离子方程式
A
通入气体
B
滴加少量的溶液
C
滴加硫酸酸化的KI溶液
D
滴加酸性溶液
A、A B、B C、C D、D -
5、微格列汀是一种抗糖尿病药物,其结构简式如图所示。下列说法正确的是
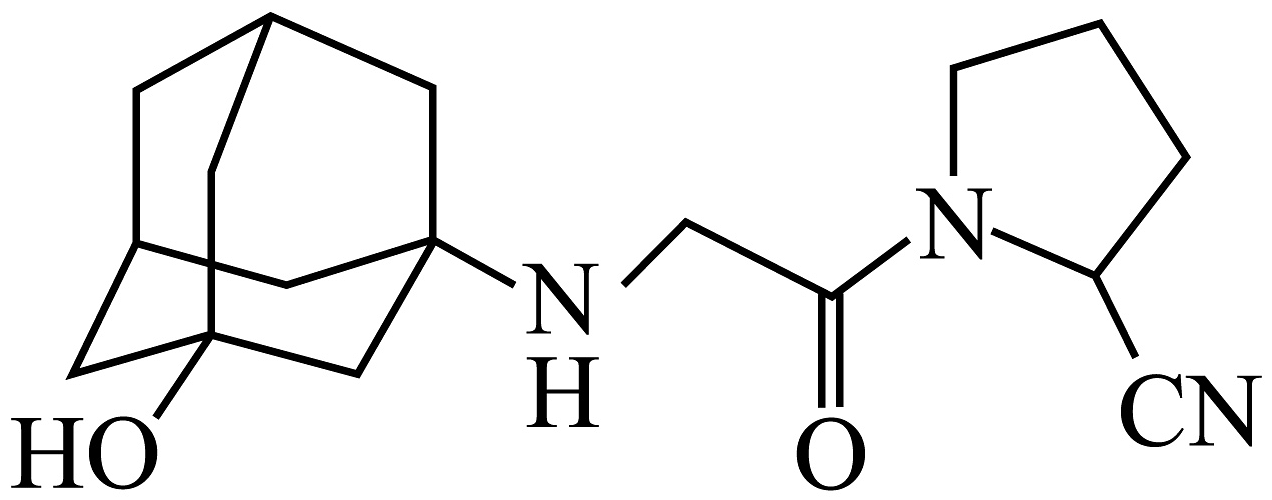 A、有3种官能团 B、有5个手性碳原子 C、碳原子有2种杂化方式 D、在碱性溶液中加热能稳定存在
A、有3种官能团 B、有5个手性碳原子 C、碳原子有2种杂化方式 D、在碱性溶液中加热能稳定存在 -
6、根据实验目的,下列实验方案设计正确的是
实验目的
实验方案
A
检验丙烯醛中的醛基
加入溴水,若溴水褪色,则证明含有醛基
B
实验室制取乙烯
将体积比为1∶3的乙醇和浓硫酸混合液加热到140℃
C
除去中的NO
将混合气体通入NaOH溶液
D
比较HClO、酸性强弱
用pH计测量同浓度NaClO、溶液的pH
A、A B、B C、C D、D -
7、在现代食品工业中,食品添加剂的使用满足人们对食品多样化的需求,保证了市场供应。下列食品添加剂与其功能不对应的是A、柠檬黄—着色剂 B、苯甲酸钠—防腐剂 C、谷氨酸钠—增味剂 D、碳酸氢钠—凝固剂
-
8、下列化学用语或图示正确的是A、
 的系统命名:2-甲基苯酚
B、分子的球棍模型:
的系统命名:2-甲基苯酚
B、分子的球棍模型: C、激发态H原子的轨道表示式:
C、激发态H原子的轨道表示式: D、键形成的轨道重叠示意图:
D、键形成的轨道重叠示意图:
-
9、植物提取物阿魏萜宁具有抗菌活性,其结构简式如图所示。下列关于阿魏萜宁的说法错误的是
 A、可与溶液反应 B、消去反应产物最多有2种 C、酸性条件下的水解产物均可生成高聚物 D、与反应时可发生取代和加成两种反应
A、可与溶液反应 B、消去反应产物最多有2种 C、酸性条件下的水解产物均可生成高聚物 D、与反应时可发生取代和加成两种反应 -
10、下列图示实验中,操作规范的是




A.调控滴定速度
B.用试纸测定溶液
C.加热试管中的液体
D.向试管中滴加溶液
A、A B、B C、C D、D -
11、以丙烯为原料合成某药物中间体ⅶ的合成路线如下:
 (1)、化合物ⅰ、ⅳ中所含的官能团分别为 , (写名称)。(2)、反应①的反应类型为 , 化合物ⅱ的结构简式为。(3)、化合物ⅲ与无色无味气体y反应,生成化合物ⅱ,原子利用率为100%,y为。(4)、下列说法正确的是_______。A、化合物ⅰ可使溴的四氯化碳溶液褪色 B、化合物ⅲ属于烃 C、化合物ⅳ与足量Na反应可得到氢气(标准状况) D、化合物ⅶ可发生聚合反应(5)、反应④的化学方程式为。(6)、已知
(1)、化合物ⅰ、ⅳ中所含的官能团分别为 , (写名称)。(2)、反应①的反应类型为 , 化合物ⅱ的结构简式为。(3)、化合物ⅲ与无色无味气体y反应,生成化合物ⅱ,原子利用率为100%,y为。(4)、下列说法正确的是_______。A、化合物ⅰ可使溴的四氯化碳溶液褪色 B、化合物ⅲ属于烃 C、化合物ⅳ与足量Na反应可得到氢气(标准状况) D、化合物ⅶ可发生聚合反应(5)、反应④的化学方程式为。(6)、已知 和
和 也可以发生类似⑤的反应,生成的有机化合物的结构简式为。
也可以发生类似⑤的反应,生成的有机化合物的结构简式为。 -
12、海水是巨大的资源宝库,实验室模拟工业上从海水中获取某些重要化工原料的流程如下图所示。
 (1)、“操作I”是(填写实验操作名称)和过滤。(2)、粗盐中常含有少量泥沙和、、等杂质离子,精制时,加入的试剂①、②、③分别为 , , (写化学式),加入盐酸的目的是。(3)、“操作Ⅱ”中可以用热空气将吹出的原因是。(4)、“、吸收”时发生反应的离子方程式为。(5)、“操作Ⅲ”选用的装置是(填标号)。
(1)、“操作I”是(填写实验操作名称)和过滤。(2)、粗盐中常含有少量泥沙和、、等杂质离子,精制时,加入的试剂①、②、③分别为 , , (写化学式),加入盐酸的目的是。(3)、“操作Ⅱ”中可以用热空气将吹出的原因是。(4)、“、吸收”时发生反应的离子方程式为。(5)、“操作Ⅲ”选用的装置是(填标号)。A.
 B.
B.  C.
C. (6)、从海水中制得的氯化钠除了供食用,还用作化工原料。电解饱和食盐水制得的氢气可用来设计环保、高效的氢氧燃料电池,某种氢氧燃料电池的结构示意图如下:
(6)、从海水中制得的氯化钠除了供食用,还用作化工原料。电解饱和食盐水制得的氢气可用来设计环保、高效的氢氧燃料电池,某种氢氧燃料电池的结构示意图如下:
该电池工作时,b处通入(填“”或“”),负极的电极反应式为。
-
13、
运用Fenton化学氧化法降解工业废水的有机污染物p-CP,其做法是在调节好pH和浓度的废水中加入。现探究有关因素对该降解反应速率的影响。
【实验设计】控制p-CP和的初始浓度相同,加入的浓度为或 , 恒定实验温度在或 , 控制pH在3或10。设计如下对比实验:
(1)请完成以下实验设计表(表中不要留空格):
实验编号
pH
实验目的
①
298
3
6.0
0.30
(Ⅰ)实验①和②探究温度对该降解反应速率的影响;
(Ⅱ)实验①和③探究pH对该降解反应速率的影响;
(Ⅲ)实验①和④探究浓度对该降解反应速率的影响。
②
③
④
【数据处理】
(2)测得实验①~③p-CP的浓度随时间变化的关系如下图,请计算实验①降解反应在50~150s内的反应速率:v(p-CP)=。

(3)请在坐标图中,画出实验④曲线(进行相应的标注)。
【解释与结论】
(4)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,可能的原因是。
(5)实验③得出的结论是:pH等于10时,。
【思考与交流】
(6)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:。
-
14、
合成氨是人类科学技术发展史上的一项重大成就。
I.实验室可用以下装置制取氨气。

(1)A中制取氨气的化学方程式为________。
(2)欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:a→________(按气流方向,用小写字母表示)。
Ⅱ.工业合成氨对国民经济和社会发展具有重要的意义。在恒容密闭容器中通入一定量的和 , 在一定条件下进行反应: , 测得部分气体的物质的量随时间变化关系如下图所示:

(3)图中X表示的反应物为________(填“”或“”),该条件下,X的最大转化率为________。
(4)M点时,X的消耗速率________X的生成速率(填“<”“>”或“=”)。
(5)下列情况能说明该反应一定达到化学平衡的是_______。
A. B. C. 的含量保持不变 D. 容器内混合气体的密度保持不变 (6)已知合成氨为放热反应,请从化学键角度解释反应过程中能量变化的本质________。
-
15、按下图(a~c均为浸有相应试液的棉花)装置进行实验。将稀硫酸全部加入Ⅰ中的试管,关闭活塞。下列说法不正确的是
 A、I中试管内反应的离子方程式为 B、Ⅱ中a处变红,说明是酸性氧化物 C、Ⅱ中b或c处褪色,均体现的漂白性 D、Ⅲ中试管出现了浑浊现象,体现的氧化性
A、I中试管内反应的离子方程式为 B、Ⅱ中a处变红,说明是酸性氧化物 C、Ⅱ中b或c处褪色,均体现的漂白性 D、Ⅲ中试管出现了浑浊现象,体现的氧化性 -
16、部分含氮物质的分类与相应化合价关系如图所示。下列说法正确的是
 A、a遇到氯化氢时,可观察到白雾产生 B、b为红棕色的有毒气体 C、d只具有酸性和氧化性 D、可存在a→b→c→e的转化关系
A、a遇到氯化氢时,可观察到白雾产生 B、b为红棕色的有毒气体 C、d只具有酸性和氧化性 D、可存在a→b→c→e的转化关系 -
17、火星大气中含有大量 , 一种有参加反应的新型全固态电池有望为火星探测器供电。该电池的总反应为。放电时A、负极上发生还原反应 B、正极反应式为: C、阴离子由负极移向正极 D、当电路中转移电子时,正极上消耗
-
18、工业制硫酸中的一步重要反应是在400~500℃下的催化氧化:。这是一个正反应放热的可逆反应。若反应在恒容密闭容器中进行,下列有关说法正确的是A、达到平衡时,正、逆反应速率均为零 B、其他条件不变时,向容器内充入Ne,的生成速率会增大 C、使用合适的高效催化剂,可以实现的完全转化 D、通过调控反应条件,可以提高该反应进行的程度
-
19、下列陈述I与陈述Ⅱ均正确,且具有因果关系的是
选项
陈述I
陈述Ⅱ
A
液氨可用作制冷剂
液氨汽化时要吸收大量的热
B
可用来生产光导纤维
具有导电性
C
用聚乙烯塑料制作食品保鲜膜
聚乙烯燃烧生成和
D
用铝槽车运送浓硫酸
Al与浓硫酸常温下不反应
A、A B、B C、C D、D -
20、下列反应的化学方程式或离子方程式正确的是A、向溶液中通入过量: B、铜与稀硝酸反应: C、浓硝酸见光分解: D、灼热的炭与浓硫酸反应:(浓)