-
1、下列各实验装置、目的或结论全都正确的是
实验装置




甲
乙
丙
丁
A、甲可验证镁片与稀盐酸反应放热 B、乙可验证FeCl3对的分解反应有催化作用 C、将丙中的铝片更换为等质量的铝粉后释放出的热量变多 D、由丁可推断出:反应为吸热反应 -
2、相同温度和压强下,关于反应的△H,下列判断错误的是
①
②
③
④
⑤
A、 B、 C、 D、 -
3、下列事实可以用勒夏特列原理解释的是A、合成氨工业选择高温 B、反应达到平衡时,加大压强,颜色加深 C、用排饱和食盐水的方法收集氯气 D、用和制备 , 工业选择常压而非高压
-
4、反应经amin后的浓度变化情况如下图所示,在内表示的平均反应速率为 , 则a等于
 A、5 B、2.5 C、0.1 D、10
A、5 B、2.5 C、0.1 D、10 -
5、密闭恒容容器中的反应: , 达到化学平衡状态时,下列描述错误的是A、氮气浓度保持不变 B、 C、容器内压强不再变化 D、断开键,同时断开键
-
6、下列叙述正确的是A、在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 B、需要加热才能发生的反应不一定是吸热反应,但吸热反应只有加热才能发生 C、升温时吸热反应速率增大,放热反应速率减少 D、化学平衡常数发生变化,化学平衡一定发生移动
-
7、反应在四种不同情况下的反应速率如下,其中表示反应速率最快的是A、 B、 C、 D、
-
8、下列说法正确的是A、催化剂通过改变反应历程、增大反应活化能,加快反应速率 B、增大反应物浓度,可增大单位体积内活化分子百分数,从而增加有效碰撞的次数 C、体系压强增大,反应速率不一定增大 D、平衡常数K越大,表示反应进行的越快
-
9、用铝片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是A、用铝粉替换铝片 B、加热 C、用浓硫酸替换稀硫酸 D、滴加少量溶液
-
10、氨的液化过程中,其焓变和熵变正确的是A、 B、 C、 D、
-
11、生活处处都与化学有关,下列属于放热反应的是A、冰融化 B、生石灰溶于水 C、蒸馒头时小苏打受热分解 D、干冰作制冷剂
-
12、炼钢电炉内发生反应: , 实验测得平衡常数K与温度的关系如图所示。某温度下向刚性密闭容器中充入足量铁粉和CO气体,发生上述反应,达到平衡时测得CO压强 , 保持温度不变,再向容器中充入少量CO,达到新平衡时测得。下列叙述正确的是
 A、反应热 B、两个平衡中CO压强: C、Fe质量不变时反应达到平衡 D、平衡时增大质量,平衡一定右移
A、反应热 B、两个平衡中CO压强: C、Fe质量不变时反应达到平衡 D、平衡时增大质量,平衡一定右移 -
13、下列化学用语表示正确的是A、HF的电子式:
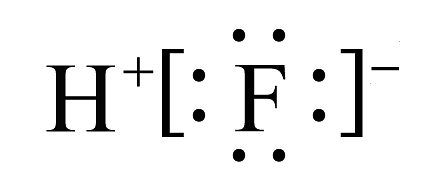 B、甲烷分子的球棍模型:
B、甲烷分子的球棍模型: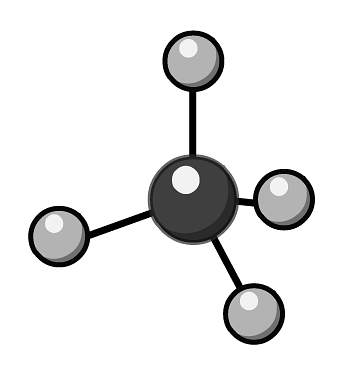 C、正丁烷的结构简式:
C、正丁烷的结构简式: D、S2-的结构示意图:
D、S2-的结构示意图: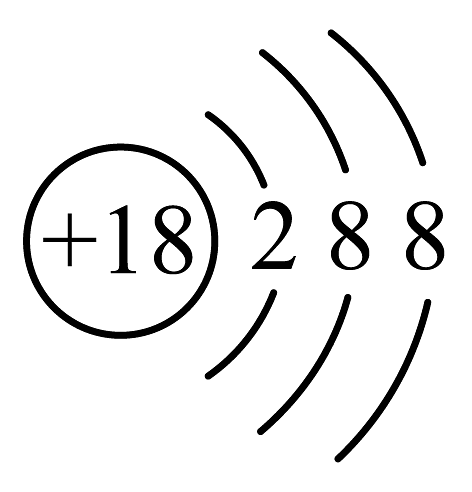
-
14、市售的溴(纯度)中含有少量的和 , 某化学兴趣小组利用氧化还原反应原理,设计实验制备高纯度的溴。回答下列问题:(1)、装置如图(夹持装置等略),将市售的溴滴入盛有浓溶液的B中,水浴加热至不再有红棕色液体馏出。仪器C的名称为;溶液的作用为;D中发生的主要反应的化学方程式为。
 (2)、将D中溶液转移至(填仪器名称)中,边加热边向其中滴加酸化的溶液至出现红棕色气体,继续加热将溶液蒸干得固体R。该过程中生成的离子方程式为。(3)、利用图示相同装置,将R和固体混合均匀放入B中,D中加入冷的蒸馏水。由A向B中滴加适量浓 , 水浴加热蒸馏。然后将D中的液体分液、干燥、蒸馏,得到高纯度的溴。D中蒸馏水的作用为和。(4)、为保证溴的纯度,步骤(3)中固体的用量按理论所需量的计算,若固体R质量为m克(以计),则需称取(用含m的代数式表示)。(5)、本实验所用钾盐试剂均经重结晶的方法纯化。其中趁热过滤的具体操作为漏斗下端管口紧靠烧杯内壁,转移溶液时用 , 滤液沿烧杯壁流下。
(2)、将D中溶液转移至(填仪器名称)中,边加热边向其中滴加酸化的溶液至出现红棕色气体,继续加热将溶液蒸干得固体R。该过程中生成的离子方程式为。(3)、利用图示相同装置,将R和固体混合均匀放入B中,D中加入冷的蒸馏水。由A向B中滴加适量浓 , 水浴加热蒸馏。然后将D中的液体分液、干燥、蒸馏,得到高纯度的溴。D中蒸馏水的作用为和。(4)、为保证溴的纯度,步骤(3)中固体的用量按理论所需量的计算,若固体R质量为m克(以计),则需称取(用含m的代数式表示)。(5)、本实验所用钾盐试剂均经重结晶的方法纯化。其中趁热过滤的具体操作为漏斗下端管口紧靠烧杯内壁,转移溶液时用 , 滤液沿烧杯壁流下。 -
15、将少量饱和FeCl3溶液分别滴加到下列物质中,得到三种分散系,回答下列问题:
甲:饱和FeCl3溶液滴加到NaOH溶液中;
乙:饱和FeCl3溶液滴加到冷水中;
丙:饱和FeCl3溶液逐滴滴加到沸水中。
(1)、将丙继续加热煮沸得到红褐色透明液体,反应的化学方程式为。(2)、用最简单的方法判断丙中是否成功制备胶体,请写出相关的操作、现象和结论。(3)、向经过检验后的丙中逐滴加入稀盐酸,会出现一系列变化,先出现和甲中相同的现象原因为。(4)、向丙中加入电极通电后,Fe(OH)3胶体粒子向电源极的方向移动(填“阴极”或“阳极”)。若要胶体发生聚沉,可以采取的措施是。(任写两条)(5)、可用如图所示的装置除去Fe(OH)3胶体中的杂质离子来提纯Fe(OH)3胶体,该提纯方法的名称是。实验过程中需不断更换烧杯中的蒸馏水。更换蒸馏水若干次后,取少量烧杯中的液体,向其中加入AgNO3溶液,若(填实验现象),则说明该Fe(OH)3胶体中的杂质离子已经完全除去。
-
16、有三种物质 A、B、C,其中一种是碱,其余两种是盐。它们均可溶于水,电离只产生下表中的离子:
阳离子
Na+、H+、Ba2+
阴离子
OH—、、
为鉴别它们,分别完成以下实验,其结果如下:
①A溶液与B溶液反应生成无色气体X,气体X可以与C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸。
请回答下列问题:
(1)、X的名称是 , X(填“是”或“不是”)电解质。(2)、C在水中的电离方程式为。鉴别C溶液中阴离子的实验操作方法。(3)、类别观和转化观是学习元素化合物的重要观念。写出以下水溶液中反应的离子方程式:①A溶液与B溶液反应生成无色气体X:。
②B溶液与C溶液反应至溶液呈中性的离子方程式为:。
③离子反应的本质就是溶液中的某些离子之间发生了类型的反应,使得反应的离子数目减少。
-
17、甘肃马家窖遗址出土的青铜刀,是我国最早冶炼的青铜器,由于时间久远,其表面有一层“绿锈”,“绿锈”俗称“铜绿”,是铜和空气中的水蒸气、CO2、O2作用产生的,其化学式为Cu2(OH)2CO3 , “铜绿”能跟酸反应生成铜盐、CO2和H2O。(1)、CO2属于(填“酸性”或“碱性”)氧化物。(2)、从物质分类标准看,“铜绿”属于哪类物质___________(填字母)。A、酸 B、碱 C、盐 D、氧化物(3)、铜器表面有时会生成“铜绿”,这层“铜绿”可用化学方法除去,写出盐酸去除“铜绿”的化学方程式:。(4)、古代人们高温灼烧孔雀石[Cu(OH)2·CuCO3]和木炭的混合物得到一种紫红色的金属铜,其化学方程式为2CuO+C2Cu+CO2↑,该反应属于___________(填字母)。A、置换反应 B、复分解反应 C、氧化还原反应 D、离子反应(5)、现代工业以黄铜矿为原料,在炼铜的过程中发生了多个反应,其中有如下两个反应:
反应Ⅰ:2Cu2S+3O22Cu2O+2SO2
反应Ⅱ:Cu2S+2Cu2O6Cu+2SO2
①对于反应Ⅰ,Cu2S中的S的化合价是 , 已知固态Cu2S不能导电,那么(填“是”或“否”)电解质。
②列举铜单质在生活中的一种应用。
-
18、铁黄(FeOOH)是一种颜料,以某硫铁矿废渣(主要成分Fe2O3 , 含有少量的SiO2 , 其余成分不考虑)为原料,制取铁黄,以下是制取工艺流程。
注:铁黄不与水反应,SiO2不与水和H2SO4反应
 (1)、过程Ⅰ的化学方程式为 , 滤渣Ⅰ中的物质有(填化学式);(2)、过程Ⅱ的操作名称为;(3)、过程Ⅲ中的化学方程式为FeSO4+2NaOH=Fe(OH)2+Na2SO4 , 该反应属于反应(填基本反应类型);(4)、①FeOOH随着温度的升高,可以加热分解成Fe2O3 , 写出其反应的化学方程式;
(1)、过程Ⅰ的化学方程式为 , 滤渣Ⅰ中的物质有(填化学式);(2)、过程Ⅱ的操作名称为;(3)、过程Ⅲ中的化学方程式为FeSO4+2NaOH=Fe(OH)2+Na2SO4 , 该反应属于反应(填基本反应类型);(4)、①FeOOH随着温度的升高,可以加热分解成Fe2O3 , 写出其反应的化学方程式;②温度不同时,生成的Fe2O3颜色如下表:
温度/℃
400
700
750
800
颜色
橘红
鲜红
鲜红
暗红
如果思考乐希希同学想获得鲜红色的Fe2O3 , 应把温度控制在。
(5)、FeS2中S的化合价是。 -
19、某班同学分组进行向一定体积的Ba(OH)2溶液中逐滴滴加稀硫酸的实验,并通过数字传感器测得混合溶液的导电能力随时间变化的曲线如图所示。下列有关说法正确的是
 A、实验时用NaOH代替Ba(OH)2也能得到该曲线 B、YZ段溶液的导电能力不断增大,主要是由于稀硫酸过量的原因 C、a时刻溶液的导电能力接近为0,所以BaSO4是非电解质 D、该反应发生的离子方程式为Ba2++OH-+H++SO= BaSO4↓+H2O
A、实验时用NaOH代替Ba(OH)2也能得到该曲线 B、YZ段溶液的导电能力不断增大,主要是由于稀硫酸过量的原因 C、a时刻溶液的导电能力接近为0,所以BaSO4是非电解质 D、该反应发生的离子方程式为Ba2++OH-+H++SO= BaSO4↓+H2O -
20、下列离子方程式书写正确的是A、氢氧化钡与稀硫酸反应: B、溶于盐酸中: C、铜和硝酸银溶液反应: D、中加入硝酸: