-
1、便携式消毒除菌卡主要活性成分为亚氯酸钠(NaClO2);一种制备NaClO2粗产品的工艺流程如图。已知纯ClO2易分解爆炸,一般用空气稀释到10%以下。
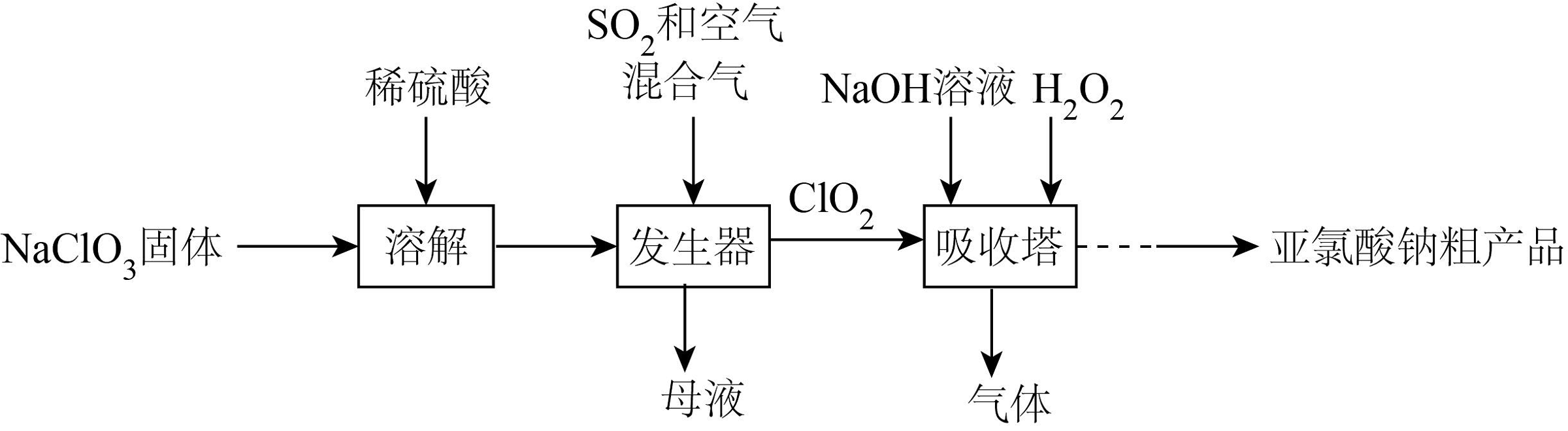
下列说法正确的是
A、溶解过程中可以用盐酸代替稀硫酸 B、流程中H2O2做氧化剂 C、发生器中鼓入空气的主要目的是提供氧化剂 D、吸收塔中温度不宜过高,否则会导致NaClO2产率下降 -
2、甲酸(HCOOH)可在纳米级Pd表面分解为活性H2和CO2 , 经下列历程实现NO的催化还原。已知Fe(Ⅱ)、Fe(Ⅲ)表示Fe3O4中二价铁和三价铁。下列说法不正确的是
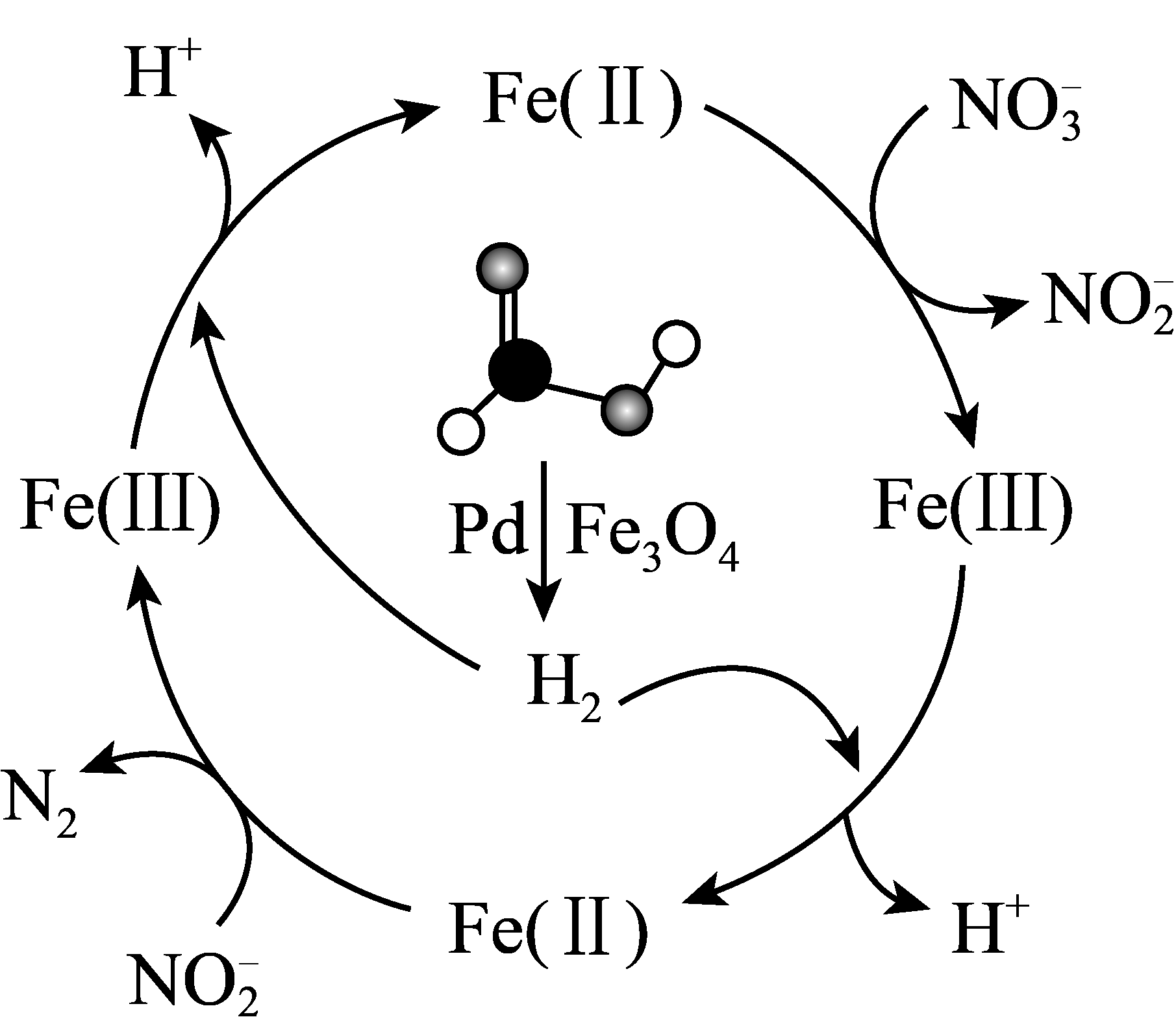 A、生产中将催化剂处理成纳米级颗粒可增大甲酸分解的速率 B、在整个历程中,每1molH2可还原2molNO C、HCOOH分解时,只有极性共价键发生了断裂 D、反应历程中生成的H+可调节体系pH,有增强NO氧化性的作用
A、生产中将催化剂处理成纳米级颗粒可增大甲酸分解的速率 B、在整个历程中,每1molH2可还原2molNO C、HCOOH分解时,只有极性共价键发生了断裂 D、反应历程中生成的H+可调节体系pH,有增强NO氧化性的作用 -
3、下列物质性质实验对应的化学反应的离子方程式书写正确的是A、Fe与FeCl3溶液反应:Fe+Fe3+=2Fe2+ B、大理石与醋酸反应:CaCO3+2H+=Ca2++H2O+CO2↑ C、将Na2O2固体投入H218O中:2Na2O2+2H218O=4Na++218OH-+2OH-+O2↑ D、向Ba(OH)2溶液中加入过量NaHSO4溶液:Ba2++OH-+H++SO=BaSO4↓+H2O
-
4、某实验小组为制备并探究SO2的化学性质,下列装置中不能达到实验目的的是




A.制取SO2
B.验证SO2的还原性
C.验证SO2的漂白性
D.吸收尾气
A、A B、B C、C D、D -
5、“光荣属于劳动者,幸福属于劳动者。”下列劳动项目与所述化学知识没有关联的是
选项
劳动项目
化学知识
A
用食醋清除水壶中的水垢
醋酸的酸性强于碳酸
B
制作豆腐的过程中煮沸豆浆
加热条件下,蛋白质可发生变性
C
制作面点时加入食用纯碱
NaHCO3能与发酵过程中产生的酸发生反应
D
清洗铁锅后及时擦干
减缓铁锅因发生吸氧腐蚀而生锈
A、A B、B C、C D、D -
6、海带中含有碘元素,从海带中提取碘的实验过程如图所示:

下列说法正确的是
A、海带中碘元素以I2形式存在 B、操作①可除去海带中的有机物 C、操作③为过滤,操作⑥为萃取 D、操作⑤用到的玻璃仪器有普通漏斗 -
7、绿色有机合成具有原子经济性高、充分利用资源、减少污染等特点。下列说法不正确的是
 A、化合物I分子中所有碳原子可能共平面 B、1mol化合物II最多能与4molH2发生加成反应 C、化合物I和III均能使酸性KMnO4溶液褪色 D、化合物III能与FeCl3溶液发生显色反应
A、化合物I分子中所有碳原子可能共平面 B、1mol化合物II最多能与4molH2发生加成反应 C、化合物I和III均能使酸性KMnO4溶液褪色 D、化合物III能与FeCl3溶液发生显色反应 -
8、安全无小事。下列操作不符合实验安全要求的是A、眼睛溅进酸液,先用大量水冲洗,再用饱和碳酸钠溶液冲洗 B、实验中剩余的少量金属钠,可以放回原试剂瓶 C、闻气体时,用手在瓶口轻轻扇动,使少量气体飘进鼻孔 D、苯酚沾到皮肤上,立即用酒精擦洗后再用水冲洗
-
9、结构决定性质。下列性质差异与结构因素不匹配的是
选项
性质差异
结构因素
A
在CCl4中的溶解度:I2>ICl
分子极性
B
熔点:SiC(2830℃)>SiF4(-90℃)
晶体类型
C
沸点:对氨基苯甲醛>邻氨基苯甲醛
氢键类型
D
电离常数Ka:F3CCOOH>Cl3CCOOH
范德华力
A、A B、B C、C D、D -
10、化学推动着社会的进步和人类的发展。下列说法正确的是A、通过煤的干馏等物理变化可以获得多种化工原料 B、红外光谱可用于测定新型材料的相对分子质量 C、植物光合作用涉及氧化还原反应 D、光伏发电系统工作时将电能转化为化学能
-
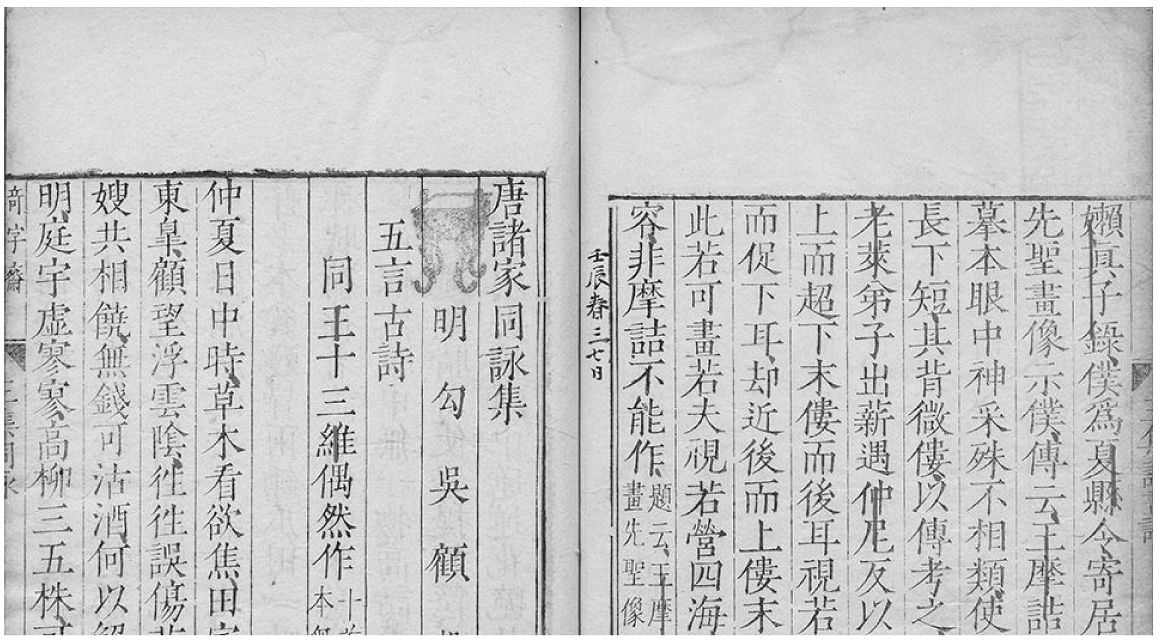
11、文物是文化传承的重要载体。下列在深圳博物馆展出的文物中,主要材质为有机高分子的是



蟠螭纹铜编钟
彩绘仕女陶俑
龙首谷纹玉玦
唐王右丞诗集
A
B
C
D
A、A B、B C、C D、D -
12、一定条件下白磷和红磷可以相互转化,白磷转化为红磷的能量变化如图所示,下列说法错误的是
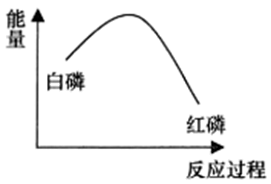 A、白磷转化为红磷是放热反应 B、红磷比白磷稳定性更高 C、等质量的红磷所含有的能量高于白磷 D、相同物质的量的白磷和红磷完全燃烧,白磷释放的热量多
A、白磷转化为红磷是放热反应 B、红磷比白磷稳定性更高 C、等质量的红磷所含有的能量高于白磷 D、相同物质的量的白磷和红磷完全燃烧,白磷释放的热量多 -
13、宏观辨识与微观探析相结合是化学特有的认识物质的方法。NaCl溶于水的过程如图所示。下列说法正确的是
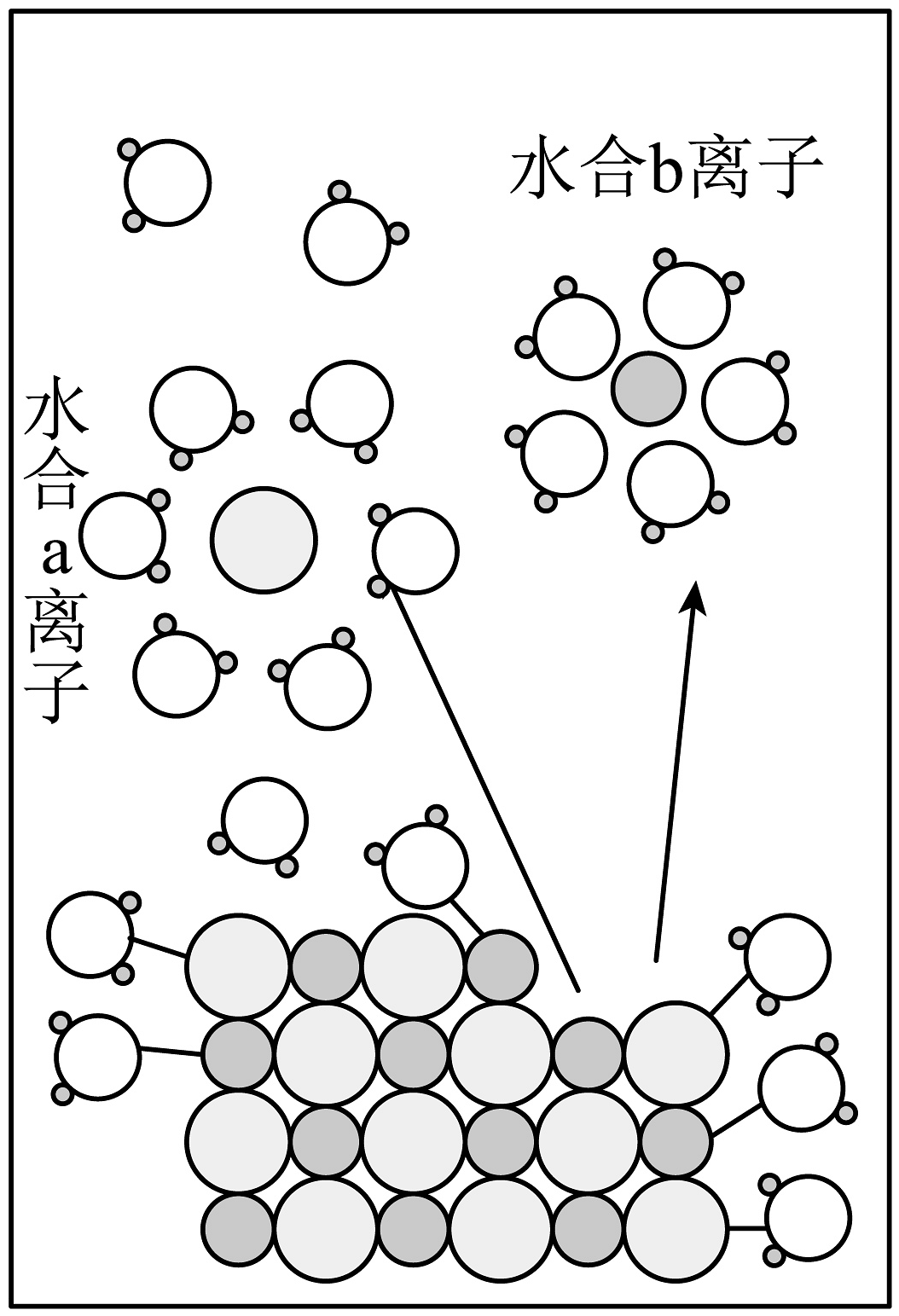 A、图中水合b离子为水合氯离子 B、NaCl溶液导电时,水合钠离子移向与电源负极相连的电极 C、固体NaCl溶于水前不能导电是因为无Na+和Cl- D、NaCl溶于水的电离过程为:NaClNa++Cl-
A、图中水合b离子为水合氯离子 B、NaCl溶液导电时,水合钠离子移向与电源负极相连的电极 C、固体NaCl溶于水前不能导电是因为无Na+和Cl- D、NaCl溶于水的电离过程为:NaClNa++Cl- -
14、化工专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备 , 进一步处理得到产品和 , 实验流程如图:

回答下列问题:
(1)、从A~E中选择合适的仪器制备 , 正确的连接顺序是(按气流方向,用小写字母表示)。 (2)、B中使用雾化装置的优点是。(3)、生成的总反应的化学方程式为。(4)、反应完成后,将B中U形管内的混合物处理得到固体和滤液:
(2)、B中使用雾化装置的优点是。(3)、生成的总反应的化学方程式为。(4)、反应完成后,将B中U形管内的混合物处理得到固体和滤液:①对固体充分加热,产生的气体先通过足量浓硫酸,再通过足量 , 增重 , 则固体的质量为g。
②市场上销售的“苏打水"是一种非常受欢迎的饮用水,其溶质是小苏打。苏打水会因储藏温度过高而分解产生少量使口感发涩,写出一种除去中改善口感的方法(用离子方程式表示)。
③固体保存不当,会发生变质部分转化为 , 下列不能测定变质后的混合物中的质量分数的是。
a.取混合物与足量溶液充分反应,得到溶液
b.取混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到固体
c.取混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,质量增加
d.取混合物与足量溶液充分反应,过滤、洗涤、烘干,得固体
-
15、现有一定量含有杂质的试样,用下图的实验装置测定试样的纯度。(可供选用的反应物只有固体、盐酸、稀硫酸和蒸馏水)
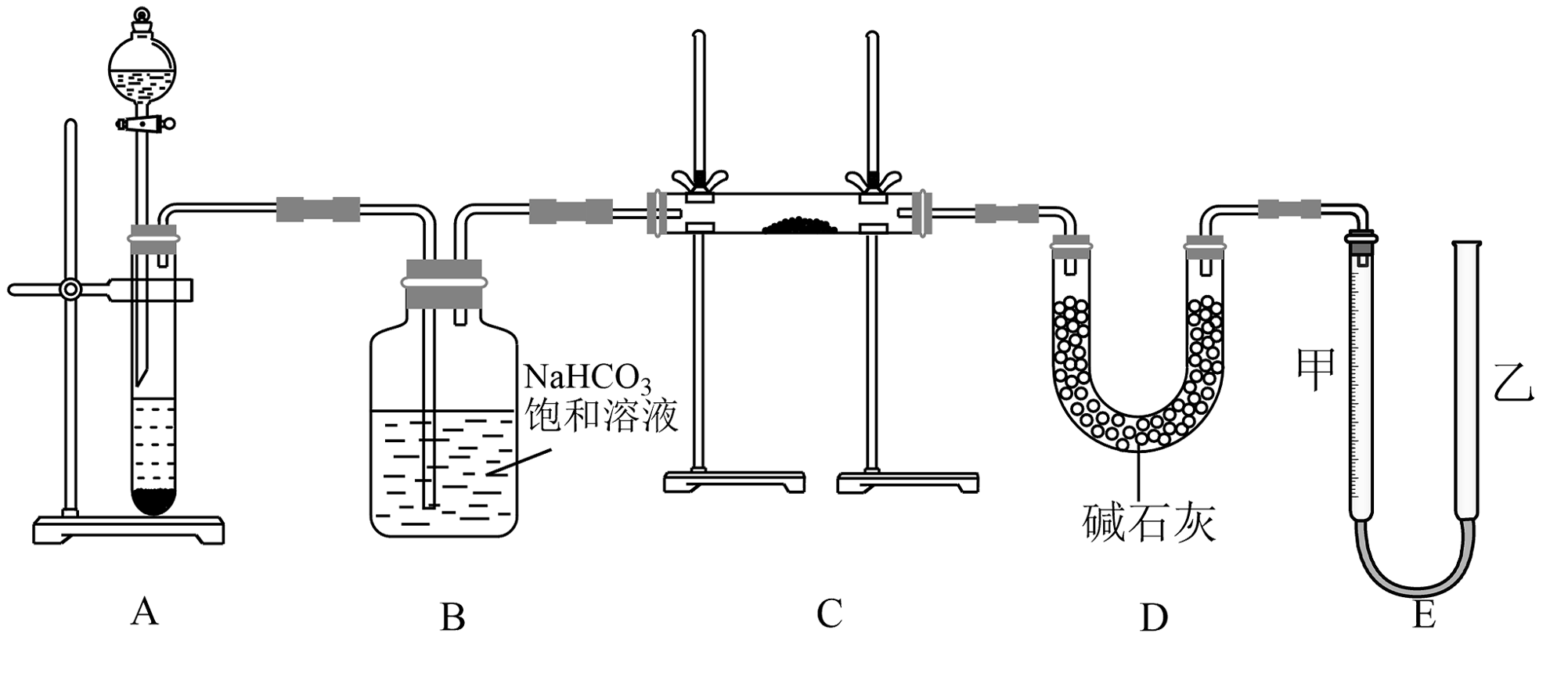
回答下列问题:
(1)、装置A中发生反应的离子方程式。(2)、装置D中碱石灰的作用是。(3)、若开始时测得样品的质量为 , 反应结束后测得气体体积为 , 该条件下此气体密度为。则试样的纯度为。(4)、为了较准确地用E装置测量氧气的体积,除了必须检查整个装置的气密性之外,在读取反应前后甲管中液面的读数求其差值的过程中还应注意___________。A、读数时视线与凹液面最低处保持水平 B、反应结束即可立刻读数,以免氧气溶解到水中影响实验结果 C、实验开始和结束时都应上下移动乙管,使甲、乙两管液面相平再读数 D、实验结束读数时若甲管中液面高于乙管时,所测气体体积偏小(5)、a克下列物质在氧气中充分燃烧后的气体(、120℃)通过足量的充分反应后增重b克,符合的选项有___________。A、 B、 C、 D、 -
16、如图所示物质之间的转化,已知:A是金属单质,且焰色试验为黄色,X为常见温室气体。按要求回答下列问题:
 (1)、D的化学式:。(2)、A→B的离子方程式:。(3)、下列说法正确的是___________。A、氢氧化钙溶液和氯化钙溶液均可鉴别D、E两种溶液 B、若G是A在空气中加热生成的,则在一定条件下G能转化为B,但不能转化为D C、少量的A放置于敞口容器中最终可变成物质D D、将A投入到E的溶液中,也会有D生成(4)、D和E的固体混合物加热到质量不再变化时,剩余物质的质量为 , 则混合物中D的质量分数为(计算结果精确到0.1)。(5)、设计实验检验B中的阳离子。
(1)、D的化学式:。(2)、A→B的离子方程式:。(3)、下列说法正确的是___________。A、氢氧化钙溶液和氯化钙溶液均可鉴别D、E两种溶液 B、若G是A在空气中加热生成的,则在一定条件下G能转化为B,但不能转化为D C、少量的A放置于敞口容器中最终可变成物质D D、将A投入到E的溶液中,也会有D生成(4)、D和E的固体混合物加热到质量不再变化时,剩余物质的质量为 , 则混合物中D的质量分数为(计算结果精确到0.1)。(5)、设计实验检验B中的阳离子。 -
17、按要求回答下列问题:(1)、某届奥运会期间,工作人员将“84”消毒液(有效成分为“”)与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是与反应产生促进藻类快速生长。该反应说明氧化性:(填“>”或“<”);当参加反应的和两物质的个数比为时,该反应的还原产物为(填字母序号)。
A. B. C. D. E.
(2)、饮用水中的对人类健康会产生危害,为了降低饮用水中的浓度,可以在碱性条件下用铝粉将还原为 , 其化学方程式为:。①用双线桥法表示反应中电子转移的方向和数目:。
②该反应中氧化剂和还原剂的个数之比:。
③若除去废液中(不考虑废液中其它物质与反应),则消耗的需要g。
-
18、现有以下物质:①铜 ②液态 ③熔融的烧碱 ④固体 ⑤胶体 ⑥粉末 ⑦ ⑧汽油 ⑨冰醋酸 ⑩(1)、以上物质中属于混合物的是;能导电的电解质是(填序号)。(2)、写出⑥溶于水的电离方程式。(3)、写出将④⑥混合溶于水后发生反应的离子方程式。(4)、往盛有氢氧化钠浓溶液的烧杯中逐滴滴加醋酸溶液,溶液的导电能力随滴入醋酸的体积变化曲线为___________(填字母)。A、
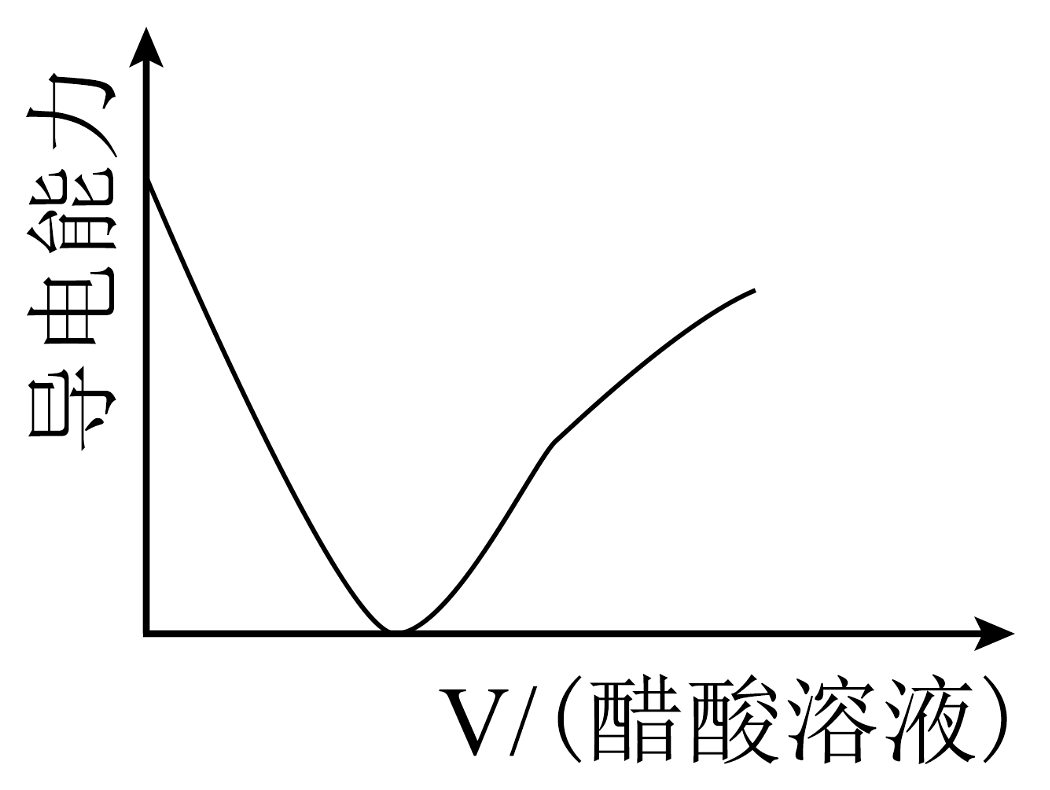 B、
B、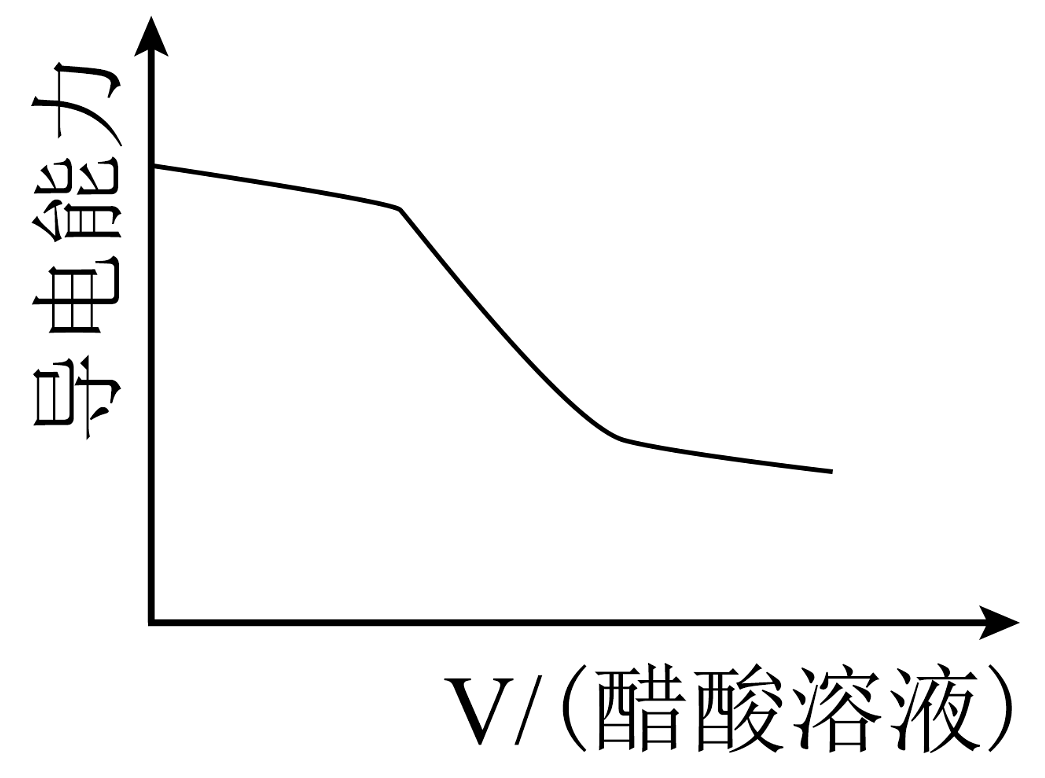 C、
C、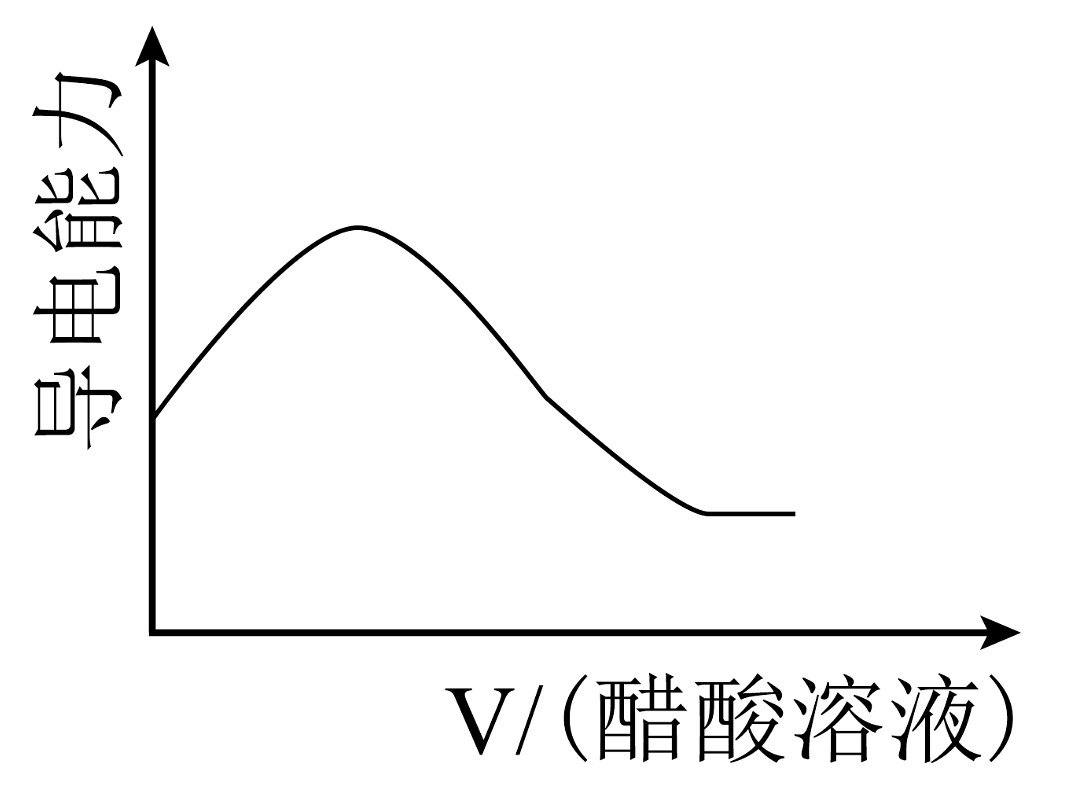 D、
D、
-
19、根据下列实验操作和现象得出的结论或解释正确的是
选项
实验操作和现象
结论或解释
A
向饱和的碳酸钠溶液中通入足量的 , 产生白色沉淀
相同温度下溶解度:碳酸钠>碳酸氢钠
B
向久置的粉末中加入过量稀硫酸,产生了无色气体
全部变质为
C
取钠与氧气反应所得的少量固体,加入蒸馏水,产生气体
固体为
D
用洁净的铂丝蘸取某溶液进行焰色反应,火焰呈黄色
该溶液一定是钠盐溶液
A、A B、B C、C D、D -
20、一种用氢气制备双氧水的反应原理如图所示,已知在化合物中钯()均以价形式存在,下列有关说法正确的是
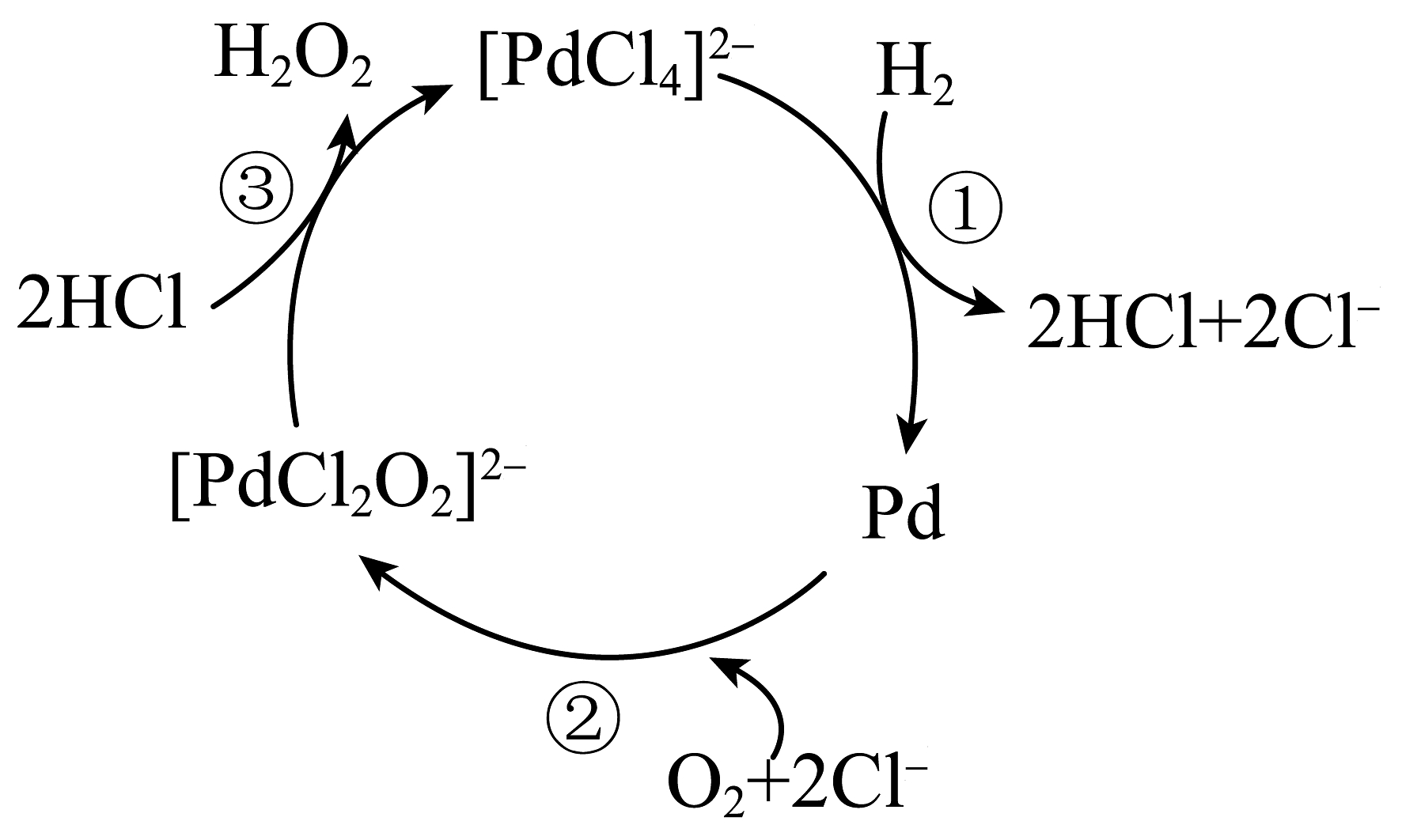 A、反应①②③均为氧化还原反应 B、反应①中为还原产物 C、反应②中每产生1个 , 转移2个电子 D、和均为该反应的催化剂
A、反应①②③均为氧化还原反应 B、反应①中为还原产物 C、反应②中每产生1个 , 转移2个电子 D、和均为该反应的催化剂