相关试卷
- 江苏省苏州市园区苏州大学附属中学2025-2026学年高一上学期10月月考化学试题
- 甘肃省多校2025-2026学年 高三上学期第一次联考考试 化学试卷
- 广东省金太阳2025-2026学年高三上学期8月开学联考化学试卷
- 广东省四校普通高中教学质量检测2025-2026学年高三上学期10月月考化学试题
- 江苏省部分高中2024-2025学年高一上学期期末迎考化学试题
- 江苏省盐城市七校联考2025-2026学年高三上学期期初考试化学试卷
- 广东省广州奥林匹克中学2025-2026学年高三上学期9月月考 化学试题
- 江苏省常州市金坛区第一中学2025-2026学年高三上学期开学化学试题
- 广东省清远市阳山县南阳中学2025-2026学年高一上学期第一次月考 化学试题
- 广州市2025-2026学年高三上学期 八月阶段训练化学试题
-
1、下列有关实验安全的叙述不正确的是A、观察活泼金属与H2O反应时,需要戴护目镜 B、GHS标准符号
 示意“毒性物质”
C、若不慎将碱沾到皮肤上,应立即用大量水冲洗,然后涂上1%的硼酸
D、中学实验室中可以将未用完的钠、钾和白磷等放回原试剂瓶
示意“毒性物质”
C、若不慎将碱沾到皮肤上,应立即用大量水冲洗,然后涂上1%的硼酸
D、中学实验室中可以将未用完的钠、钾和白磷等放回原试剂瓶
-
2、下列说法不正确的是A、侯德榜是我国著名化工专家,发明了侯氏制碱法 B、戴维发现了一种黄绿色气体,并确认该气体为氯气 C、瑞典化学卷阿伦尼乌斯研究电解质稀溶液的导电性,提出了电离模型 D、英国科学家道尔顿提出原子学说,为近代化学的发展奠定了坚实的基础
-
3、名称为“坩埚”的仪器是A、
 B、
B、 C、
C、 D、
D、
-
4、根据物质的组成与性质进行分类,属于A、酸 B、氧化物 C、碱 D、盐
-
5、完成下列计算。(1)、现有标准状况下CO和混合气体3.36L,其质量为5g,则混合气体中,CO和物质的量之比为。(2)、现有和的混合物,置于试管中加热到质量不再变化时,得到42.4g固体,则原混合物中和的物质的量之比为。(3)、用催化分解 , 当转移电子的个数为时,得到的在标准状况下的体积为。(4)、硫酸钠和硫酸铝的混合溶液中,测得浓度为 , 加入等体积的氯化钡溶液恰好使完全沉淀,则原混合溶液中浓度为。
-
6、
Ⅰ.如图为氯元素的“价-类”二维图。回答下列问题:
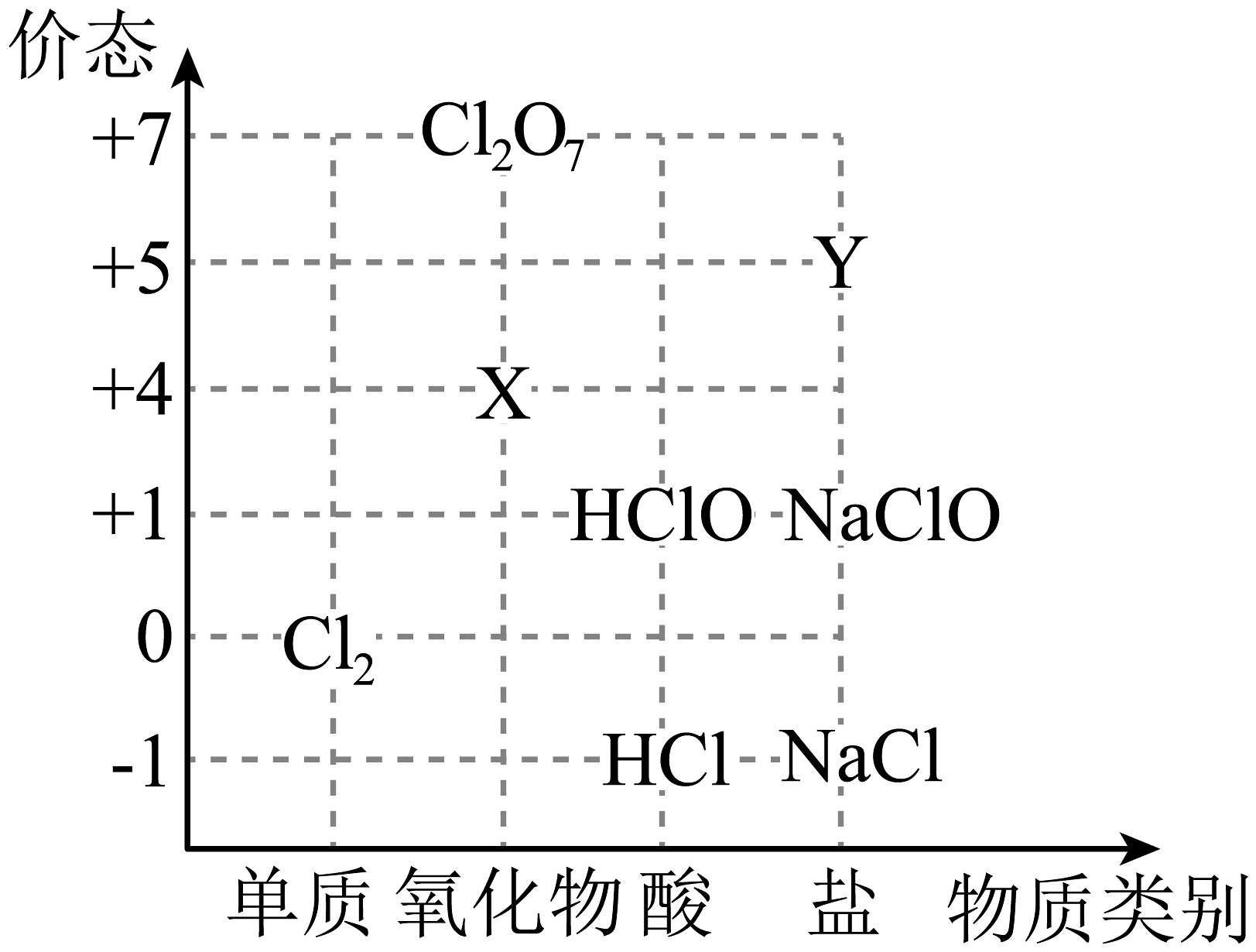
(1)X可以代替成为新时代自来水消毒剂,则X是________(填化学式,下同);Y的焰色试验呈紫色,则Y是________。
(2)从化合价角度看,HCl能与___________发生反应(填序号)。
A. NaClO B. Fe C. D. NaOH (3)一种酸性氧化物,写出与NaOH反应的化学方程式:________。
Ⅱ.青铜是金属冶炼史上最早冶炼的合金,我国出土了大量青铜器,体现了古代中国对人类文明的巨大贡献。青铜器在埋藏过程中会逐渐生锈,其修复工作是文物保护的重要环节。
(4)查阅资料得知铜锈的主要成分为 , 俗称铜绿,是由于铜长期放置在潮湿空气中所致,请写出该过程的化学方程式:________。
(5)铜绿可溶于酸,将少量的铜绿粉末加入足量的稀硫酸中,可观察到的现象为________,写出反应的离子方程式:________。
(6)继续查阅资料,了解到铜锈的成分很复杂,主要成分有和。结构如图所示:
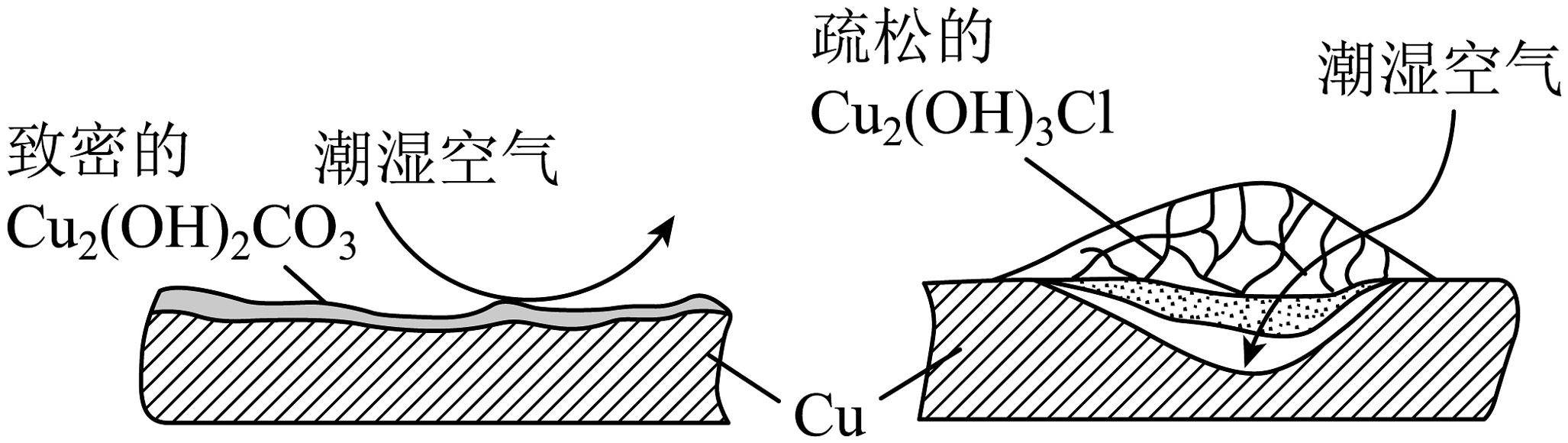
考古学家将铜锈分为“无害锈”和“有害锈”,“无害锈”形成后可阻止内部金属继续腐蚀,而“有害锈”则无法阻止腐蚀的深入。结合两种铜锈的结构推测,“有害锈”的主要成分为:________。
(7)青铜器的修复有多种方法,其中之一是碳酸钠法:将腐蚀文物置于含碳酸钠和碳酸氢钠的混合溶液中浸泡,使转化为。请写出该方法涉及的离子方程式________。
-
7、按要求写出下列反应的离子方程式。(1)、次氯酸见光分解:。(2)、澄清石灰水中加入过量溶液:。(3)、用醋酸()除去水垢:。(4)、实验室用与浓盐酸制取:。(5)、溶液与酸性溶液反应生成与 , 并用双线桥标出电子转移:。
-
8、某化学兴趣小组模拟侯氏制碱法进行实验,流程如图所示。下列说法正确的是
 A、气体N,M分别为和 B、气体可以循环利用,因此工业生产时理论上不需要进行补充 C、加入NaCl粉末的作用是增 , 促进结晶析出 D、加入NaCl粉末后所得“食盐水”中溶质只有NaCl
A、气体N,M分别为和 B、气体可以循环利用,因此工业生产时理论上不需要进行补充 C、加入NaCl粉末的作用是增 , 促进结晶析出 D、加入NaCl粉末后所得“食盐水”中溶质只有NaCl -
9、已知反应:①;②(浓);③。
下列说法正确的是
A、上述三个反应都是置换反应 B、氧化性由弱到强的顺序为 C、反应①中氧化剂与还原剂的物质的量之比为2:1 D、反应③中若反应 , 则还原剂得电子的物质的量为5mol -
10、关于实验室安全,下列表述错误的是A、如果不慎将碱沾在皮肤上,应立即用大量水冲洗,然后涂上1%的醋酸 B、具有
 标识的化学品为爆炸类物质,实验时不准敲击、摩擦和挤压
C、轻微烫伤或烧伤时,可先用洁净的冷水处理,然后涂上烫伤药膏
D、少量浓硫酸溅到皮肤上时,应用大量水冲洗并涂上稀的溶液
标识的化学品为爆炸类物质,实验时不准敲击、摩擦和挤压
C、轻微烫伤或烧伤时,可先用洁净的冷水处理,然后涂上烫伤药膏
D、少量浓硫酸溅到皮肤上时,应用大量水冲洗并涂上稀的溶液
-
11、下列有关氯气的叙述中,不正确的是A、为方便运输可用干燥的钢瓶储存液氯 B、工业上用电解饱和食盐水制备氯气 C、灼热的铁丝放入盛有干燥氯气的集气瓶中燃烧生成棕色的烟雾 D、干燥的氯气能使鲜花褪色
-
12、某固体粉末由与组成,将其分成等量的两份,第一份恰好与盐酸完全中和;第二份与足量的气体作用,发现该固体质量增加了11.6g,试计算:(1)、与第一份反应的盐酸的物质的量是。(2)、固体中与的物质的量之比是。
-
13、如图是一套制取并验证氯气部分化学性质的实验装置。已知:。

回答下列问题:
(1)、写出装置A中仪器a的名称。(2)、为了尽量减少浓盐酸挥发和多余氯气尽量被氢氧化钠充分吸收(产生氯气不能太快),可采取的措施有(写两条):;。(3)、若要证明无漂白性,则必须在C与D装置之间加一个装有为洗气瓶,此实验条件下装置D中干燥的有色布条褪色的可能原因是。(4)、装置E中反应的离子方程式为。(5)、经测定E中得到1mol NaClO和 , 则吸收过程中消耗NaOH物质的量为mol。(6)、某消毒小组人员用的浓硫酸配制的稀硫酸用于84消毒液消毒能力的实验探究,在配制过程中,下列操作中能使所配溶液的浓度偏低的有(填代号)。①用量筒量取98%的硫酸时俯视
②未等稀释后的溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④转移过程中,有少量液体溅出
⑤定容时,加蒸馏水超过标线,又用胶头滴管吸出
-
14、从钛铁矿提取金属钛(海绵钛)的主要工艺过程如下:
 (1)、第一步:钛铁矿的主要成分是 , 第一步发生的反应: , 该反应的氧化产物是。(2)、第二步:第一步反应所得的高钛渣主要成分为二氧化钛,在高温下与焦炭、氯气反应,焦炭转化为一氧化碳,写出该反应的化学方程式。(3)、第三步用Mg高温下还原四氯化钛需要在惰性气体或隔绝空气条件下进行,原因是。(4)、单质镁通过电解熔融氯化镁的方式得到,请用一个化学方程式说明不能通过钠与氯化镁溶液反应制备单质镁的原因:。(5)、在潮湿的空气中产生白色的烟雾,生成和一种二元化合物,请写出此二元化合物分子式。
(1)、第一步:钛铁矿的主要成分是 , 第一步发生的反应: , 该反应的氧化产物是。(2)、第二步:第一步反应所得的高钛渣主要成分为二氧化钛,在高温下与焦炭、氯气反应,焦炭转化为一氧化碳,写出该反应的化学方程式。(3)、第三步用Mg高温下还原四氯化钛需要在惰性气体或隔绝空气条件下进行,原因是。(4)、单质镁通过电解熔融氯化镁的方式得到,请用一个化学方程式说明不能通过钠与氯化镁溶液反应制备单质镁的原因:。(5)、在潮湿的空气中产生白色的烟雾,生成和一种二元化合物,请写出此二元化合物分子式。 -
15、
某化学兴趣小组设计实验,探究离子反应及氧化还原反应的本质。
I.电解质在水溶液中的反应
向溶液中滴入几滴酚酞溶液,然后向溶液中滴加溶液。请回答下列问题:
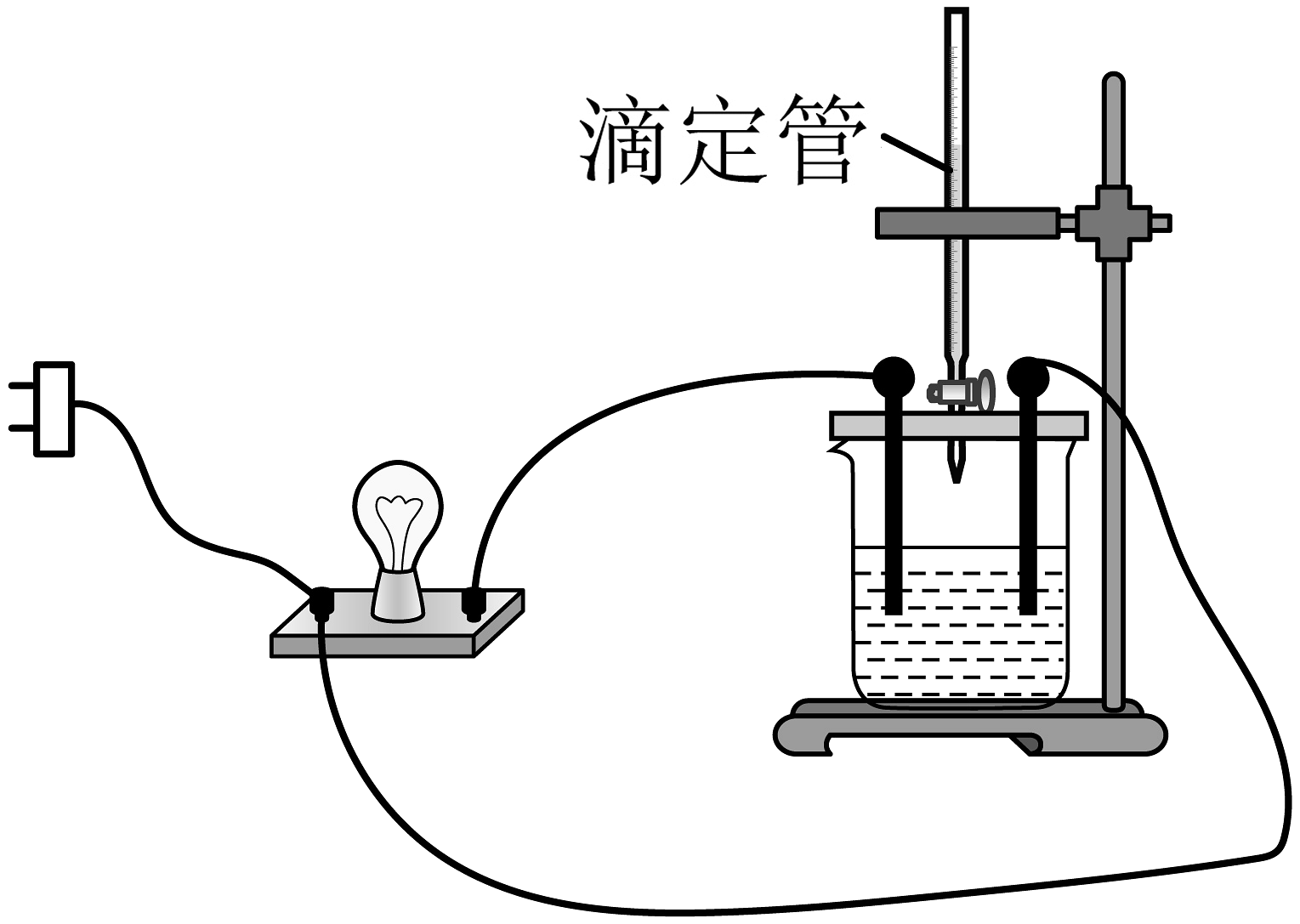
(1)按如图所示连接装置,并接通电源,发现灯泡变亮,某同学认为在电流的作用下,溶液电解离出了可导电的离子,此观点(填写“正确”或“错误”)。随着溶液的滴入,溶液中物质的量减小的主要微粒有。
(2)可观察到烧杯中溶液红色逐渐褪去,产生白色沉淀,小灯泡亮度变暗,该反应的离子方程式为。
(3)某同学认为用溶液代替溶液进行上述实验,结果发现灯泡变暗的程度不明显,推测当溶液刚好沉淀完全时候,溶液中还存在的导电主要微粒为。
Ⅱ.氧化还原反应
将锌片和石墨棒用导线连接,平行放置在硫酸铜溶液中,装置如图所示。观察到电流表指针偏转,锌片逐渐溶解,石墨棒上有红色物质析出。请回答下列问题:

(4)已知石墨棒上的反应式为: , 该反应类型为填“氧化反应”,“还原反应”或“氧化还原反应”);类比锌片上的反应,写出锌片棒上的反应式。该实验说明氧化还原反应的本质是电子的转移。
(5)实验过程中,兴趣小组同学发现一个完整的氧化还原反应方程式可以拆开写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如的拆写结果是:氧化反应为:;还原反应为:。
-
16、按要求完成下列各小题:(1)、下列有关物质的分类或归类说法正确的是。
①液氯、干冰、纯碱均为纯净物
②常温下,氯水和液氯均可用钢罐存放
③焰色实验使用的铂丝用盐酸洗涤,在灯焰灼烧至与原来灯焰颜色相同
④纳米材料一定为胶体
⑤离子反应只能代表强酸与强碱的中和反应
(2)、氢原子的物质的量相等的四种气体、、、 , 在同温同压下,此四种气体体积之比。(3)、在标准状况下,224mL某气体的质量为0.64g,该气体的摩尔质量为。(4)、用溶液配溶液,需量取溶液。(5)、现有下列8种物质:①②③盐酸④熔融⑤固体⑥液氯⑦胆矾晶体⑧蔗糖晶体。上述物质属于电解质的有(填序号)。 -
17、下列“实验结论”与“实验操作及现象”不相符的一组是
实验操作及现象
实验结论
A
向KI-淀粉溶液中滴加氯水,溶液变成蓝色
氧化性:
B
将钠放入热坩埚中加热燃烧,生成淡黄色固体
反应有生成
C
用玻璃棒蘸取氯水,点在湿润的pH试纸中间
可测得氯水的pH
D
向某溶液中加入几滴溶液,有白色沉淀生成,再加入少量稀硝酸,沉淀不溶解
溶液中可能含有
A、A B、B C、C D、D -
18、重铬酸铵[(NH4)2Cr2O7]受热分解的反应为氧化还原反应。下列对重铬酸铵受热分解的产物的判断符合实际的是( )A、NH3+CrO3+H2O B、NH3+Cr2O3+H2O C、N2+CrO3+H2O D、N2+Cr2O3+H2O
-
19、和的混合气体共0.1mol,通过足量的灼热的氧化铜,完全反应后,气体再全部通入足量的澄清石灰水中,得到的白色沉淀质量是A、5g B、10g C、15g D、20g
-
20、为提纯下列物质(括号内为杂质)选用的试剂和分离方法都正确的是
物质
试剂
分离方法
A
饱和碳酸
氢钠溶液
洗气
B
点燃
C
溶液
足量铁粉
过滤
D
NaOH溶液
洗气
A、A B、B C、C D、D