相关试卷
- 江苏省苏州市园区苏州大学附属中学2025-2026学年高一上学期10月月考化学试题
- 甘肃省多校2025-2026学年 高三上学期第一次联考考试 化学试卷
- 广东省金太阳2025-2026学年高三上学期8月开学联考化学试卷
- 广东省四校普通高中教学质量检测2025-2026学年高三上学期10月月考化学试题
- 江苏省部分高中2024-2025学年高一上学期期末迎考化学试题
- 江苏省盐城市七校联考2025-2026学年高三上学期期初考试化学试卷
- 广东省广州奥林匹克中学2025-2026学年高三上学期9月月考 化学试题
- 江苏省常州市金坛区第一中学2025-2026学年高三上学期开学化学试题
- 广东省清远市阳山县南阳中学2025-2026学年高一上学期第一次月考 化学试题
- 广州市2025-2026学年高三上学期 八月阶段训练化学试题
-
1、下列指定条件下的物质转化能够实现的是A、 B、 C、 D、
-
2、下列反应可用离子方程式表示的是A、碳酸钙和盐酸反应 B、碳酸钠和硫酸反应 C、碳酸氢钠与硝酸反应 D、碳酸钾和醋酸反应
-
3、常温常压,含有相同分子数的和 , 体积相同的原因是A、该条件下和的质量相同 B、该条件下和的密度相同 C、该条件下分子间距离相同 D、该条件下和分子的大小相同
-
4、关于常温常压下,0.1molHCl气体,下列说法不正确的是A、约含个HCl分子 B、质量为3.65g C、体积为2.24L D、溶于水配成100mL溶液,则HCl的物质的量浓度为
-
5、实验室用下列装置制取、净化、收集并验证氯水呈酸性,能达到实验目的的是




A
B
C
D
A、制备 B、干燥 C、收集 D、验证氯水的酸性 -
6、下图所示为Cr元素的部分化合物的转化图。下列说法不正确的是
 A、转化①可以加入NaOH溶液实现 B、转化②可以加入盐酸实现 C、转化③需要加入氧化剂才能实现 D、转化④中发生还原反应
A、转化①可以加入NaOH溶液实现 B、转化②可以加入盐酸实现 C、转化③需要加入氧化剂才能实现 D、转化④中发生还原反应 -
7、工业上炼铁中含有下列反应,其中不属于氧化还原反应的是A、 B、 C、 D、
-
8、下列不属于碱的通性的是A、能与酸反应生成盐和水 B、能与酸性氧化物反应生成盐和水 C、能与活泼金属反应生成 D、能与某些盐反应生成新的碱和新的盐
-
9、下列物质的性质与用途具有对应关系的是A、氧化铝能溶于酸,可用于制作耐磨材料 B、碳酸氢钠呈碱性,可用于焙制糕点 C、铁粉可与氧气反应,可用作食品脱氧剂 D、氧化铁熔点高,可用于制红色颜料
-
10、向绿矾溶液中滴加过量新制氯水,充分反应后溶液中不能大量存在的离子是A、 B、 C、 D、
-
11、下列有关钠及其化合物的说法正确的是A、金属活动性: B、的结构示意图:
 C、中Na的化合价为
D、的电离方程式:
C、中Na的化合价为
D、的电离方程式:
-
12、发射神舟飞船的火箭箭体使用的是某种铝合金材料。下列不属于火箭箭体所用铝合金材料特点的是A、强度高 B、密度大 C、延展性好 D、耐腐蚀
-
13、下列关于碱金属元素和卤族元素的说法错误的是A、由于钠和钾的原子结构极为相似,所以它们对应的碱都是强碱 B、通过钠与钾分别与水反应的剧烈程度可知,碱金属元素原子半径越大,失电子能力越强 C、碱金属元素的单质在氧气中燃烧均生成过氧化物 D、通过卤素单质与氢气反应所需要的反应条件难易,可以判断氯的非金属性比溴强
-
14、实验室制备氯气的方法有多种,下列说法错误的是A、KClO3与浓盐酸制备Cl2时,盐酸既表现酸性又表现还原性 B、Ca(ClO)2与浓盐酸制备Cl2时,Cl2既是氧化产物又是还原产物 C、KMnO4、Ca(ClO)2分别与浓盐酸反应,产生等量Cl2时转移电子数也相同 D、KMnO4和浓盐酸制备Cl2无需加热,因此不能用盐酸来酸化KMnO4溶液
-
15、一种矿物由短周期元素W、X、Y组成,溶于稀盐酸有无色无味气体生成。W、X、Y原子序数依次增大。简单离子X2-与Y2+具有相同的电子结构。下列叙述正确的是A、X的常见化合价有-1、-2 B、原子半径大小为Y>X>W C、YX的水合物具有两性 D、W单质只有2种同素异形体
-
16、
常温下,某小组同学用如图装置探究的沉淀溶解平衡。
实验装置
实验序号
传感器种类
实验操作
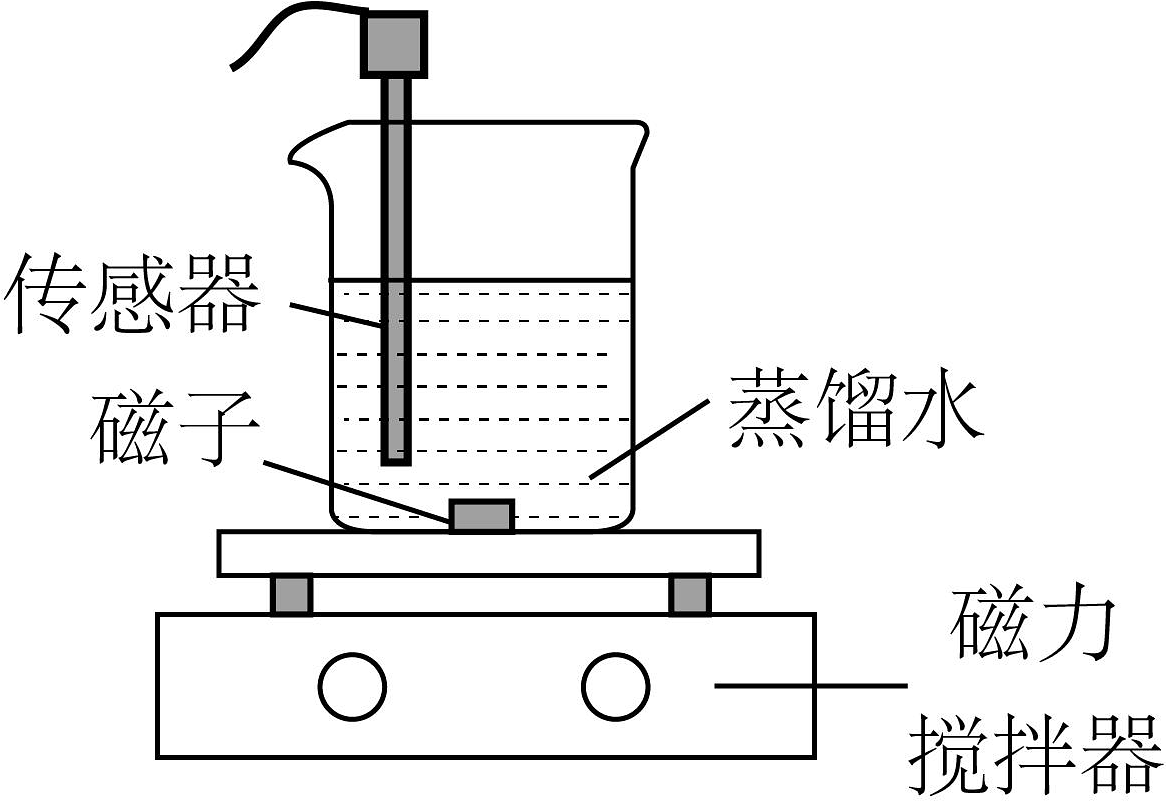
①
电导率传感器
向蒸馏水中加入足量粉末,一段时间后,再向所得悬浊液中加入少量蒸馏水
②
传感器
向滴有酚酞溶液的蒸馏水中加入足量粉末,一段时间后,再向所得悬浊液中加入一定量稀硫酸,一段时间后,仍存在粉末
Ⅰ.实验①测得电导率随时间变化的曲线如图1所示。
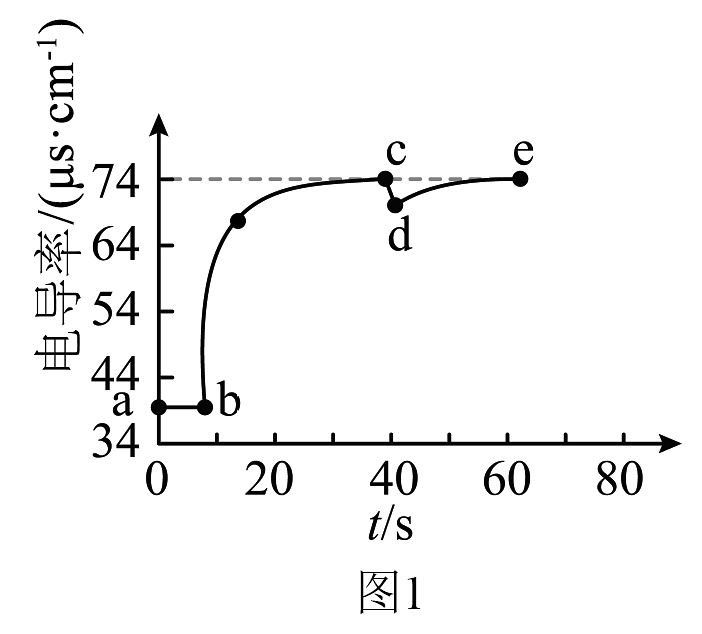
已知:在稀溶液中,离子浓度越大,电导率越大。
(1)点电导率不等于0的原因是。
(2)由图1可知,在悬浊液中再加入少量蒸馏水的时刻为(填“”“”或“”)点。
(3)分析电导率在段逐渐上升的原因:时刻,(填“>”“<”或“=”) , 导致。
Ⅱ.实验②测得随时间变化的曲线如图2所示。
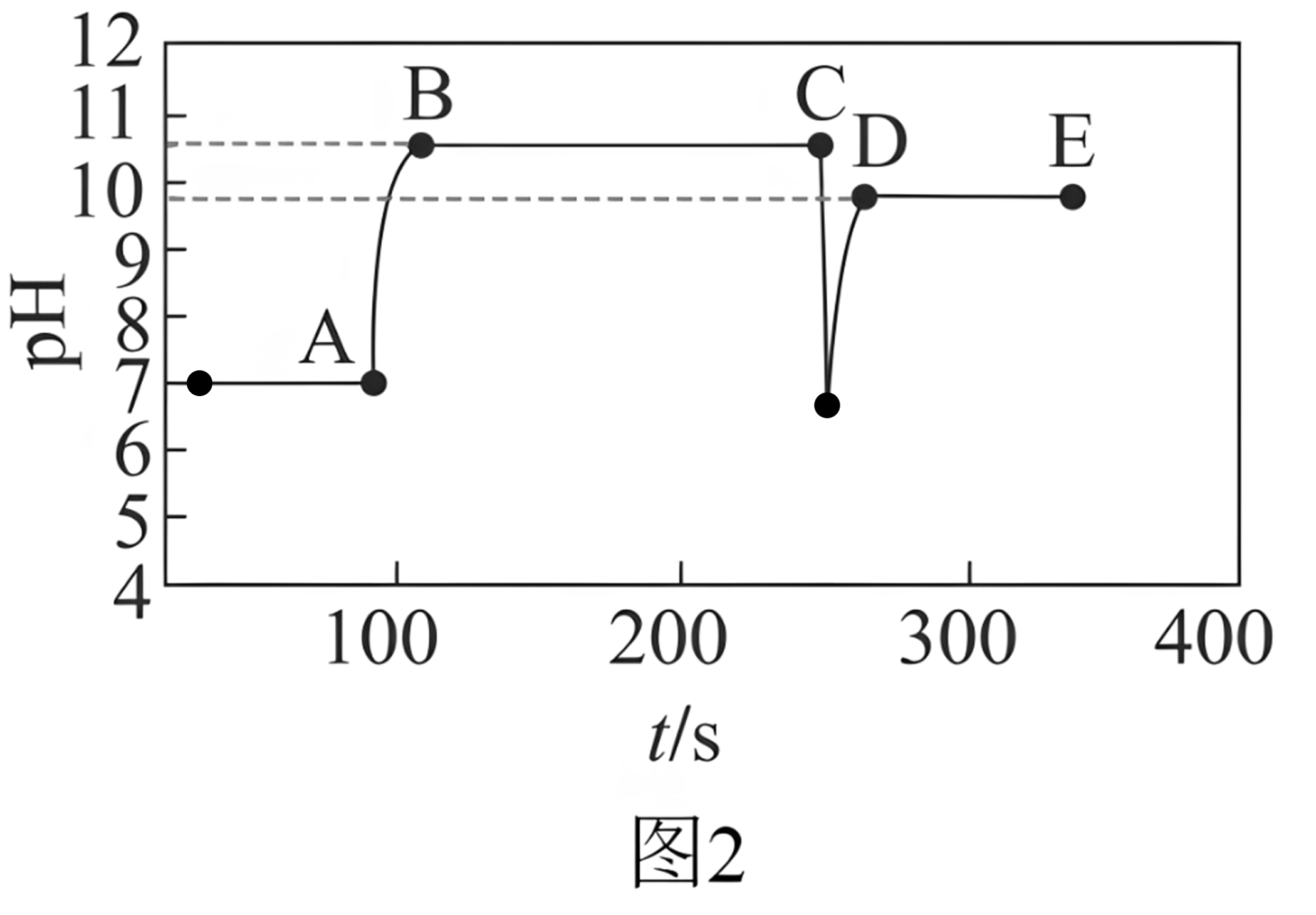
已知:①25℃时,;
②酚酞变色范围如下表:
颜色
无色
淡粉色
红色
(4)实验②过程中,溶液颜色变化:先变红,。
(5)图2中段低于段的原因是。
(6)常被用于改良水质,可调节水体 , 进而抑制细菌的生长。25℃且水体时,水体中为。
-
17、工业上以软锰矿(主要成分为 , 还含有少量的、、等)为原料制取金属锰的工艺流程如图所示。

已知:ⅰ.经检验浸取液中不存在。
ⅱ.部分金属离子形成氢氧化物沉淀时的如下表:
金属离子
开始沉淀的
6.8
1.8
3.7
8.6
沉淀完全的
8.3
2.8
4.7
10.1
ⅲ.25℃时,的电离常数、 , , 。
(1)、软锰矿“粉磨”的目的是。(2)、写出“浸出”过程中参与反应的离子方程式:。(3)、“浸渣”的主要成分是(填化学式)。(4)、“除杂”反应中的最佳选择是(填标号)。a. b. c.
(5)、“除杂”时,调节溶液的范围为。(6)、写出“沉锰”操作中发生反应的离子方程式:。(7)、在废水处理中常用将转化为除去,向含有的废水中通入一定量的气体,调节溶液的 , 当时,开始沉淀,则。往悬浊液中滴加过量饱和溶液,写出反应的离子方程式:。 -
18、和的高效利用不仅能缓解大气变暖,对日益枯竭的石油资源也有一定的补充作用。临氧耦合重整的反应有:
反应Ⅰ:
反应Ⅱ:
(1)、写出表示燃烧热的热化学方程式:。(2)、在两个体积均为的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下进行反应Ⅱ:(不发生其他反应),的平衡转化率如表所示。容器
起始物质的量/
的平衡转化率
X
0.1
0.1
0
0
Y
0.1
0.1
0.2
0.2
-
①下列条件能说明反应达到平衡状态的是(填标号)。
A.
B.容器内各物质的浓度满足
C.容器内混合气体的总压强不再变化
D.容器内混合气体的密度保持不变
②达到平衡时,容器X、Y内的物质的量关系满足(填“>”“<”或“=”)。
(3)、还可以通过催化加氢合成乙醇: 。设[]为起始时的投料比。通过实验得到下列图像: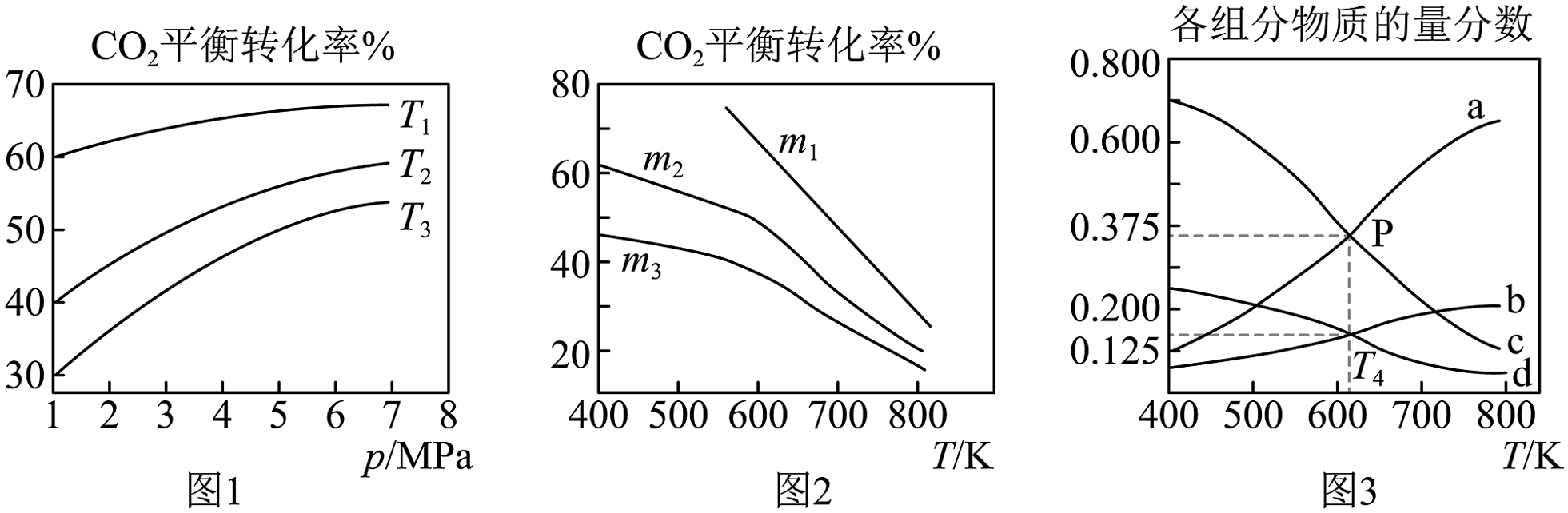
①若图1中相等,则温度从高到低的排序为 , 原因是。
②图2中、、从大到小的排序为。
③图3表示在总压为的恒压条件下,时,平衡状态下各组分的物质的量分数与温度的关系,则曲线表示的是(填化学式)的物质的量分数。下,该反应压强平衡常数的计算式为(用平衡分压代替平衡浓度计算,分压总压物质的量分数,代入数据,不用化简)。
-
19、
某学习小组用溶液和溶液的反应探究外界条件对化学反应速率的影响。
Ⅰ.硫酸浓度的测定:移取待测液,加入2滴酚酞溶液,用标准溶液滴定至终点。
(1)上述滴定操作用到的仪器有(填标号)。

(2)上述操作的实验数据如表:
实验编号
待测液体积
标准溶液体积
滴定前读数
滴定后读数
1
20.00
0.00
20.02
2
20.00
0.04
20.04
3
20.00
0.10
20.08
4
20.00
0.00
20.98
①判断滴定终点的依据是。
②该硫酸的浓度为。
③请在答题卡虚线框中绘出上述实验中溶液随溶液)变化的滴定曲线图,注意标注滴定起点和滴定终点。
④以下操作会导致测得的待测液浓度偏低的是(填标号)。
A.未用标准溶液润洗滴定管
B.滴定前锥形瓶中有水
C.量取硫酸时,酸式滴定管内开始有气泡,放液后气泡消失
D.用标准溶液滴定前仰视读数,达到滴定终点时俯视读数
Ⅱ.探究外界条件对化学反应速率的影响。
【反应原理】将一定体积溶液与过量的稀硫酸(浓度为上述标定浓度)反应,相关反应的化学方程式为。
【实验方案】
实验序号
实验温度
溶液
溶液
硫全部沉淀所需时间
①
293
2.0
0.10
8.0
10.0
②
293
2.0
0.10
10.0
③
313
2.0
0.10
(注:忽略溶液混合时体积的变化)
(3)实验①②是探究浓度对化学反应速率的影响,实验②③是探究温度对化学反应速率的影响。则。
(4)下列说法正确的是(填标号)。
A.增大反应物浓度,活化分子百分数也增大
B.升高温度,活化分子数增多,活化分子百分数不变
C.根据所学知识,预测三组实验硫全部沉淀所需时间:
(5)在内实验②中用表示的速率为(用含的代数式表示)。
-
20、甲[]、乙[]是定量分析中的常用试剂。已知为阿伏加德罗常数的值,常温下,、、。下列说法正确的是A、等浓度的甲溶液和乙溶液的:甲<乙 B、浓度相等的甲溶液和乙溶液:(甲)(乙) C、等体积等浓度的甲溶液和乙溶液所含的阴离子总数:甲>乙 D、浓度均为的甲溶液和乙溶液含有的数目均为