相关试卷
- 江苏省苏州市园区苏州大学附属中学2025-2026学年高一上学期10月月考化学试题
- 甘肃省多校2025-2026学年 高三上学期第一次联考考试 化学试卷
- 广东省金太阳2025-2026学年高三上学期8月开学联考化学试卷
- 广东省四校普通高中教学质量检测2025-2026学年高三上学期10月月考化学试题
- 江苏省部分高中2024-2025学年高一上学期期末迎考化学试题
- 江苏省盐城市七校联考2025-2026学年高三上学期期初考试化学试卷
- 广东省广州奥林匹克中学2025-2026学年高三上学期9月月考 化学试题
- 江苏省常州市金坛区第一中学2025-2026学年高三上学期开学化学试题
- 广东省清远市阳山县南阳中学2025-2026学年高一上学期第一次月考 化学试题
- 广州市2025-2026学年高三上学期 八月阶段训练化学试题
-
1、下列实验装置可以达到实验目的是
A.测定氯水的pH
B.可用于制备并检验氢气的可燃性


C.验证Na和水反应是否为放热反应
D.验证氯气是有具有漂白性

 A、A B、B C、C D、D
A、A B、B C、C D、D -
2、下列各组离子在指定溶液中能大量共存的是A、澄清透明溶液中:、、、 B、的溶液中:、、、 C、能使酚酞变红的溶液中:、、、 D、无色透明溶液中:、、、
-
3、部分含氯物质的分类与相应化合价关系如图所示。下列说法正确的是
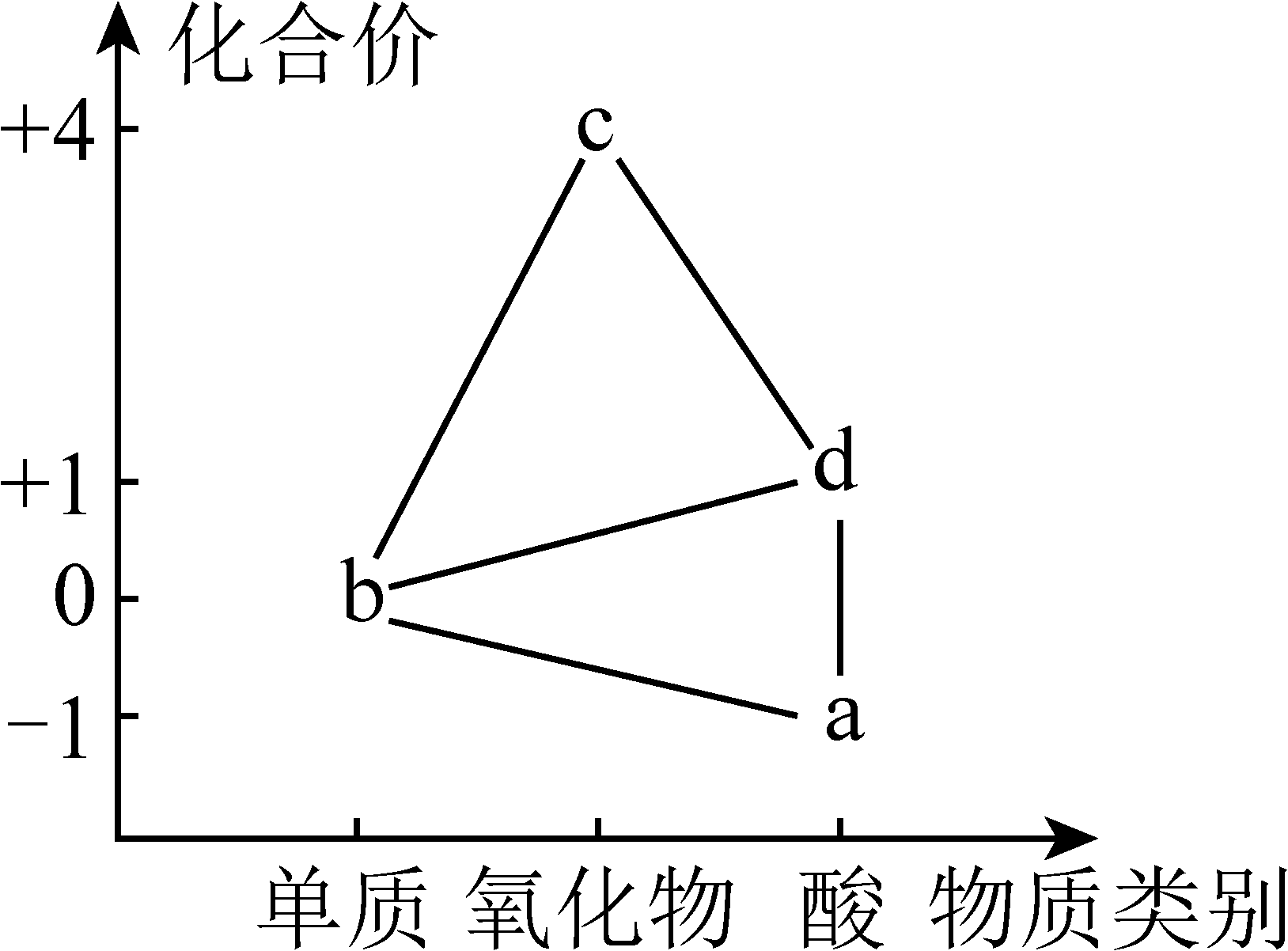 A、纯净的在b中安静燃烧,产生白烟 B、c可用作自来水消毒剂,具有强还原性 C、存在a→b→d→a的转化关系 D、d性质稳定,常用作漂白剂
A、纯净的在b中安静燃烧,产生白烟 B、c可用作自来水消毒剂,具有强还原性 C、存在a→b→d→a的转化关系 D、d性质稳定,常用作漂白剂 -
4、下列化学反应的离子方程式书写正确的是A、与水反应: B、溶于水: C、石灰乳与盐酸反应: D、向液中加足量溶液:
-
5、设表示阿伏加德罗常数,下列说法正确的是A、常温常压下,与CO的混合气体中含有的质子数为 B、铁粉与反应,转移的电子数为 C、标准状况下,所含的分子数为 D、的溶液中含有钠离子数目为
-
6、我国科学家通过乙醛溶液与氢氧化钠混合后室温静置反应制备了尺寸为3~5nm的碳量子点(内核由碳单质组成,内核表面含有由碳、氢、氧等元素形成的原子团)。碳量子点是具有荧光性质的新型纳米碳材料,具有独特的性质。下列关于碳量子点的说法正确的是A、碳量子点是纯净物 B、碳量子点不可以燃烧 C、碳量子点分散在水中可产生丁达尔效应 D、可以利用过滤的方法分离碳量子点和氯化钠溶液组成的体系
-
7、下列物质的除杂质方法中,试剂的选择和实验操作均正确的是
选项
物质(杂质)
试剂和实验操作
A
CO(CO2)
气体通过装有Na2O2的干燥管
B
CO2(HCl)
气体通过饱和Na2CO3溶液
C
NaHCO3溶液(Na2CO3)
向溶液通入过量CO2
D
NaCl溶液(CaCl2)
向溶液通入过量CO2后过滤
A、A B、B C、C D、D -
8、下列转化不能通过一步反应实现的是A、 B、 C、 D、
-
9、实验要有安全意识,下列实验操作符合安全规范的是A、加热液体时,将试管口对准其他人 B、稀释浓硫酸时,应向浓硫酸中缓慢加入水,并不断搅拌 C、Na的性质探究实验结束后,将剩余的钠投入废液缸中 D、闻气味时,用手轻轻地在瓶口扇动,使极少量的气体进入鼻孔
-
10、一种以碱性蚀刻废液(主要成分为为原料回收CuO的装置如下。取一定量蚀刻废液和稍过量的NaOH溶液加入装置甲的三颈瓶中,在搅拌下加热反应并通入空气,有产生,反应结束后将装置甲内混合物过滤、洗涤,得到CuO。
 (1)、过滤装置甲内混合物后,所得滤液中的溶质除NaOH外,还有。(2)、写出装置乙溶液中所发生反应的离子方程式:。(3)、将所得CuO溶于稀硫酸中,向其中加入KⅠ溶液,发生反应:。为测定生成的物质的量,可进行如下实验:向溶液中滴加溶液,发生反应:恰好完全反应时消耗的溶液20.00mL。
(1)、过滤装置甲内混合物后,所得滤液中的溶质除NaOH外,还有。(2)、写出装置乙溶液中所发生反应的离子方程式:。(3)、将所得CuO溶于稀硫酸中,向其中加入KⅠ溶液,发生反应:。为测定生成的物质的量,可进行如下实验:向溶液中滴加溶液,发生反应:恰好完全反应时消耗的溶液20.00mL。①配制溶液,所需固体的质量为。
②计算反应生成的物质的量,并写出计算过程。
③原CuO的质量为。
-
11、含锰化合物在电池和催化剂等领域应用广泛。(1)、将碳酸锰在一定温度与氧气反应,可以制取。每生成 , 反应中转移电子的数目是。(2)、控制恒温,向溶液鼓入空气可制得沉淀和硫酸。
①写出该反应的化学方程式并用单线桥表示反应中电子转移的方向和数目:。
②由反应可知该条件下粒子的氧化性大小:>。
(3)、是实验室常用的强氧化剂,氧化性大于在酸性(或通入酸性气体)条件下可转化为和。实验室制取的一种方法是向的溶液中通入气体,反应后有和生成。①反应中生成的和的物质的量之比为。
②实验中可通入气体制 , 但不能改为加入盐酸制。不能加入盐酸制的原因是。
-
12、二氧化氯常作为饮用水消毒杀菌剂和纸浆、面粉等的漂白剂。
 (1)、具有较强消毒杀菌能力的原因是:。(2)、某实验小组设计用如下实验装置制取、收集和
(1)、具有较强消毒杀菌能力的原因是:。(2)、某实验小组设计用如下实验装置制取、收集和已知:Ⅰ.的熔点沸点;
Ⅱ.装置A中加入浓盐酸反应后有和KCl生成;
Ⅲ.装置B中浓硫酸的作用是干燥气体。
①写出装置A中发生反应时的化学方程式:。
②常温常压下,和的密度之比为。
③装置C中使用冰水浴的目的是:。
(3)、作氧化剂时,所得反应产物与作氧化剂时反应产物相同。从得失电子角度比较等物质的量情况下,选择哪种氧化剂好并说明理由:。(4)、从括号中选择合适的试剂,设计证明具有氧化性的实验方案:。(气体、淀粉KI溶液、溶液) -
13、久置的硫酸亚铁溶液中会产生沉淀物,沉淀物中含难溶的碱式硫酸铁和析出的硫酸亚铁晶体。以该沉淀物制取硫酸亚铁晶体(的流程如下:
 (1)、某同学用密度为、质量分数为98%的浓硫酸配制的稀硫酸。需98%的浓硫酸的体积为。(2)、写出“酸溶”时反应的离子方程式:。(3)、选用最合适的金属X,写出“还原”反应的离子方程式:。(4)、检验“还原”反应后,溶液中是否存在的试剂是。(5)、为验证碱式硫酸铁中含有 , 可进行如下实验,补充完整实验方案:取少量含难溶碱式硫酸铁和硫酸亚铁晶体的沉淀物, , 则含有。
(1)、某同学用密度为、质量分数为98%的浓硫酸配制的稀硫酸。需98%的浓硫酸的体积为。(2)、写出“酸溶”时反应的离子方程式:。(3)、选用最合适的金属X,写出“还原”反应的离子方程式:。(4)、检验“还原”反应后,溶液中是否存在的试剂是。(5)、为验证碱式硫酸铁中含有 , 可进行如下实验,补充完整实验方案:取少量含难溶碱式硫酸铁和硫酸亚铁晶体的沉淀物, , 则含有。 -
14、根据信息书写反应方程式:(1)、请从下列试剂中选择合适的完成指定转化。
试剂:溶液、NaCl溶液、NaOH溶液、溶液
①的离子方程式:。
②的离子方程式:。
(2)、铝钴(Co)镍(Ni)合金可用于制造永磁材料。将铝钴(Co)镍(Ni)合金在NaOH溶液中浸取可以除去其中的单质铝,写出该反应的化学方程式:。(3)、从钴渣(主要成分为 , 还含有少量)中回收金属的部分流程如下:
①写出“浸取”时所发生反应的离子方程式:。
②写出“浸取”时所发生反应的离子方程式:。
-
15、酸性条件下,向含的溶液中加入溶液,可发生如下图所示转化。下列说法正确的是
 A、图中化合价发生变化的元素有2种 B、转化Ⅰ、Ⅱ中均作为氧化剂 C、由转化Ⅰ可知氧化性: D、图中所示转化的总反应为
A、图中化合价发生变化的元素有2种 B、转化Ⅰ、Ⅱ中均作为氧化剂 C、由转化Ⅰ可知氧化性: D、图中所示转化的总反应为 -
16、四氧化三铁磁性材料有广泛的应用。共沉淀法是制备纳米四氧化三铁的重要方法,其一种制取流程如下图所示:

下列说法正确的是
A、溶液在空气中久置会氧化变质 B、理论上,流程中需要的和的物质的量之比为1:2 C、滤液中一定含有和 D、四氧化三铁纳米粒子分散到水中能产生丁达尔效应 -
17、某同学对某种消毒液X进行如下实验,依据实验现象所得结论正确的是
选项
实验操作及现象
实验结论
A
向X中滴加酚酞,溶液先变红,后褪色
X呈碱性
B
向X中滴加溶液,有白色沉淀生成
X中含有
C
向X中加入浓盐酸,有黄绿色气体生成
X具有强氧化性,酸性条件下可将氧化成
D
用铂丝蘸取X在火焰上灼烧,火焰为黄色
X中不含
A、A B、B C、C D、D -
18、下列实验方法能达到实验目的的是A、用加热的方法除去固体中混有的 B、用NaOH溶液除去氧化铁中混有的氧化铝 C、用溶液除去中的HCl D、用饱和食盐水吸收尾气中的
-
19、阅读下列信息,完成下列小题:
现实验室准备用NaOH固体配制100mL、的NaOH溶液。
(1)、下图所示的仪器中,不是实验中必须使用的是A、 B、
B、 C、
C、 D、
D、 (2)、下列情况或操作会使所配溶液浓度偏高的是A、NaOH已部分变质 B、容量瓶使用前未完全干燥 C、转移溶解后的NaOH溶液及定容时,未等溶液冷却 D、转移溶解后的NaOH溶液时,部分溶液洒落
(2)、下列情况或操作会使所配溶液浓度偏高的是A、NaOH已部分变质 B、容量瓶使用前未完全干燥 C、转移溶解后的NaOH溶液及定容时,未等溶液冷却 D、转移溶解后的NaOH溶液时,部分溶液洒落 -
20、下列反应所对应的离子方程式正确的是A、氯气通入水中: B、氯化铁溶液腐蚀铜线路板: C、稀硫酸中滴加溶液: D、NaOH溶液中通入过量