相关试卷
- 江苏省苏州市园区苏州大学附属中学2025-2026学年高一上学期10月月考化学试题
- 甘肃省多校2025-2026学年 高三上学期第一次联考考试 化学试卷
- 广东省金太阳2025-2026学年高三上学期8月开学联考化学试卷
- 广东省四校普通高中教学质量检测2025-2026学年高三上学期10月月考化学试题
- 江苏省部分高中2024-2025学年高一上学期期末迎考化学试题
- 江苏省盐城市七校联考2025-2026学年高三上学期期初考试化学试卷
- 广东省广州奥林匹克中学2025-2026学年高三上学期9月月考 化学试题
- 江苏省常州市金坛区第一中学2025-2026学年高三上学期开学化学试题
- 广东省清远市阳山县南阳中学2025-2026学年高一上学期第一次月考 化学试题
- 广州市2025-2026学年高三上学期 八月阶段训练化学试题
-
1、中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末。该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些理解,其中错误的是A、这种金刚石粉末属于胶体 B、制造过程中元素种类没有改变 C、CCl4是一种化合物 D、这个反应是置换反应
-
2、向一定量的Ba(OH)2溶液中逐滴加入稀硫酸,直至过量,如图中的曲线可近似表示整个过程中混合溶液的导电能力变化的是(用电流强度I表示)
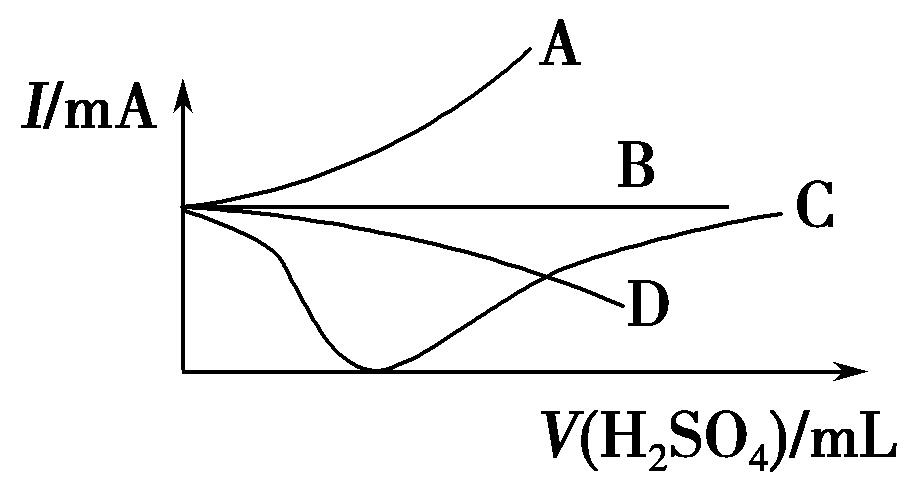 A、曲线A B、曲线B C、曲线C D、曲线D
A、曲线A B、曲线B C、曲线C D、曲线D -
3、实验室制备氧气的化学方程式:KMnO4K2MnO4+MnO2+O2↑,对于该反应有关说法错误的是A、KMnO4只作氧化剂 B、部分氧元素被氧化 C、锰元素被还原 D、该反应既属于分解反应,也属于氧化还原反应
-
4、下面关于药品保存和实验安全方面的说法正确的是A、金属钠着火燃烧时,用泡沫灭火器灭火 B、有大量的氯气泄漏时,用肥皂水浸湿软布捂住口鼻,并迅速离开现场 C、实验室制备盐酸,可以采用将氢气与氯气混合后点燃的方法 D、金属钠的保存应避光,存放于敞口容器中
-
5、下列叙述正确的是A、过氧化钠可在呼吸面具中作为氧气的来源 B、用铂丝蘸取少量某溶液进行焰色试验,火焰呈黄色,该溶液一定是钠盐溶液 C、将红热的铜丝伸入氯气的集气瓶中,剧烈燃烧,产生大量蓝色的烟 D、氯化钠溶液在电流作用下电离出钠离子和氯离子
-
6、下列碱性透明溶液中,能大量共存的离子组是A、、、、 B、、、、 C、、、、 D、、、、
-
7、下列化学用语表示正确的是A、的摩尔质量是2g B、和互为同素异形体 C、苏打的化学式: D、中Fe元素的化合价:
-
8、垃圾分类可以有效地回收资源,把垃圾从“敌人”变成“朋友”。同样通过研究物质分类,可以发现物质的变化规律,下列有关物质的分类正确的是A、酸性氧化物:、、 B、碱:NaOH、纯碱、熟石灰 C、电解质:HCl、、 D、化合物:氢氧化铁、稀盐酸、干冰
-
9、下列仪器中可以直接用酒精灯加热的是A、
 B、
B、 C、
C、 D、
D、
-
10、
回答下列问题:
I.下图是实验室某浓盐酸试剂瓶标签上的有关数据。
盐酸
分子式:
相对分子质量:36.5
密度:
的质量分数:
(1)该浓盐酸中的物质的量浓度为________。(2)某学生欲用上述浓盐酸和蒸馏水配制物质的量浓度为的稀盐酸。该学生需要量取________上述浓盐酸进行配制。(3)在实验中其他操作均正确,若用量筒量取浓盐酸时仰视刻度线,则所配得溶液的浓度________(填“大于”“等于”或“小于”)。Ⅱ.要配制的溶液,配制过程中有如下操作步骤:
①把称量好的胆矾()放入小烧杯中,加适量蒸馏水溶解;
②把①所得溶液小心转入___________中;
③继续向容量瓶中加蒸馏水至液面距离刻度处,改用胶头滴管滴加蒸馏水至液面与刻度线相切;
④用少量蒸馏水洗涤烧杯玻璃棒次,每次洗涤的液体都小心转入容量瓶,并轻轻摇动容量瓶,使溶液混合均匀;
⑤将容量瓶塞紧,反复上下颠倒,摇匀;
⑥待溶液恢复到室温。
(4)请填写上述实验步骤的空白处:②把①所得溶液小心转入________中。(5)实验操作步骤的正确顺序为(填序号)________。(6)实验室用胆矾()来配制该溶液,用托盘天平称量胆矾________g。(7)由于错误操作,使得实际浓度比所要求的偏小的是___________(填写编号)。A. 称量胆矾时,左码右物 B. 使用容量瓶配制溶液时,俯视液面定容 C. 没有用蒸馏水洗烧杯次,并将洗液移入容量瓶中 D. 把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用 -
11、“分类研究”是重要的学习与科研方法。现有下列9种物质:①气体;②固体;③;④蔗糖;⑤固体;⑥熔融;⑦氢氧化铁胶体;⑧硫酸溶液;⑨铜。回答下列问题:(1)、上述物质中属于电解质的有 , 能导电的纯净物有(填序号)。(2)、写出⑥的电离方程式为。(3)、上述9种物质中有两种物质在水溶液中发生反应的离子方程式为 , 则该反应的化学方程式为。(4)、溶液与足量的溶液反应的离子方程式为。(5)、配平下列化学方程式,在横线上填写化学计量数。
-
12、下列实验方案设计、现象、结论都正确的是
实验方案
现象
结论
A
向溶液中滴加过量氯水,再加入淀粉溶液
先变橙色,后变蓝色
氧化性:
B
用玻璃棒蘸取次氯酸钠溶液点在试纸上
试纸变白
次氯酸钠溶液呈中性
C
将食品脱氧剂样品中的还原铁粉溶于盐酸,滴加溶液
溶液呈浅绿色
食品脱氧剂样品中没有价铁
D
分别取与溶液于试管中,加入足量溶液
氯化镁溶液出现白色沉淀,氯化铝溶液先出现白色沉淀,后溶解
镁的金属性更强
A、A B、B C、C D、D -
13、某溶液仅由、、、、、、中的若干种离子组成,且各离子浓度相等。取适量溶液进行如下实验:
①用洁净的铂丝蘸取待测液在酒精灯外焰灼烧,观察到有黄色火焰;
②加过量盐酸无现象,得到无色溶液;
③取操作①后的溶液,加入过量的 , 产生白色沉淀1;
④取操作②后的滤液,加入过量的和溶液,产生白色沉淀2;
根据以上实验判断,下列推断不正确的是
A、根据操作②的无色溶液,推断原溶液一定不存在 B、白色沉淀1为混合物,白色沉淀2为纯净物 C、原溶液中一定不存在 D、由实验可知原溶液中不一定存在 -
14、将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是
 A、苛性钾溶液中KOH的质量是5.04g B、由题中信息可知,氧化性ClO-<ClO C、反应中转移电子的物质的量是0.21mol D、在酸性条件下ClO-和ClO可生成Cl2
A、苛性钾溶液中KOH的质量是5.04g B、由题中信息可知,氧化性ClO-<ClO C、反应中转移电子的物质的量是0.21mol D、在酸性条件下ClO-和ClO可生成Cl2 -
15、为阿伏加德罗常数的值。下列说法正确的是A、含有的中子数为 B、在水溶液中含有氧原子的数目为 C、在氧气中完全反应生成和 , 转移电子数目一定为 D、溶于水后,生成分子的总数为
-
16、某种物质由原子序数依次增大的五种主族元素组成。五种元素分处三个短周期,同主族,的原子序数之和与Z的原子序数相等,Y原子的最外层电子数是Z原子的一半。下列说法正确的是A、简单氢化物的稳定性: B、Y的氧化物是两性氧化物 C、元素的非金属性: D、三种元素不能形成盐
-
17、将样品溶解在过量的的硫酸溶液中,然后向其中加入溶液,使刚好沉淀完全,用去溶液 , 则溶液的浓度为A、 B、 C、 D、
-
18、下列说法正确的是A、实验未用完的钠可放回原试剂瓶 B、焰色试验时,可以用铁丝代替铂丝,使用前都要用稀硫酸清洗干净 C、使用容量瓶配制溶液时,应先检漏,且干燥后才能使用 D、粗盐净化过程中,可用除去
-
19、下列“类比”合理的是A、溶液显酸性,溶液也显酸性 B、与反应生成 , 则与反应生成 C、一定条件下,和反应生成和 , 则和反应生成和 D、与反应生成和 , 则与反应生成和
-
20、下列说法正确的是A、在元素周期表中共有18个族 B、当L层上的电子数为奇数时,M层上不可能有电子 C、同一周期中,ⅡA与ⅢA族元素原子的核电荷数都相差1 D、在多电子原子中,离核近的区域内运动的电子能量较高