相关试卷
- 江苏省苏州市园区苏州大学附属中学2025-2026学年高一上学期10月月考化学试题
- 甘肃省多校2025-2026学年 高三上学期第一次联考考试 化学试卷
- 广东省金太阳2025-2026学年高三上学期8月开学联考化学试卷
- 广东省四校普通高中教学质量检测2025-2026学年高三上学期10月月考化学试题
- 江苏省部分高中2024-2025学年高一上学期期末迎考化学试题
- 江苏省盐城市七校联考2025-2026学年高三上学期期初考试化学试卷
- 广东省广州奥林匹克中学2025-2026学年高三上学期9月月考 化学试题
- 江苏省常州市金坛区第一中学2025-2026学年高三上学期开学化学试题
- 广东省清远市阳山县南阳中学2025-2026学年高一上学期第一次月考 化学试题
- 广州市2025-2026学年高三上学期 八月阶段训练化学试题
-
1、某实验小组用如图所示装置探究木炭与浓硝酸的反应,实验记录如下:

①烧瓶中产生红棕色气体;②澄清石灰水始终不变浑浊;③酸性溶液颜色变浅。
下列叙述正确的是
A、甲中木炭一定与浓硝酸发生了反应 B、乙向丙中导入了还原性气体 C、乙中不变浑浊的原因是甲中不产生 D、浓硝酸与木炭的反应中,硝酸表现氧化性和酸性 -
2、下列过程中,对应的反应方程式错误的是
A
西汉刘安《淮南万毕术》记载湿冶铜:“曾青得铁化为铜”
B
和水反应制乙炔
C
用氨水浸泡试管中的AgCl
D
加入足量NaHS除去废水中的
A、A B、B C、C D、D -
3、胆固醇是细胞膜的重要组成结构,激素胆固醇具有调节新陈代谢过程的功能。胆固醇的结构简式如图所示。下列有关胆固醇的叙述错误的是
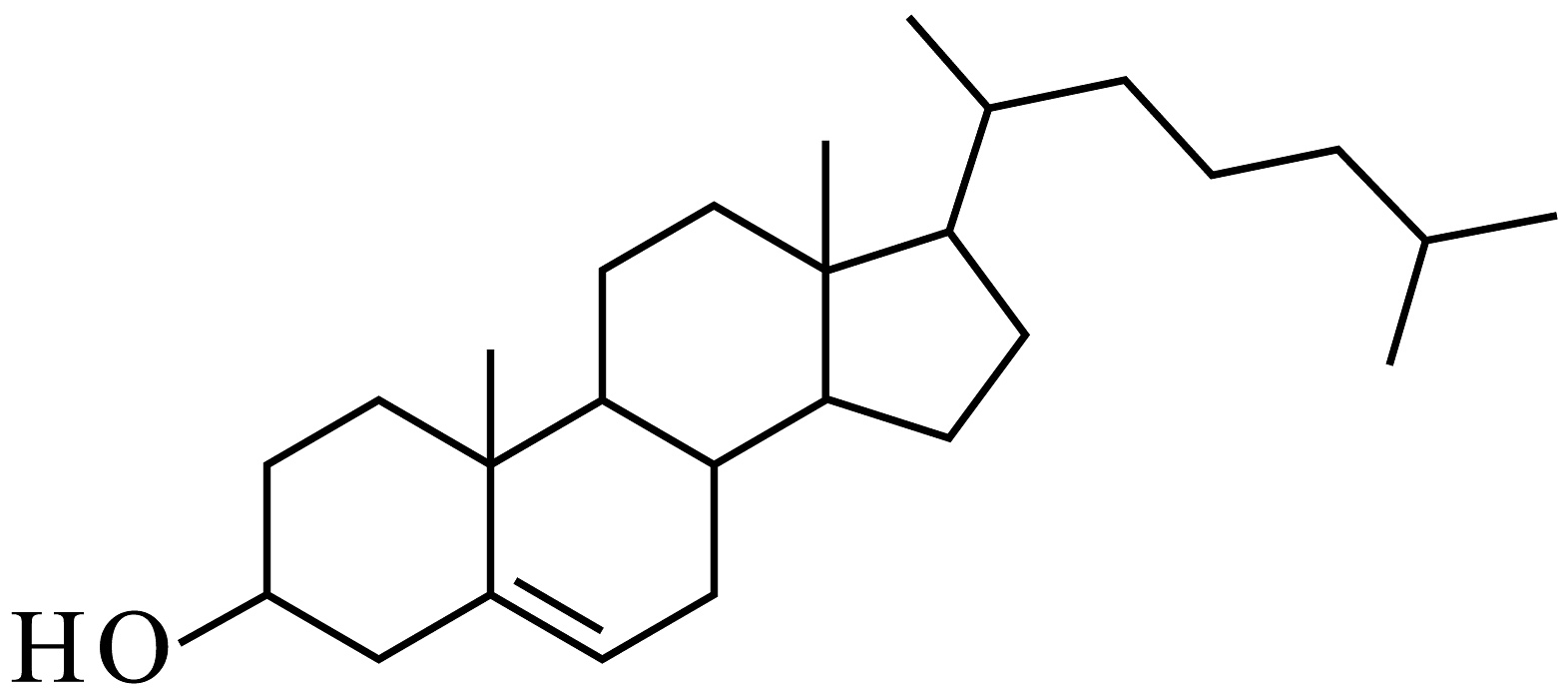 A、能发生消去反应且产物有2种 B、该分子中含8个手性碳原子 C、它的同分异构体可能有芳香酮 D、遇溶液显紫色
A、能发生消去反应且产物有2种 B、该分子中含8个手性碳原子 C、它的同分异构体可能有芳香酮 D、遇溶液显紫色 -
4、下列有关化学概念或性质的推断错误的是A、组成为的有机物一定能与水互溶 B、苯分子中碳原子间不存在单键和双键,则
 和
和 是同一种物质
C、冠醚12-冠-4能识别 , 不能识别 , 因为半径大于
D、能与过渡金属离子形成配离子,而不易形成,原因是F的电负性太大
是同一种物质
C、冠醚12-冠-4能识别 , 不能识别 , 因为半径大于
D、能与过渡金属离子形成配离子,而不易形成,原因是F的电负性太大
-
5、下列实验事故的处理方法不合理的是
选项
实验事故
处理方法
A
NaOH沾在皮肤上
先用大量水冲洗,再用1%硼酸溶液冲洗
B
硫磺粉撒在实验台上
在硫磺粉表面覆盖一层水银
C
不慎吸入煤气
立刻到室外呼吸新鲜空气或做人工呼吸
D
乙醚等有机物着火
用湿布、石棉布覆盖可燃物
A、A B、B C、C D、D -
6、下列化学用语表述错误的是A、肼的电子式为
 B、2-羟基丁醛的结构简式为
C、乙烯形成碳碳键时2p轨道重叠方式为
B、2-羟基丁醛的结构简式为
C、乙烯形成碳碳键时2p轨道重叠方式为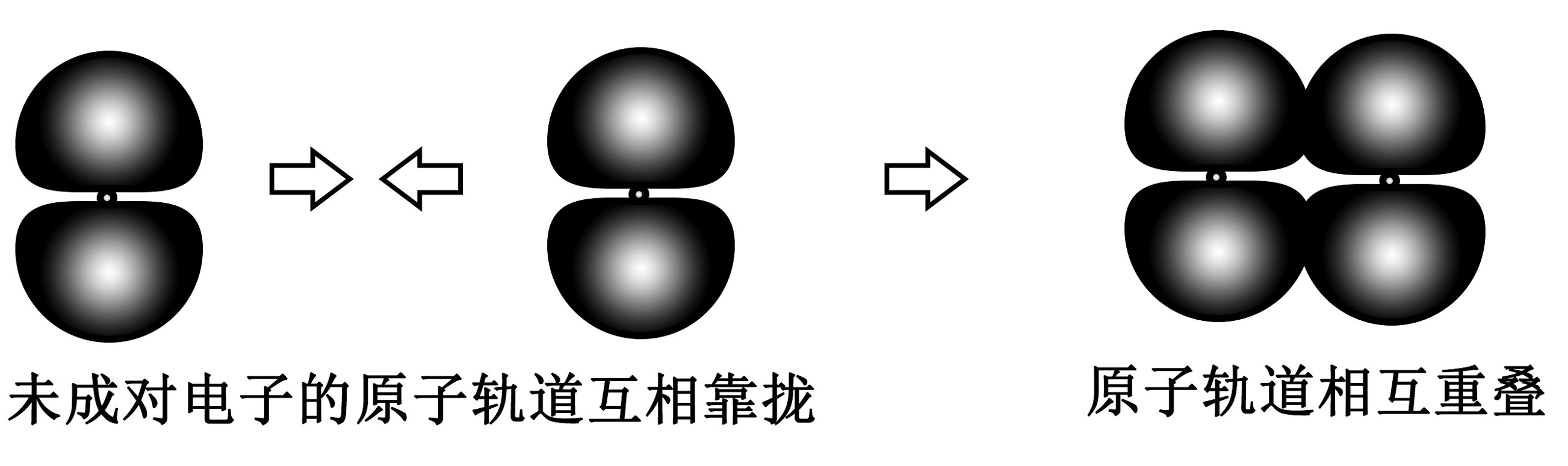 D、分子的空间填充模型为
D、分子的空间填充模型为
-
7、第33届奥运会在巴黎举行。下列有关开幕式的叙述错误的是A、火炬采用丙烷和氢气为燃料,火炬的燃烧反应是放热反应 B、呈现北京开幕式镜头之一的奥运金牌“金镶玉”,“玉”的主要成分是硅酸盐 C、开幕式现场燃放的烟花呈现出法国国旗的颜色,利用了金属元素的焰色 D、具有100多年历史的法国地标—埃菲尔铁塔,以水泥、纯铁等为建筑材料
-
8、一种治疗慢性便秘药品中间体的合成路线如下,回答下列问题。

已知:①
②克莱森重排:
 (1)、B中的官能团名称为。(2)、E的结构简式为。(3)、下列说法正确的是___________。A、C能与发生显色反应 B、最多能与发生加成反应 C、B分子中所有碳原子可能共平面 D、图示流程中没有发生克莱森重排反应(4)、F→G有一种分子式为的副产物生成,写出生成该副产物的反应方程式。(5)、设计以苯,1,3-丁二烯为原料合成
(1)、B中的官能团名称为。(2)、E的结构简式为。(3)、下列说法正确的是___________。A、C能与发生显色反应 B、最多能与发生加成反应 C、B分子中所有碳原子可能共平面 D、图示流程中没有发生克莱森重排反应(4)、F→G有一种分子式为的副产物生成,写出生成该副产物的反应方程式。(5)、设计以苯,1,3-丁二烯为原料合成 的路线(用流程图表示,无机试剂、有机溶剂任选)。 (6)、写出比E少一个C原子,两个H原子且同时满足以下条件的同分异构体的结构简式。
的路线(用流程图表示,无机试剂、有机溶剂任选)。 (6)、写出比E少一个C原子,两个H原子且同时满足以下条件的同分异构体的结构简式。①不能与发生显色反应,但能发生银镜反应
②最多能与溶液恰好完全反应
③核磁共振氢谱有4组吸收峰
④分子中没有两个甲基连在同一个碳原子上
-
9、以黄铜矿(主要成分为 , 含少量)为原料,相关转化关系如下。

已知:①反应1中不变价,且固体A为单一化合物;
②具有疏松结构。
(1)、固体A的化学式为;中心原子的杂化方式为。(2)、下列说法不正确的是___________。A、不溶于水,但溶于稀硝酸 B、在该环境生锈后,铜锈可隔绝空气,减缓生锈速度 C、气体B具有还原性所以能使品红溶液褪色 D、与混合共热可制得无水(3)、反应2的化学方程式为。(4)、①反应4生成的物质D难溶于水,且同时生成两种酸性气体,则反应4的化学方程式为。②设计实验验证物质D中的氯元素。
-
10、已知 , 速率方程为 , 其中k为速率常数,只与温度、催化剂、固体接触面积有关,与浓度无关;n为该反应中的反应级数,也是该反应总级数,可以为正数、0、负数;起始浓度消耗一半的时间叫半衰期,在某催化剂表面上分解的实验数据如表:
0
10
20
30
40
50
60
下列说法正确的是
A、该反应速率常数为 B、该反应为0级反应 C、若起始浓度为 , 半衰期为 D、工业上用该反应制备氢气 -
11、下列化学反应与方程式不相符的是A、用醋酸和淀粉溶液检测加碘盐中的碘: B、石英和焦炭在高温的氮气流中制备氮化硅: C、绿矾处理含铬废水: D、漂粉精在空气中变质:
-
12、下列关于实验操作的说法正确的是A、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 B、灼烧固体时,玻璃棒都不可用于转移灼烧后的固体 C、过滤操作时,为使过滤效果好,玻璃棒应放在单层滤纸一侧 D、称量固体时,将物品放在托盘天平左边,砝码放在托盘天平右边
-
13、物质的性质决定用途,下列说法不正确的是A、臭氧具有强氧化性,可以用作自来水的消毒剂 B、铁钴合金耐高温,可以用作喷气式飞机发动机叶片 C、二氧化硅具有导光性,可以用作生产光导纤维 D、福尔马林是良好的有机溶剂,可以用作保存动物标本
-
14、高铁酸钠是一种新型、高效的绿色水处理剂,其中一种干法制备反应为 , 下列说法正确的是A、高铁酸钠处理饮用水的原理与明矾类似 B、该反应的离子方程式为: C、高铁酸钠中铁的质量分数为 D、高铁酸钠还可用和在一定条件下制得
-
15、化合物F是一种食品保鲜剂,可按如下途径合成:

已知:
试回答:
(1)、A的一氯代物只有2种结构,请写出A的结构简式为 , A→B的反应类型是。(2)、B→C的化学方程式为。(3)、C→D所用试剂和反应条件分别是。(4)、E的结构简式是。F中官能团的名称是。(5)、连在双键碳上的羟基不稳定,会转化为羰基,则D的同分异构体中,只有一个环的芳香族化合物有种。其中苯环上只有一个取代基,核磁共振氢谱有5组峰,且峰面积之比为2:1:2:2:1的同分异构体的结构简式为。(6)、写出用乙醇为原料制备2-丁烯醛的合成路线(其他试剂任选)。。 -
16、以炼锌钴渣(主要含有Co、Zn、Fe等金属元素)为原料制备(氢氧化高钴)的流程如图:

已知:①酸浸后溶液中的阳离子有、、、、;②难溶于稀酸。
回答下列问题:
(1)、“酸浸”过程中,可加快反应速率的措施有(任写两项)。(2)、“氧化”过程中发生反应的离子方程式为 , 反应温度不宜超过55℃的原因是。(3)、①“沉钴”使用的过硫酸铵的化学式为 , 25℃时,控制 , 钴将以形式沉淀。补充并配平下面反应的离子方程式:。_________________________________=______________________+___________
②“沉钴”滤液的溶质为。
(4)、新型储氢材料的晶胞形状为立方体,边长为anm,如下图所示。
①与距离最近且等距的有个。
②已知的摩尔质量为Mg/mol,阿伏加德罗常数为 , 此晶体的密度为。()
-
17、氮化镁是一种浅黄色粉末,易水解生成氢氧化镁和氨气,常用于制备其它超硬、高导热、耐高温的氮化物。实验室用以下装置制取干燥、纯净的N2并与金属镁反应制取氮化镁。

已知:Mg + 2NH3 Mg(NH2)2+ H2
回答下列问题:
(1)装置A的分液漏斗中盛装的试剂是;B、F中盛装碱石灰的仪器名称是。
(2)连接好装置进行实验前经检查装置的气密性良好。其他实验步骤如下:
①装药品 ②点燃C处酒精灯 ③点燃E处酒精灯 ④打开A中分液漏斗
正确的先后顺序为(填序号)。
(3)与分液漏斗相连通的橡胶管的作用是。
(4)C中反应的化学方程式是。
(5)D装置的作用是。
(6)若24.0g镁放入E装置中,实验结束后称得E增加了7.0g,则氮化镁的产率是。
(7)设计简单实验证明E中得到的固体中含有氮化镁
-
18、
Ⅰ.是有机合成中常用的还原剂。
(1)中与之间的作用力类型是。的空间构型是 , 中心原子的杂化类型为。
Ⅱ.“富煤、贫油、少气”是我国能源发展面临的现状,随着能源的日益紧张,发展“煤化工”对我国能源结构的调整具有重要意义。图1是煤化工产业链之一、

“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出热值很高的煤炭合成气,其主要成分是CO和 , CO和可作为能源和化工原料,应用十分广泛。
(2)已知:
则反应 。
(3)在℃时,体积为1L的恒容容器中充入物质的量之和为3mol的和CO,发生反应:。
①下列情形能说明上述反应已达到平衡状态的是(填字母)。
a.体系压强保持不变
b.密闭容器中CO、、三种气体的物质的量相等
c.体系内的密度保持不变
d.每消耗1molCO的同时生成2mol
②当起始时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率 , 此温度下的化学平衡常数为。
(4)已知 , 在密闭容器中有浓度均为的与 , 在一定条件下反应。测得的平衡转化率与温度及压强的关系如图2所示,则压强(填“>“<”或“=”,下同);当压强为时,在y点;。

-
19、下列热化学方程式正确的是A、甲烷的标准燃烧热为 890.3 kJ·mol-1 , 则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890. 3 kJ·mol-1 B、500 ℃、30 MPa 下,将 0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成 NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)⇌2NH3(g) ΔH=-38.6 kJ·mol-1 C、已知在 120 ℃、101 kPa 下,1g H2 燃烧生成水蒸气放出 121 kJ 热量,其热化学方程式为:H2(g)+O2(g)H2O(g) ΔH=-242 kJ/mol D、25 ℃,101 kPa 时,强酸与强碱的稀溶液发生中和反应的中和热为 57.3 kJ/mol,硫酸溶液与氢氧化钡溶液反应的热化学方程式为:H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l) ΔH=- 114.6 kJ/mol
-
20、野黄芩素具有消炎止痛、活血化瘀和祛风除湿等功效。黄芩素则具有抗氧化、抗炎症、抗凋亡以及改善学习记忆能力等广泛的生物学活性及药理学活性。两者的结构简式如图所示。

下列关于野黄芩素和黄芩素的叙述正确的是
A、都属于芳香烃 B、都容易发生取代、加成和水解反应 C、野黄芩素与黄芩素互为同系物 D、都存在含酯基和羧基的同分异构体