相关试卷
- 江苏省苏州市园区苏州大学附属中学2025-2026学年高一上学期10月月考化学试题
- 甘肃省多校2025-2026学年 高三上学期第一次联考考试 化学试卷
- 广东省金太阳2025-2026学年高三上学期8月开学联考化学试卷
- 广东省四校普通高中教学质量检测2025-2026学年高三上学期10月月考化学试题
- 江苏省部分高中2024-2025学年高一上学期期末迎考化学试题
- 江苏省盐城市七校联考2025-2026学年高三上学期期初考试化学试卷
- 广东省广州奥林匹克中学2025-2026学年高三上学期9月月考 化学试题
- 江苏省常州市金坛区第一中学2025-2026学年高三上学期开学化学试题
- 广东省清远市阳山县南阳中学2025-2026学年高一上学期第一次月考 化学试题
- 广州市2025-2026学年高三上学期 八月阶段训练化学试题
-
1、填空。(1)、基态碳原子核外电子的空间运动状态有种,基态硒原子核外价电子排布式为。(2)、吡啶(
 )分子中也含有与苯类似的大键,则吡啶中N原子的孤电子对占据的轨道为轨道,吡啶在水中的溶解度苯(填“大于”或“小于”)。 (3)、已知CH3NH2的碱性比NH2OH强,原因是。(4)、NH4HF2中存在的化学键类型是_______(填选项字母)。A、配位键 B、氢键 C、离子键 D、共价键(5)、如图表示的SiO2的晶胞结构,试回答下列问题。
)分子中也含有与苯类似的大键,则吡啶中N原子的孤电子对占据的轨道为轨道,吡啶在水中的溶解度苯(填“大于”或“小于”)。 (3)、已知CH3NH2的碱性比NH2OH强,原因是。(4)、NH4HF2中存在的化学键类型是_______(填选项字母)。A、配位键 B、氢键 C、离子键 D、共价键(5)、如图表示的SiO2的晶胞结构,试回答下列问题。
①1个SiO2晶胞中含有个Si-O键。
②若SiO2正立方体形状晶体的密度为ρ g/cm3 , SiO2晶体中最近的两个硅原子之间的距离表达式为cm。(NA表示阿伏加德罗常数)
-
2、普鲁卡因是一种常见药物,其结构如图所示,有关该化合物的说法不正确的是
 A、分子中最多有11个碳原子共平面 B、具有还原性,能使酸性高锰酸钾溶液褪色 C、能与盐酸反应,最多消耗2mol盐酸 D、一定条件下,能发生水解,其中一种水解产物既可与盐酸反应又可与NaOH溶液反应
A、分子中最多有11个碳原子共平面 B、具有还原性,能使酸性高锰酸钾溶液褪色 C、能与盐酸反应,最多消耗2mol盐酸 D、一定条件下,能发生水解,其中一种水解产物既可与盐酸反应又可与NaOH溶液反应 -
3、对于反应 , 在温度一定时,平衡体系中的体积分数随压强的变化情况如图所示。下列说法中,正确的是
 A、A、D两点对应状态的正反应速率大小关系:v(A)>v(D) B、A、B、C、D、E各点对应状态中,v(正)<v(逆)的是E C、维持不变,E→A所需时间为 , 维持不变,D→C所需时间为 , 则 D、欲使C状态沿平衡曲线到达A状态,从理论上,可由无限缓慢降压至达成
A、A、D两点对应状态的正反应速率大小关系:v(A)>v(D) B、A、B、C、D、E各点对应状态中,v(正)<v(逆)的是E C、维持不变,E→A所需时间为 , 维持不变,D→C所需时间为 , 则 D、欲使C状态沿平衡曲线到达A状态,从理论上,可由无限缓慢降压至达成 -
4、三氟化溴有强氧化性和强反应活性,是一种良好的非水溶剂,遇水立即发生如下反应:3BrF3+5H2O=HBrO3+Br2+9HF+O2↑,下列有关该反应的说法不正确的是A、当0.5molH2O被氧化时,生成0.1mol氧气 B、氧化剂与还原剂的物质的量之比为2∶3 C、当转移电子6mol时,生成的还原产物为1mol D、当生成2.7molHF时,被BrF3还原的BrF3为0.2mol
-
5、下列关于
 的说法,不正确的是 A、该物质至少10个碳原子共平面 B、该物质既能与NaOH反应也能与HCl反应 C、该物质能与溶液作用显紫色 D、该物质能与1,3—丁二烯制得三个六元环的产物
的说法,不正确的是 A、该物质至少10个碳原子共平面 B、该物质既能与NaOH反应也能与HCl反应 C、该物质能与溶液作用显紫色 D、该物质能与1,3—丁二烯制得三个六元环的产物 -
6、下列说法正确的是A、硫在纯氧中燃烧可生成三氧化硫 B、亚硝酸钠是一种食品添加剂,用作食品防腐剂和肉类食品的发色剂 C、浓盐酸、浓硝酸、浓硫酸均可用铝罐车运输 D、将氯气通入紫色石蕊溶液中,溶液先变红后褪色,说明氯气具有酸性和漂白性
-
7、下列说法不正确的是A、氮气、二氧化碳均可用作镁燃烧的灭火剂 B、熟石灰、氨水均可用于吸收工业废气中的二氧化硫 C、氯化钠可用于生产纯碱、烧碱 D、氧化镁、氧化铝均可用于制作耐火材料
-
8、下列玻璃仪器上有标明“0”刻度的是A、
 B、
B、 C、
C、 D、
D、
-
9、下列物质不属于电解质的是A、氨基酸 B、锌单质 C、硫酸钡 D、氯化铝
-
10、下列关于物质的分类不正确的是A、尿素—有机物 B、云—气溶胶 C、纤维素—纯净物 D、硝酸—共价化合物
-
11、丙醛是一种重要的工业原料。在铑催化剂作用下,乙烯羰基合成丙醛的反应如下:
反应Ⅰ:C2H4(g)+H2(g)+CO(g)CH3CH2CHO(g) △H1
反应Ⅱ:C2H4(g)+H2(g)C2H6(g) △H2
回答下列问题:
(1)、T℃时,向恒压容器中充入1.0 mol C2H4、1.0 mol H2和1.0 mol CO,若在该条件下只发生反应Ⅰ,达平衡时,反应放出77.4 kJ的能量:若相同条件下向该容器中充入1.0 mol CH3CH2CHO,达平衡时,反应吸收51.6 kJ的能量,则反应Ⅰ的△H1= kJ/mol。(2)、在恒压条件下,按照投料n(C2H4):n(H2):n(CO)=1:1:1,匀速通入装有催化剂的反应器中发生反应Ⅰ和Ⅱ,相同时间内,测得不同温度下C2H4的转化率()如图曲线中n所示。预测化学反应速率v(B)v(D) (填“>”、“=”或“<" ),产生这一结果的原因可能是。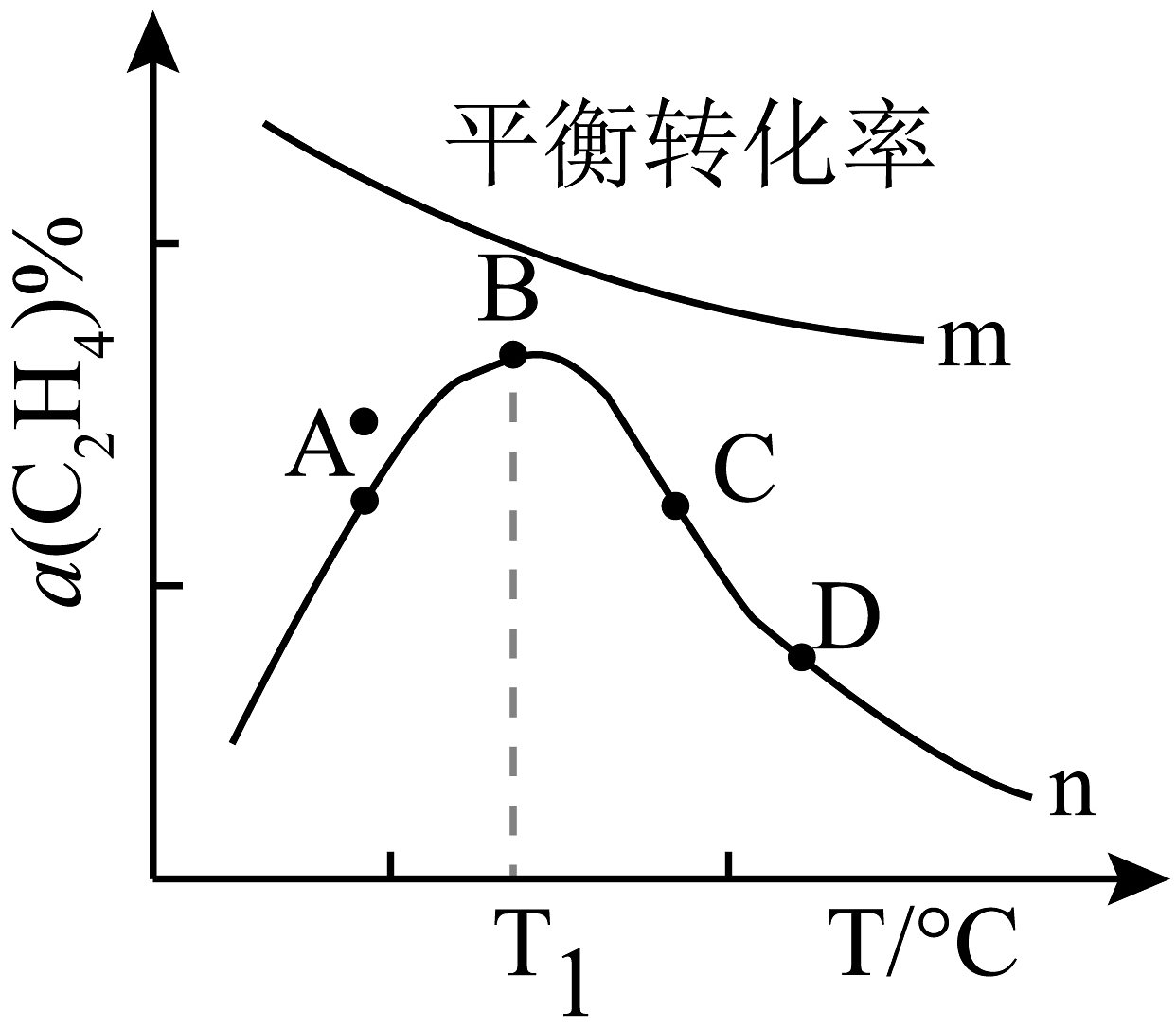 (3)、在恒压密闭容器中,通入1 mol C2H4、1 mol CO和n(H2),在一定温度和铑催化剂作用下,发生上述反应,测得C2H4的转化率()和丙醛选择性(x=)随变化关系如图所示。则曲线b表示 , 当1.08 <<1.1时,曲线a随的增大而降低的原因是。
(3)、在恒压密闭容器中,通入1 mol C2H4、1 mol CO和n(H2),在一定温度和铑催化剂作用下,发生上述反应,测得C2H4的转化率()和丙醛选择性(x=)随变化关系如图所示。则曲线b表示 , 当1.08 <<1.1时,曲线a随的增大而降低的原因是。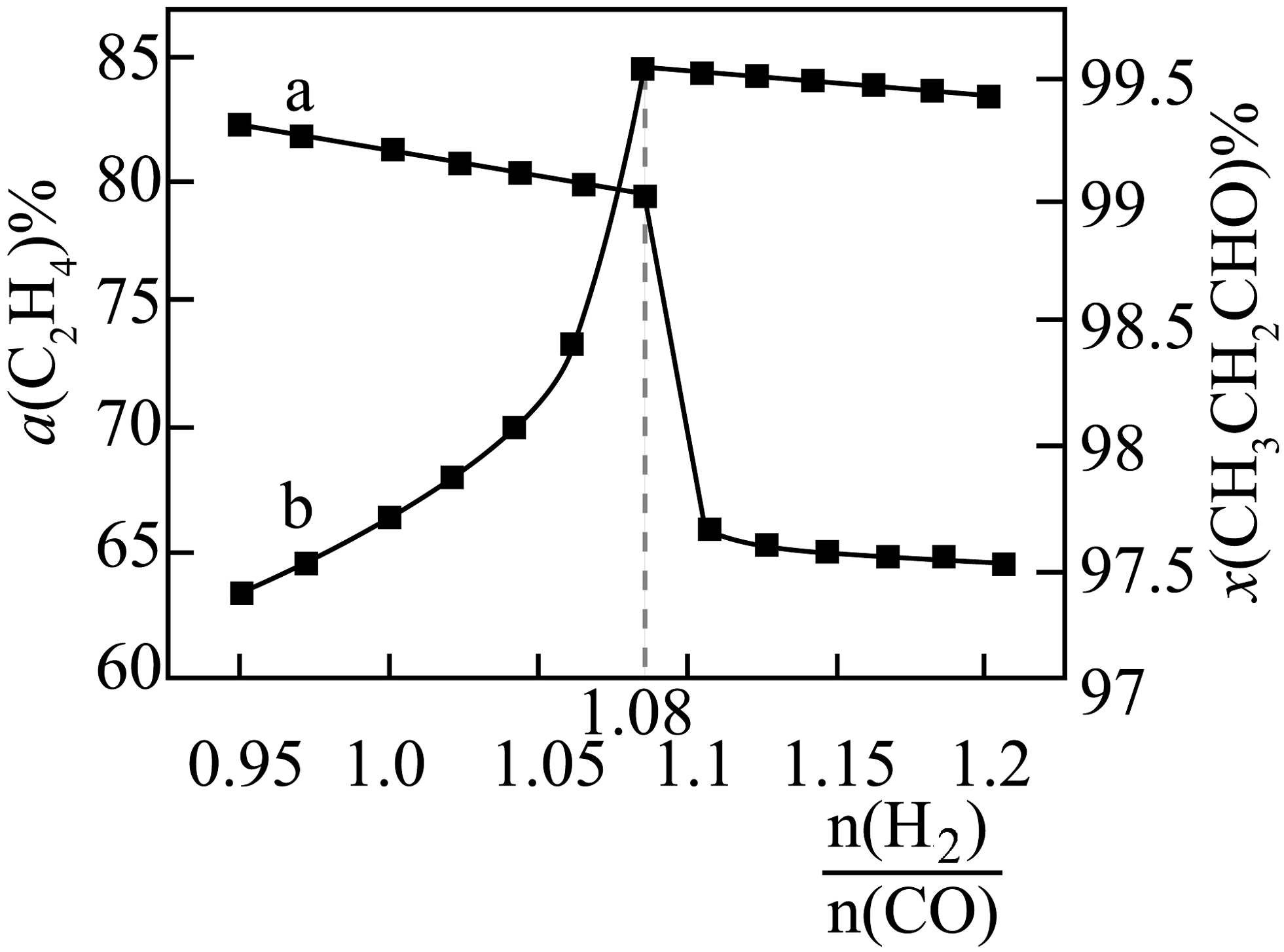 (4)、保持温度不变,在恒容反应器中,按照投料n(C2H4):n(H2):n(CO)=1:1:1,初始总压为3p kPa,发生反应Ⅰ和Ⅱ,达到平衡时C2H4的转化率为80%,C2H6的选择性为25%,则H2的转化率为 , 反应Ⅱ的Kp=kPa-1 (用含p的代数式表示)。
(4)、保持温度不变,在恒容反应器中,按照投料n(C2H4):n(H2):n(CO)=1:1:1,初始总压为3p kPa,发生反应Ⅰ和Ⅱ,达到平衡时C2H4的转化率为80%,C2H6的选择性为25%,则H2的转化率为 , 反应Ⅱ的Kp=kPa-1 (用含p的代数式表示)。 -
12、硝苯甲乙砒啶临床适用于高血压、充血性心衰竭,其合成路线如下:

已知:①

②

③
 (以上反应中、、、表示烃基)
(以上反应中、、、表示烃基)回答下列问题:
(1)、A的名称是。(2)、B中官能团的名称是 , 写出由B→D的化学反应方程式。(3)、连有4个不同的原子或基团的碳原子称为手性碳,则E中含有个手性碳。(4)、是加成反应,则C的结构简式为。(5)、B的同分异构体中,同时满足以下条件的共有种(不考虑立体异构);其中,核磁共振氢谱有四组峰的化合物的结构简式为(写出一种即可)。a.能发生水解反应; b.1mol该化合物发生银镜反应,可得4molAg
(6)、设计由B和溴乙烷为原料,制备2-戊酮( )的合成路线(其他无机试剂任选)。
)的合成路线(其他无机试剂任选)。 -
13、以钒矿石为原料制备化工产品的一种工艺流程如下:

已知:ⅰ.“焙烧”后,固体中主要含有、、、;“酸浸”后,钒以形式存在。
ⅱ.P204对四价钒具有高选择性,萃取而不萃取。
ⅲ.多钒酸铵微溶于冷水,易溶于热水。
ⅳ.该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子
开始沉淀pH
1.9
7.0
11.9
8.1
完全沉淀pH
3.2
9.0
13.9
10.1
回答下列问题:
(1)、基态Fe的价电子排布式为 , 的各元素第一电离能由大到小为。(2)、“还原中和”时,还原步骤中参与反应的离子方程式为。(3)、钒的漫出率与焙烧温度、硫酸加入量的关系如图1、图2所示。指出适宜的工艺条件为。使用冰水洗涤多钒酸铵的目的是。 (4)、流程中可循环使用的物质有。(5)、萃取后的“水相”中含有丰富的金属资源,经三道工序可回收溶液。请根据题给信息,参照上述工艺流程,选用括号中所给的合适试剂,将下列工艺流程剩余两步工序补充完整(、、稀、、)。
(4)、流程中可循环使用的物质有。(5)、萃取后的“水相”中含有丰富的金属资源,经三道工序可回收溶液。请根据题给信息,参照上述工艺流程,选用括号中所给的合适试剂,将下列工艺流程剩余两步工序补充完整(、、稀、、)。 (6)、已知常温下、的分别为、 , 若上述水相“沉钙”后 , 理论上不超过。
(6)、已知常温下、的分别为、 , 若上述水相“沉钙”后 , 理论上不超过。 -
14、常用调味剂花椒油是一种从花椒籽中提取的水蒸气挥发性香精油,溶于乙醇、乙醚等有机溶剂。利用如图所示装置处理花椒籽粉,经分离提纯得到花椒油。

实验步骤:
(一)在A装置中的圆底烧瓶中装入容积的水,加1~2粒沸石。同时,在B中的圆底烧瓶中加入20g花椒籽粉和50mL水。
(二)加热A装置中的圆底烧瓶,当有大量蒸气产生时关闭弹簧夹,进行蒸馏。
(三)向馏出液中加入食盐至饱和,再用15mL乙梄萃取2次,将两次萃取的醚层合并,加入少量无水;将液体倾倒入蒸馏烧瓶中,蒸馏得花椒油。
(1)、装置A中玻璃管的作用是。装置B中圆底烧瓶倾斜的目的是。(2)、步骤(二)中,当观察到现象时,可停止蒸馏。蒸馏结束时,下列操作的顺序为(填标号)。①停止加热②打开弹簧夹③关闭冷凝水
(3)、在馏出液中加入食盐的作用是。(4)、实验结束后,用稀NaOH溶液清洗冷凝管,反应的化学方程式为。(残留物以 表示)
表示) -
15、泰坦星是土星最大的卫星,大气中含有大量的氮气和甲烷,同时含有大量的 , 研究其与甲烷的反应对推测地球大气的演变有重要意义。反应过程能量变化如图,下列说法错误的是
 A、由中间产物I转化为有极性键的断裂和非极性键的生成 B、生成的决速步骤是由物质2到 C、中间产物1比2稳定 D、与的反应过程为放热反应
A、由中间产物I转化为有极性键的断裂和非极性键的生成 B、生成的决速步骤是由物质2到 C、中间产物1比2稳定 D、与的反应过程为放热反应 -
16、研究发现,在酸性乙醇燃料电池中加入硝酸,可使电池持续大电流放电,其工作原理如图所示。

下列说法错误的是
A、加入HNO3降低了正极反应的活化能 B、电池工作时正极区溶液的pH增大 C、1 mol CH3CH2OH被完全氧化时有6 mol O2被还原 D、负极反应为CH3CH2OH+3H2O-12e-=2CO2+12H+ -
17、下列“类比”或“推理”合理的是A、与NaOH溶液反应生成NaCl和NaClO,则与NaOH溶液反应也生成NaF和NaFO B、少量与反应生成和HClO,则少量与反应生成和HClO C、FeS与稀盐酸反应生成 , 则CuS与稀盐酸也能反应生成 D、和与足量NaOH溶液反应分别生成和 , 则和均为一元酸
-
18、下列离子方程式书写错误的是A、酸性溶液中与KI反应生成 B、向溶液中通入少量气体: C、过量通入饱和碳酸钠溶液: D、向次氯酸钠溶液中通入少量
-
19、实验是化学的最高法庭。下列所示装置或操作能达到实验目的的是
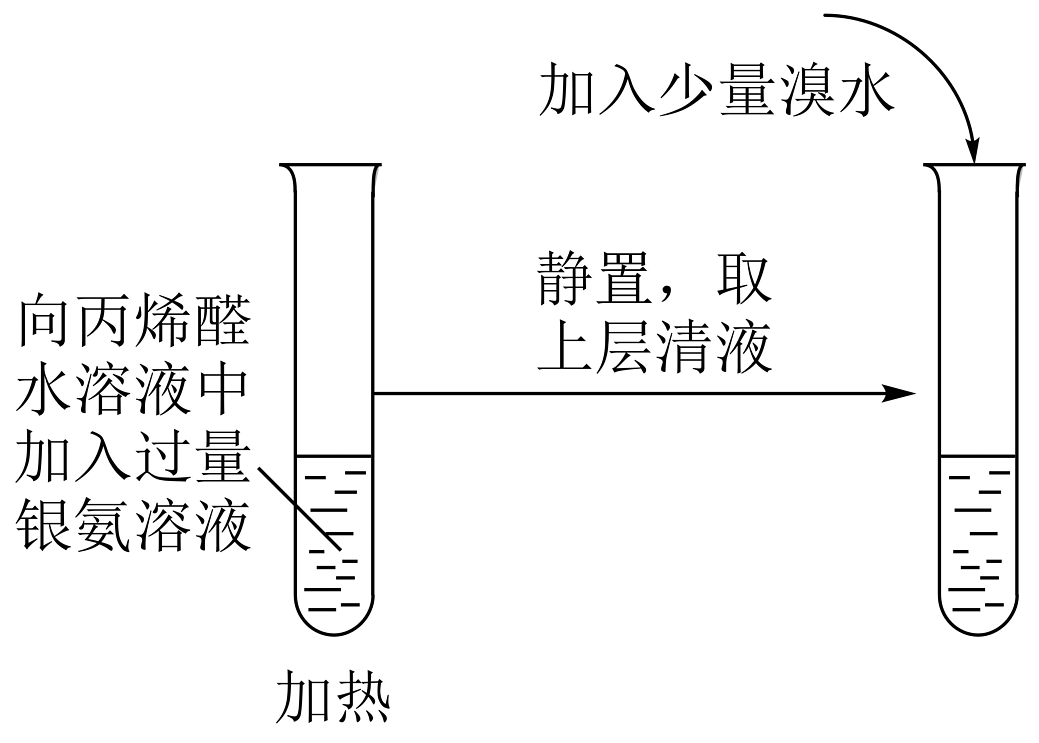

A.检验CH2=CHCHO有碳碳双键
B.制备Al2S3固体
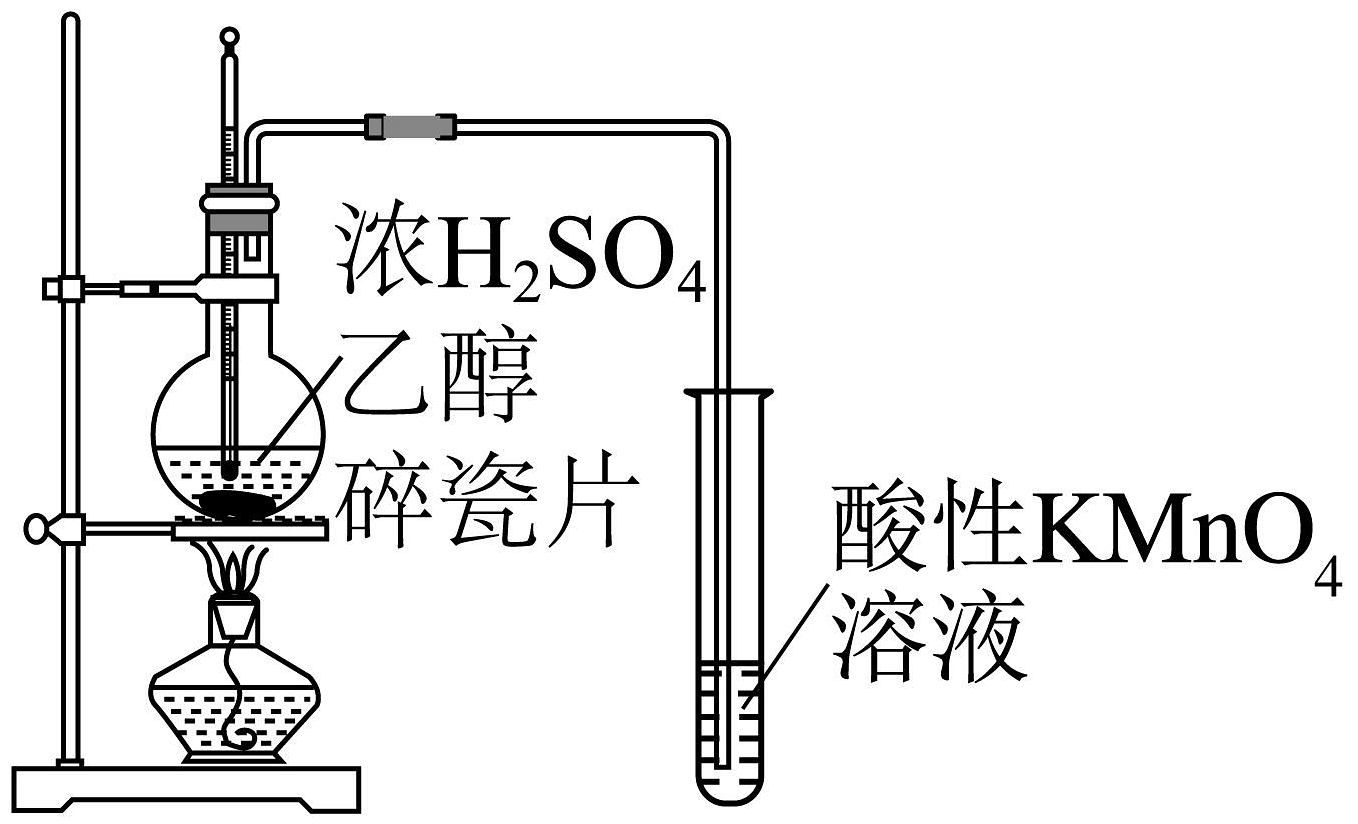

C.验证乙烯具有还原性
D.在铁制品上镀致密铜镀层
A、A B、B C、C D、D -
20、下列实验操作规范且能达到实验目的的是




A.验证浓硫酸稀释放出热量
B.测定中和热
C.探究对和反应速率的影响
D.酸式滴定管的使用
A、A B、B C、C D、D