相关试卷
- 江苏省苏州市园区苏州大学附属中学2025-2026学年高一上学期10月月考化学试题
- 甘肃省多校2025-2026学年 高三上学期第一次联考考试 化学试卷
- 广东省金太阳2025-2026学年高三上学期8月开学联考化学试卷
- 广东省四校普通高中教学质量检测2025-2026学年高三上学期10月月考化学试题
- 江苏省部分高中2024-2025学年高一上学期期末迎考化学试题
- 江苏省盐城市七校联考2025-2026学年高三上学期期初考试化学试卷
- 广东省广州奥林匹克中学2025-2026学年高三上学期9月月考 化学试题
- 江苏省常州市金坛区第一中学2025-2026学年高三上学期开学化学试题
- 广东省清远市阳山县南阳中学2025-2026学年高一上学期第一次月考 化学试题
- 广州市2025-2026学年高三上学期 八月阶段训练化学试题
-
1、锑白(Sb2O3)为白色粉末,不溶于水,溶于酸和强碱,主要用于制备白色颜料、油漆等。一种利用锑矿粉(主要成分为Sb2S3、SiO2)制取锑白的流程如下。

已知:浸出液中的阳离子主要为Sb3+、Fe3+、Fe2+。
下列说法错误的是
A、“浸出”时发生的反应为Sb2S3+6Fe3+=2Sb3++6Fe2++3S B、可以用KSCN溶液检验“还原”反应是否完全 C、“滤液”中通入Cl2后可返回“浸出”工序循环使用 D、“中和”时可用过量的NaOH溶液代替氨水 -
2、有机物G是一种医药中间体,其合成路线如下(部分试剂和反应条件略去)。
 (1)、根据化合物C的结构特征,分析预测其含氧官能团可能的化学性质,完成下表。
(1)、根据化合物C的结构特征,分析预测其含氧官能团可能的化学性质,完成下表。序号
反应试剂、条件
反应形成新官能团的名称
反应类型
①
H2 , 催化剂,加热
②
消去反应
(2)、化合物B的化学式是 , 组成元素的第一电离能数值由大到小的排列是。在B的同分异构体中,含有六元环结构且能发生银镜反应的有机物有种(不考虑立体异构)。(3)、上述物质转变过程中,说法正确的是___________(填标号)A、B生成C的反应是原子利用率100%的反应,则化合物a是甲醛 B、化合物C中手性碳原子有2个,且所有的碳原子不可能共平面 C、反应④中,有键的断裂与生成 D、化合物E的碳原子的杂化方法有sp2和sp3 , 分子内有“s-p”形成的Π键(4)、根据上述信息,以甲苯和乙酰乙酸乙酯(CH3COCH2COOC2H5)为有机原料,合成化合物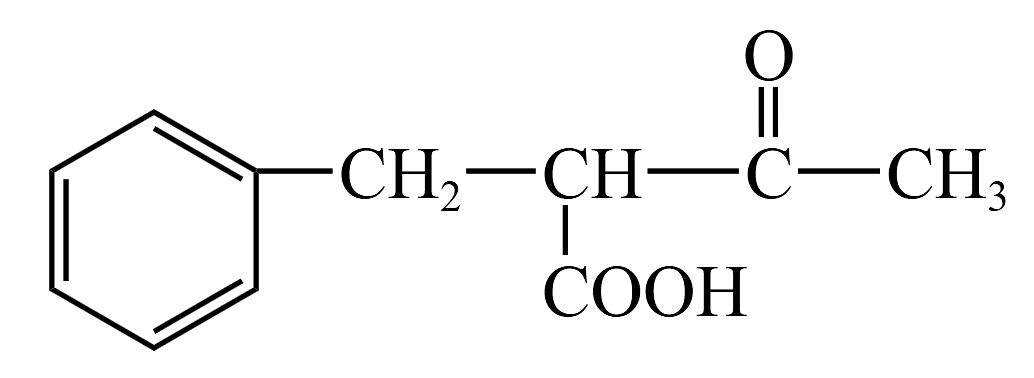 , 基于你的合成路线,回答下列问题:
, 基于你的合成路线,回答下列问题:①从甲苯出发,第一步的化学方程式为。
②第二步生成有机产物的结构简式为。
-
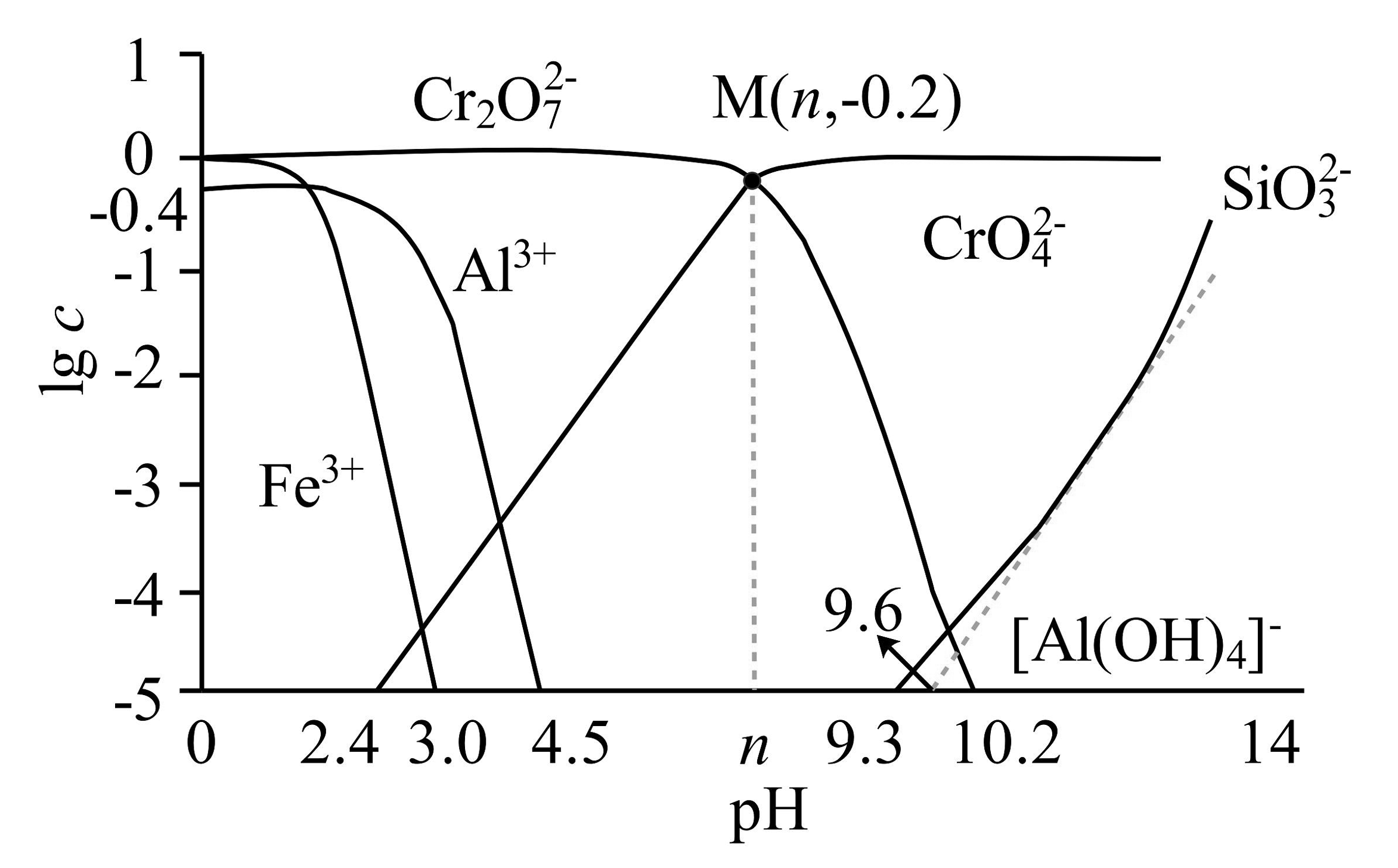
3、Cr(OH)3可用于油漆颜料及羊毛处理。工业上以高铁铬铁矿(主要成分为Cr2O3 , 含Fe2O3、SiO2、Al2O3等杂质)为原料生产Cr(OH)3和金属Al的工艺流程如图:

已知:
I.“焙烧”过程中,Cr2O3反应转化为Na2CrO4。
Ⅱ.若溶液中相关离子的物质的量浓度为c,则常温时,lgc与溶液pH的关系如图所示。
Ⅲ.。
回答下列问题:
(1)、“焙烧”时,Cr2O3发生反应的化学方程式为。(2)、“水浸”后滤渣主要成分为(填化学式);“调pH”时通入的“气体X”是。(3)、常温下,图象上M点对应的溶液pH=。(4)、“沉铝”后的母液Ⅱ的主要成分为;煅烧步骤的化学方程式为。(5)、加入Na2S“析铬”时,硫元素被氧化成 , 与Na2S反应的比例是。(6)、储氢技术是目前化学家研究的热点之一,铁与镁形成的某种合金可用于储氢领域,其晶胞如图所示:其中A的原子坐标参数为(0,0,0),B为(),C为(),则D点的坐标参数为。此晶胞中Fe的配位数是。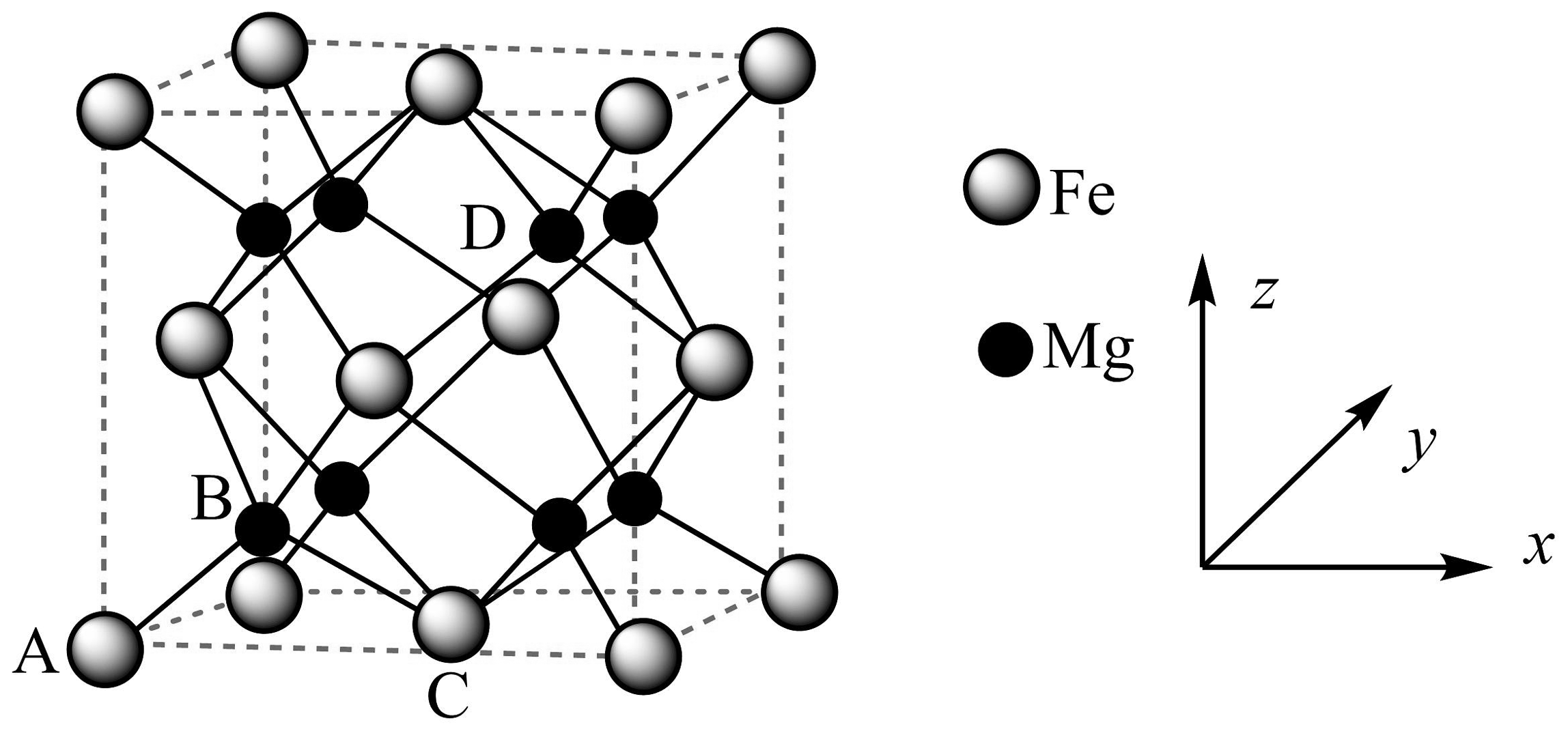
-
4、常温下,向1L0.1mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下NH3·H2O电离平衡常数K=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
 A、0.1mol·L-1HR溶液的pH为5 B、当pH=6时,水电离出的氢离子浓度为1.0×10-6 C、当通入0.1 mol NH3时,c()>c(R-)>c(H+)>c(OH-) D、当 pH=7时,c()=c(R-)
A、0.1mol·L-1HR溶液的pH为5 B、当pH=6时,水电离出的氢离子浓度为1.0×10-6 C、当通入0.1 mol NH3时,c()>c(R-)>c(H+)>c(OH-) D、当 pH=7时,c()=c(R-) -
5、全钒液流电池具有响应速度快、操作安全、使用寿命长等优点,被广泛应用于各领域,原理如图所示。下列有关说法正确的是
 A、放电时,A极为负极,发生还原反应 B、放电时,B极反应式为 C、充电时,电流移动方向为A极→隔膜→B极 D、充电时,A极反应式为
A、放电时,A极为负极,发生还原反应 B、放电时,B极反应式为 C、充电时,电流移动方向为A极→隔膜→B极 D、充电时,A极反应式为 -
6、吡啶(C5H5N)是一种有机弱碱,可与盐酸反应生成盐酸盐(C5H5NHCl)。下列关于0.01mol/LC5H5NHCl水溶液的叙述正确的是A、水溶液的pH=2 B、加水稀释,pH降低 C、水溶液中: D、水溶液中:
-
7、利用可逆动态吡唑银分子
 催化剂,可实现高效丙烯电催化氧化制备1,2-丙二醇。吡唑银分子由于与*OH之间的氢键作用,对*OH具有较强的吸附作用,而解离形成H空位后,对*OH的吸附作用减弱,加速*OH与丙烯分子耦合,反应机理如图。下列叙述错误的是
催化剂,可实现高效丙烯电催化氧化制备1,2-丙二醇。吡唑银分子由于与*OH之间的氢键作用,对*OH具有较强的吸附作用,而解离形成H空位后,对*OH的吸附作用减弱,加速*OH与丙烯分子耦合,反应机理如图。下列叙述错误的是 A、图中甲为该反应的催化剂 B、该反应机理中涉及水的解离 C、
A、图中甲为该反应的催化剂 B、该反应机理中涉及水的解离 C、 中的键不稳定
D、利用该反应机理可由1,3-丁二烯制备
中的键不稳定
D、利用该反应机理可由1,3-丁二烯制备
-
8、X、Y、Z为短周期主族元素,化合物ZYX2是一种有机中间体,与水发生剧烈反应生成强酸HX和一种常见的温室气体ZY2。下列说法正确的是A、电负性:Z<Y<X B、基态Z原子和Y原子的未成对电子数相等 C、ZYX2为非极性分子 D、ZY2的分子中,键与键个数比为2:1
-
9、一种能标记DNA的有机物的结构简式如图所示,下列关于该有机物的说法不正确的是
 A、能使酸性KMnO4溶液褪色 B、最多能与2倍物质的量的NaOH反应 C、能与NaHCO3溶液反应生成CO2 D、能与浓溴水发生加成反应和取代反应
A、能使酸性KMnO4溶液褪色 B、最多能与2倍物质的量的NaOH反应 C、能与NaHCO3溶液反应生成CO2 D、能与浓溴水发生加成反应和取代反应 -
10、锰酸钾(K2MnO4)可用于油脂、纤维、皮革的工业漂白。利用软锰矿提取的粗MnO2为原料,制备锰酸钾的反应为:。下列说法错误的是A、X的化学式是KCl B、MnO2、K2MnO4均具有氧化性和还原性 C、K2MnO4是还原产物 D、KClO3阴离子的VSEPR模型为四面体形
-
11、下列实验所选装置正确且能达到相应实验目的的是
选项
A
B
实验装置

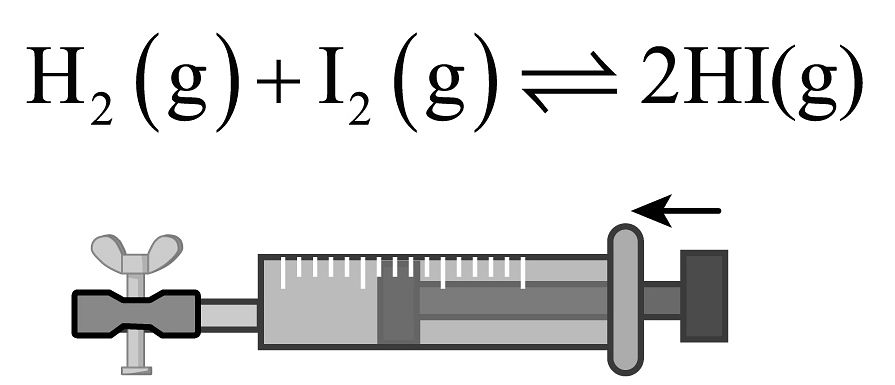
实验目的
除去Cl2中的NO2
探究压强对平衡的影响
选项
C
D
实验装置


实验目的
制备无水AlCl3
分离乙酸乙酯和饱和Na2CO3溶液
A、A B、B C、C D、D -
12、设为阿伏加德罗常数的值,下列叙述中正确的是A、常温常压下,和混合气体中含原子数为 B、的溶液中含离子数目为 C、标准状况下,含有的分子数为 D、所含离子数为
-
13、下列化学用语中正确的是A、Fe位于元素周期表VIII族,ds区 B、的空间填充模型:
 C、CN-的电子式为
C、CN-的电子式为 D、反式2-丁烯的键线式是:
D、反式2-丁烯的键线式是:
-
14、化学与生活、生产息息相关。下列物质的应用错误的是A、二氧化硫用作葡萄酒抗氧化剂 B、单晶硅用于制作计算机芯片 C、甲醛稀溶液用作海产品保鲜剂 D、石墨烯用作新型电池电极材料
-
15、化合物H是一种有机光电材料中间体。实验由芳香化合物A制备H的一种合的一种合成路线如下:成路线如下:

已知:①
②
 +
+

回答下列问题:
(1)、A的化学名称是。(2)、由C生成D和E生成F的反应类型分别是、。(3)、E的结构简式为。(4)、G为甲苯的同分异构体,由F生成H的化学方程式为。(5)、芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出 , 其核磁共振氢谱显示有4种不同化学环境的氢,个数比为6︰2︰1︰1,写出2种符合要求的X的结构简式:。(6)、写出用环戊烷和2—丁炔为原料制备化合物 的合成路线。(其他试剂任选)。
的合成路线。(其他试剂任选)。 -
16、常用作麻醉剂、用于肝脏超声检查等。可通过硫蒸气和氟气反应制备。
已知:①
② ,
回答下列问题:
(1)、和的结构如图所示。
①在一定温度下会生成 , 破坏的作用力类型有(填标号)。
A.键 B.极性键 C.非极性键 D.型键
②下列有关叙述正确的是(填标号)。
A.空间结构为正四面体形 B.难溶于水,易溶于
C.键角为90°、180° D.1mol含14mol共价键
(2)、 。(3)、反应②的正反应在下列温度下能自发进行的是_______(填标号)。A、500℃ B、900℃ C、1900℃ D、2000℃(4)、某温度下,向刚性密闭容器中充入0.1mol和0.1mol , 发生反应②,测得含S粒子浓度与时间的关系如图1所示。
①2s时,转化率为。正反应速率:ab(填“”“”或“”)。
②0~6s内平均反应速率为(结果保留2位有效数字)。
(5)、某温度下,向恒容密闭容器中充入0.1mol和适量 , 达到平衡后,调节浓度,测得、和浓度与的关系如图2所示。
①代表与的关系。
②该温度下,反应的平衡常数K为(不带单位)。
-
17、以镉废渣(主要成分是Cd,含少量Cu、Fe、Co等)为原料提取镉的流程如下:

已知:
①在金属活动性顺序表中,Co、Cd排在H之前;Cd与Zn同族。
②几种金属离子形成氢氧化物的pH如下表:
金属氢氧化物
开始沉淀pH
1.9
7.0
7.2
完全沉淀pH
3.2
9.0
9.5
回答下列问题:
(1)、Cd位于元素周期表区。(2)、“滤渣1”的主要成分是(填化学式);“除铁”中双氧水的作用是(用离子方程式表示)。(3)、“试剂X”宜选择(填标号),其调节pH范围为。A.氨水 B.CdO C. D.NaOH
(4)、“电解”中,阳极反应式为。(5)、氧元素有多种同素异形体。在超高压下转化为平行六面体的分子(结构如图所示)。的沸点(填“高于”或“低于”) , 其理由是。 (6)、Cd晶胞为体心立方晶胞,如图所示。已知:晶胞参数为a pm,为阿伏加德罗常数的值。则Cd原子半径为pm,Cd晶体密度为。
(6)、Cd晶胞为体心立方晶胞,如图所示。已知:晶胞参数为a pm,为阿伏加德罗常数的值。则Cd原子半径为pm,Cd晶体密度为。
-
18、
常作有机反应的催化剂。某实验小组拟制备并探究其性质。
实验(一)制备。
装置如图1所示。已知:沸点为58.8℃。实验中,观察到烧瓶中产生红棕色气体。
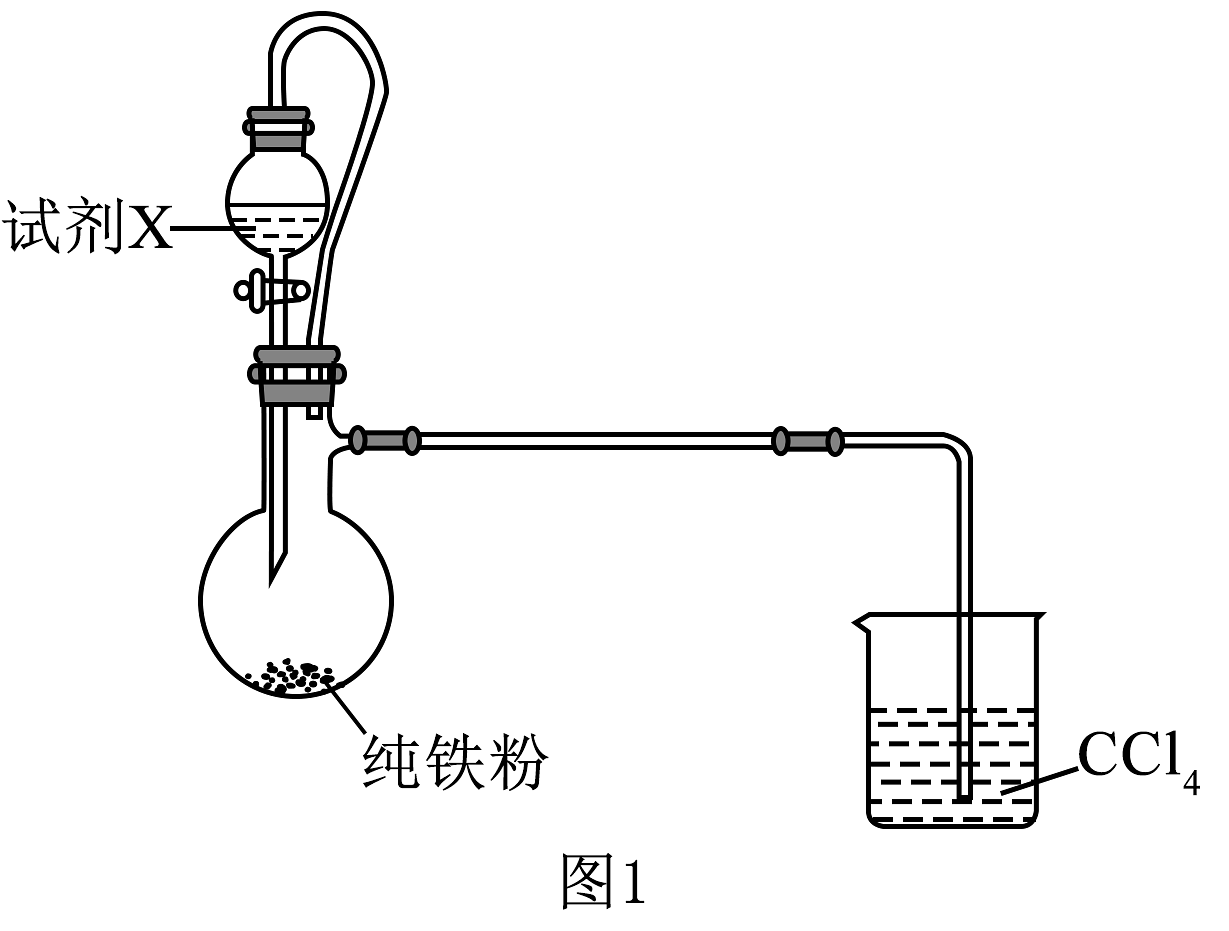
(1)试剂X宜选择(填“溴水”或“液溴”)。用铁粉替代铁片的目的是。
(2)装置中利用到的四氯化碳的性质是。实验完毕后,将烧瓶中混合物经(填实验操作名称)得到固体。
实验(二)探究性质。
为了探究的稳定性,进行如图2实验。
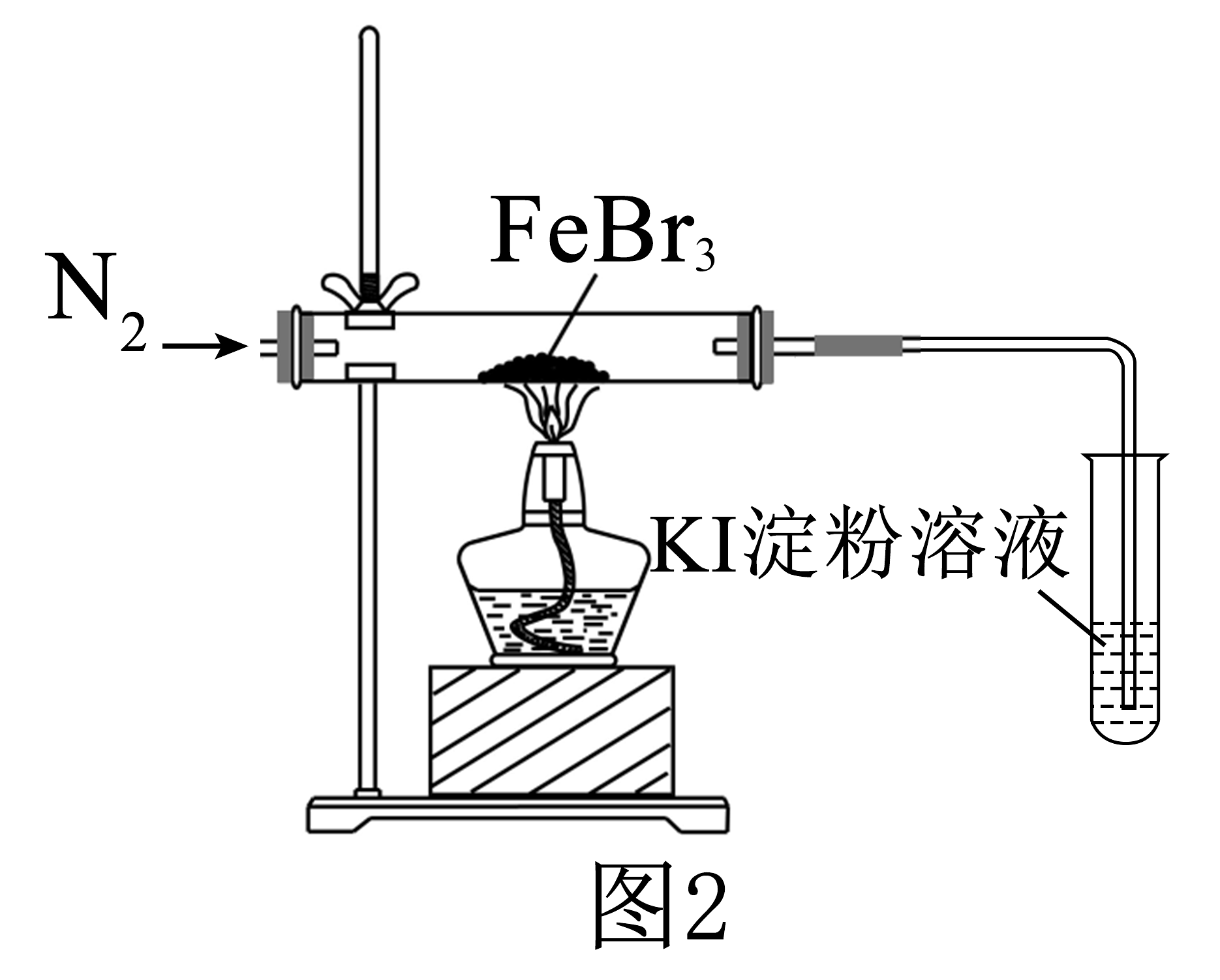
(3)当(填实验现象)时,可以确认发生分解反应,生成了。
(4)实验过程中,先通入一会儿 , 再点燃酒精灯,这样操作的目的是。
(5)为确认玻璃管中残留物有 , 宜选择试剂(填标号)。
a.溶液 b.酸性溶液
c.KSCN溶液,氯水 d.溶液
(6)为了探究浓度对氧化性的影响,实验操作及现象如下:
实验
操作
现象
ⅰ
向2mL0.1mol溶液中滴加KI淀粉溶液
溶液变蓝色
ⅱ
向2mL0.1mol溶液中先加入适量NaF固体,后滴加KI淀粉溶液
溶液不变蓝色
已知:呈无色。
写出实验ⅰ中离子反应方程式:。
实验ⅱ“不变蓝色”的原因是(结合必要化学用语和文字解释)。
-
19、某溶液M含一种阳离子和、、、、中的一种或几种阴离子。为了确定其组成,实验操作及现象如下:
实验
操作
现象
①
向M溶液中滴加酚酞溶液
溶液变红色
②
向M溶液中滴加盐酸
产生气体和浅黄色沉淀
根据实验结果,下列关于M的推断合理的是
A、不可能含 B、一定含 C、一定含和 D、一定不含 -
20、为达到下列实验目的,操作方法合理的是
选项
实验目的
操作方法
A
从含有的固体中提取
用水溶解、过滤、结晶、过滤
B
证明2-丁烯醛含碳碳双键
加入溴水观察现象
C
制备热饱和溶液
蒸发溶液至溶液表面形成一层膜
D
测定的含氮量
酸化,加足量NaOH共热,用过量的盐酸吸收氨气;以酚酞作指示剂,用NaOH溶液滴定吸收液
A、A B、B C、C D、D