相关试卷
- 江苏省苏州市园区苏州大学附属中学2025-2026学年高一上学期10月月考化学试题
- 甘肃省多校2025-2026学年 高三上学期第一次联考考试 化学试卷
- 广东省金太阳2025-2026学年高三上学期8月开学联考化学试卷
- 广东省四校普通高中教学质量检测2025-2026学年高三上学期10月月考化学试题
- 江苏省部分高中2024-2025学年高一上学期期末迎考化学试题
- 江苏省盐城市七校联考2025-2026学年高三上学期期初考试化学试卷
- 广东省广州奥林匹克中学2025-2026学年高三上学期9月月考 化学试题
- 江苏省常州市金坛区第一中学2025-2026学年高三上学期开学化学试题
- 广东省清远市阳山县南阳中学2025-2026学年高一上学期第一次月考 化学试题
- 广州市2025-2026学年高三上学期 八月阶段训练化学试题
-
1、草酸亚铁是生产磷酸铁锂电池的原料,实验室可通过如下反应制取:

已知室温时:。
下列说法正确的是
A、室温下,向溶液中加酸调节时溶液中存在: B、“酸化溶解”后的溶液中存在: C、室温时,能与反应生成沉淀 D、室温时,“沉铁”后的上层清液中: -
2、下列由实验操作和现象推出的结论正确的是
实验操作和现象
结论
A
向含有ZnS和的白色悬浊液中滴加少量溶液,有黑色沉淀生成
B
向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,冷却后向其中加入足量稀NaOH溶液,再加入新制的银氨溶液,并水浴加热,产生了银镜
蔗糖水解产物具有还原性
C
向浓中插入红热的炭,有红棕色气体生成
炭可与浓反应生成
D
将食品脱氧剂样品中的还原铁粉溶于盐酸,滴加KSCN溶液,无血红色出现
食品脱氧剂样品中无+3价铁
A、A B、B C、C D、D -
3、回收利用工业废气中的和 , 实验原理示意图如下。
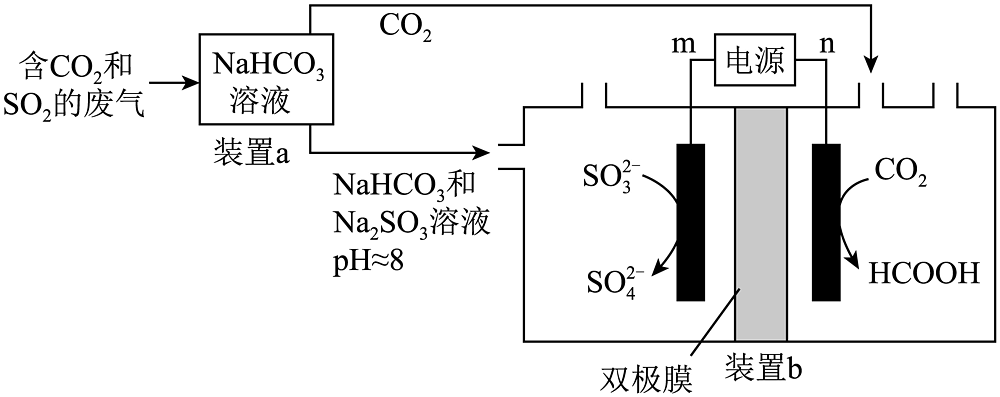
下列说法不正确的是
A、m极为电源正极 B、电解过程中,双极膜中产生的移向右侧,产生的移向左侧 C、装置a中溶液的作用是吸收废气中的和 D、装置b中,每当有标准状况下参与反应时,得电子数为2mol -
4、植物提取物阿魏萜宁具有抗菌活性,其结构简式如下图所示。下列关于阿魏萜宁的说法错误的是
 A、可与Na2CO3溶液反应 B、消去反应产物最多有2种 C、酸性条件下的水解产物均可生成高聚物 D、该有机物与足量H2反应所得产物有5个手性碳原子
A、可与Na2CO3溶液反应 B、消去反应产物最多有2种 C、酸性条件下的水解产物均可生成高聚物 D、该有机物与足量H2反应所得产物有5个手性碳原子 -
5、阅读以下材料,完成下列小题:
海洋是一个巨大的卤素资源宝库,从海水中能获得NaCl。工业常用电解饱和NaCl溶液制备 , 并进一步制得等用途更广泛的化合物。黄绿色气体可用于自来水消毒,(N的化合价为-3)有强氧化性,遇水剧烈水解,可用于漂白和杀菌消毒。
(1)、下列说法正确的是A、分子中含有键 B、是由极性键构成的非极性分子 C、中的键角小于中的键角 D、在NaCl晶胞中,每个周围紧邻且距离相等的构成正六面体结构(2)、下列化学反应表示正确的是A、电解饱和食盐水制备的离子方程式: B、将氯水在强光下照射的化学方程式: C、水解的化学方程式: D、与NaOH溶液在时生成的离子方程式:(3)、下列物质性质与用途具有对应关系的是A、能溶于水,可用于工业制盐酸 B、HCl具有还原性,可用于实验室制取氯气 C、NaClO具有强碱性,可用作漂白液 D、气体呈黄绿色,可用作自来水消毒剂 -
6、铵明矾常用作絮凝剂。下列说法正确的是A、离子半径: B、电负性: C、第一电离能: D、沸点:
-
7、利用下列装置(夹持装置略)进行实验,能达到实验目的的是
 A、用甲装置进行中和热的测定 B、用乙装置制备溴苯并验证有HBr产生 C、用丙装置制备无水 D、用丁装置加热熔融NaOH固体
A、用甲装置进行中和热的测定 B、用乙装置制备溴苯并验证有HBr产生 C、用丙装置制备无水 D、用丁装置加热熔融NaOH固体 -
8、传统鎏金工艺是将金溶于汞中制成“金汞漆”,涂在器物表面,然后加火除汞,使金附着在器物表面。下列说法错误的是A、刻金工艺中金发生了化学反应 B、鎏金工艺利用了汞的挥发性 C、鎏金工艺的原理可用于金的富集 D、将银代替金溶于汞中即为鎏银工艺
-
9、已知常温下部分弱电解质的电离平衡常数如下表:
化学式
HF
HClO
H2CO3
NH3·H2O
电离常数
6.8×10−4
4.7×10−8
K1=4.3×10−7
K2=5.6×10−11
Kb=1.7×10−5
(1)常温下,pH相同的三种溶液①NaF溶液②NaClO溶液③Na2CO3溶液,其物质的量溶度由大到小的顺序是(填序号)
(2)25℃时,pH=4的NH4Cl溶液中各离子浓度的大小关系为。
(3)0.1 mol/L的NaClO溶液和0.1 mol/L的NaHCO3溶液中,c(ClO‒)c(HCO3‒)(填“>,<,=”)可使上述两种溶液PH相等的方法是(填代号)
a.向NaClO溶液中加适量的水b.向NaClO溶液中加适量的NaOH
c.向NaHCO3溶液中加适量的水d.向NaHCO3溶液中加适量的NaOH
(4)向NaClO溶液中通入少量的CO2 , 所发生的离子方程式为。
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,判断混合溶液的酸碱性(填“酸性”“碱性”“中性”)
-
10、一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mol)随时间t(min)的变化如图所示。

(1)该反应的化学方程式为 , 在此条件下,下列各项能说明该反应达到平衡状态的是。
A.混合气体的压强不变B.混合气体的密度不变
C.混合气体的总物质的量不变D.混合气体的平均相对分子质量不变
E.C的体积分数不变
(2)该反应的反应速率υ随时间t的关系如图所示:

①根据图判断,在t3时刻如何改变外界条件的。
②a、b、c三点中,C的体积分数最大的是。
③各阶段的平衡常数如下表所示:则K1、K2、K3之间的关系为(用“”、“”或“=”连接)。
t2~t3
t4~t5
t5~t6
K1
K2
K3
-
11、
I.联氨(N2H4 , 常温下是无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)已知12.8 g的液态高能燃料联氨在氧气中燃烧,生成气态N2和液态水,放出248.8kJ的热量。写出表示液态联氨燃烧热的热化学方程式。(2)已知①2O2(g)+N2(g)=N2O4(l) ΔH1②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH4=-1048.9kJ/mol
上述反应热效应之间的关系式为ΔH4= , 联氨和N2O4可作为火箭推进剂的主要原因为。
Ⅱ.现有反应:mA(g)+nB(g)pC(g).达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(3)该反应的逆反应为热反应,且m+np(填“>”“=”“<”)。(4)若加入B(体积不变),则A的转化率 , B的转化率(填“增大”“减小”或“不变”)。(5)若升高温度,则平衡时B、C的浓度之比将。(6)若加入催化剂,平衡时气体混合物的总物质的量。 -
12、25℃时,用浓度为0.1000的NaOH溶液滴定20.00mL浓度均为0.1000的三种酸HX、HY、HZ,滴定曲线如图所示,下列说法正确的是
 A、在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX B、根据滴定曲线,可得 C、将上述HX、HY溶液等体积混合后,用NaOH溶液中和滴定至恰好完全反应时,c(X−)>c(Y−)>c(OH−)>c(H+) D、HX、HY、HZ中均存在电离平衡
A、在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX B、根据滴定曲线,可得 C、将上述HX、HY溶液等体积混合后,用NaOH溶液中和滴定至恰好完全反应时,c(X−)>c(Y−)>c(OH−)>c(H+) D、HX、HY、HZ中均存在电离平衡 -
13、如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700—900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是
 A、电池总反应为N2H4+2O2=2NO+2H2O B、电池内的O2-由电极乙移向电极甲 C、电极乙上反应的电极方程式为:O2+2e-=O2- D、电池外电路的电子由电极乙移向电极甲
A、电池总反应为N2H4+2O2=2NO+2H2O B、电池内的O2-由电极乙移向电极甲 C、电极乙上反应的电极方程式为:O2+2e-=O2- D、电池外电路的电子由电极乙移向电极甲 -
14、下列依据热化学方程式得出的结论正确的是A、在、时,完全燃烧生成液态水,放出热量,则表示氢气燃烧热的热化学方程式为: B、的燃烧热是 , 则 C、在稀溶液中: , 若将含的稀硫酸与含的溶液混合,放出的热量大于 D、已知石墨,金刚石, , 则金刚石比石墨稳定
-
15、25℃时,向纯水中通入Cl2至饱和,再逐滴滴加0.1mol/L的NaOH溶液,实验过程中得到如下图所示的pH变化曲线。下列有关说法正确的是
 A、pH=7时,一定有c(Na+)=c(Cl-)+c(ClO-) B、从a点到b点,Cl2在水中的溶解度增大 C、b点溶液中:c(H+)=c(Cl-)+c(OH-)+c(HClO) D、从b点到c点,溶液中减小
A、pH=7时,一定有c(Na+)=c(Cl-)+c(ClO-) B、从a点到b点,Cl2在水中的溶解度增大 C、b点溶液中:c(H+)=c(Cl-)+c(OH-)+c(HClO) D、从b点到c点,溶液中减小 -
16、在25℃和T℃时,水溶液中c(H+)和c(OH-)的关系如图所示,下列说法正确的是
 A、T<25℃ B、AB点连线上的任意一点pH均为7 C、B点溶液的导电能力一定大于A点 D、溶液中水的电离程度C点可能大于D点
A、T<25℃ B、AB点连线上的任意一点pH均为7 C、B点溶液的导电能力一定大于A点 D、溶液中水的电离程度C点可能大于D点 -
17、设阿伏加 德罗常数为NA , 下列说法正确的是( )A、1molCl2与足量Fe反应,转移的电子数为3NA B、22.4L(标准状况)15NH3含有的质子数为11NA C、常温下,1L0.1mol/LMgCl2溶液中,含有Mg2+数为0.1NA D、常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA
-
18、锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+2H2O(l)=Zn(OH)2(s)+2MnOOH(s),下列说法错误的是A、电池工作时,锌失去电子 B、用该电池电解水时,电子通过外电路流向电解池阳极 C、电池正极电极反应式为:2MnO2(s)+2H2O(l)+2e-=2MnOOH(s)+2OH-(aq) D、外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
-
19、利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、II、II)作用下,CH4产量随光照时间的变化如图所示,下列说法不正确的是


图1 光照时间/小时
A、0~30h内,CH4的平均生成速率v(Ⅰ),v(Ⅱ)和v(Ⅲ)的大小顺序为v(Ⅲ)>v(Ⅱ)>v(Ⅰ) B、当其他条件一定时,使用催化剂I,反应到达平衡的时间最短 C、反应开始后的12h内,在催化剂II作用下,得到的CH4最多 D、该反应的热化学方程式为CO2(g)+2H2O(g)=CH4(g)+2O2(g) ΔH>0 -
20、甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
① CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
② CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
则下列说法不正确的是
A、CH3OH的燃烧热为192. 9 kJ/mol B、CH3OH转变成H2的过程不一定要吸收能量 C、根据①②推知反应:H2O(g)=H2(g) +1/2O2(g) ΔH=+241.9 kJ/mol D、根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的ΔH>-192.9 kJ/mol