相关试卷
- 人教版初中化学九年级上册期末专题复习专题十 制取气体的反应原理的探究(B卷)
- 人教版初中化学九年级上册期末专题复习专题十 制取气体的反应原理的探究(A卷)
- 人教版初中化学九年级上册期末专题复习专题八 化学实验探究能力(B卷)
- 人教版初中化学九年级上册期末专题复习专题八 化学实验探究能力(A卷)
- 人教版初中化学九年级上册期末专题复习专题七 基本的实验技能(B卷)
- 人教版初中化学九年级上册期末专题复习专题七 基本的实验技能(A卷)
- 人教版初中化学九年级上册期末专题复习专题六化学变化的基本特征(B卷)
- 人教版初中化学九年级上册期末专题复习专题六化学变化的基本特征(A卷)
- 人教版初中化学九年级上册期末专题复习专题五化学的基本常识(B卷)
- 人教版初中化学九年级上册期末专题复习专题五化学的基本常识(A卷)
-
1、用“
 ”和“
”和“ ”分别代表氢气分子和氮气分子,它们在高温、高压、有催化剂条件下能发生化学反应,反应前后的模拟模型如下图所示,下列说法不正确的是
”分别代表氢气分子和氮气分子,它们在高温、高压、有催化剂条件下能发生化学反应,反应前后的模拟模型如下图所示,下列说法不正确的是 A、该反应是化合反应 B、该反应前后共涉及到四种分子 C、参加反应的氢气和氮气的分子个数比是 D、每个生成物分子由4个原子构成
A、该反应是化合反应 B、该反应前后共涉及到四种分子 C、参加反应的氢气和氮气的分子个数比是 D、每个生成物分子由4个原子构成 -
2、下列说法正确的是A、在给定的条件下能一步转化S燃SO3 B、用水能鉴别 MnO2和KMnO4两种固体 C、检验氢气的纯度时,听到尖锐爆鸣声,说明气体较纯 D、铜粉中混有少量炭粉,可以在空气中充分灼烧除去
-
3、下列各组物质中,前者属于混合物,后者属于纯净物的是A、碳酸氢铵、铁 B、洁净的空气、水银 C、矿泉水、煤 D、冰水混合物、高锰酸钾充分加热后的剩余固体
-
4、下列实验现象描述正确的是A、红磷在空气中燃烧产生白色烟雾 B、铁丝在空气中燃烧,火星四射,生成黑色固体 C、硫在氧气中燃烧,发出蓝紫色火焰,生成二氧化硫气体 D、纯净的氢气在氧气中安静的燃烧,产生淡蓝色火焰
-
5、
光亮的铜片在酒精灯上加热后,表面变黑。同学们对“铜变黑的原因”产生了兴趣,于是展开了项目化学习探究。
【资料】铜在加热的条件下,不与空气中的氮气发生反应。
【形成假设】
同学甲认为是铜和空气中的某种气体发生了反应。
同学乙认为是酒精灯火焰中的烟灰附着在铜片上。
任务一:定性探究铜变黑的原因
实验
实验1
实验2
实验3
操作
取一片光亮的铜片在酒精灯上加热一段时间后,取下铜片,冷却后用白色纸巾反复擦拭
用铝箔紧紧包裹一片光亮的铜片加热一段时间,冷却后打开铝箔
向装有一片光亮的铜片的试管中充满氮气,封好橡胶塞,并加热
现象
纸巾上有黑色物质,但铜片表面仍为黑色
铜片表面不变色
铜片表面不变色
【分析解释】
(1)通过实验1现象分析,你认为同学(填“甲”或“乙”)的观点是错误的。
(2)实验2中铝箔的作用是 , 说明在发生化学反应时,反应物要相互。
(3)实验3说明铜片变黑与没有关系。
任务二∶定量探究铜变黑的原因
以上三组实验是对研究对象由表及里的“质”的分析,同学们还对研究对象进行更加精准的“量”的分析。
【实施实验】
将一定量的铜粉放置在密闭玻璃管中加热,利用氧气传感器测定加热过程中玻璃管内氧气含量的变化情况,记录数据并绘制曲线(如图所示)。
【得出结论】

(4)由曲线图推断铜与氧气发生反应的依据是。
(5)通过对黑色物质来源的探究,写出铜与氧气反应的文字表达式∶。
-
6、配制饱和食盐水(1)、已知20℃时NaCl的溶解度为36.0 g,配制50 g饱和食盐水需量取水的体积为mL(水的密度可近似看作 , 结果保留一位小数)。(2)、模拟侯氏制碱法
具体原理为: ,
取一定量的饱和食盐水,通入足量的氨气和二氧化碳充分反应,过滤后得到8.4 g碳酸氢钠固体,加热完全分解生成碳酸钠的质量为多少克?(根据化学方程式计算。写出计算过程)
(3)、20℃时,NaCl饱和溶液中溶质质量分数为(只写计算式)。(4)、配制100 g质量分数为16%的氯化钠溶液进行选种时,下列相关内容错误的是___________。A、相关图标 B、量取
B、量取 C、溶解
C、溶解 D、装瓶贴签
D、装瓶贴签 (5)、配制50 g16%的氯化钠溶液,下列做法中会导致所配溶液溶质质量分数偏大的是___________。A、氯化钠放入烧杯时有洒落 B、溶解时使用内壁附着有水的烧杯 C、量取水时俯视量筒读数 D、氯化钠未完全溶解就装入试剂瓶
(5)、配制50 g16%的氯化钠溶液,下列做法中会导致所配溶液溶质质量分数偏大的是___________。A、氯化钠放入烧杯时有洒落 B、溶解时使用内壁附着有水的烧杯 C、量取水时俯视量筒读数 D、氯化钠未完全溶解就装入试剂瓶 -
7、水是生命赖以生存的重要物质。(1)、保护水资源从我做起。下列做法正确的是___________(填序号)。A、洗手后随手关闭水龙头,以节约用水 B、工业污水未经分级处理直接作为园林绿化用水(2)、下列净水方法中,采用单一操作净化程度较高的是___________(填序号)。A、吸附 B、过滤 C、蒸馏(3)、向所取河水中加入明矾做絮凝剂,明矾的作用是。(4)、沉降、过滤后的河水还会有一些有颜色、有气味的杂质,可利用活性炭的性进行净化。(5)、通过水的生成和分解实验认识水的组成。

①在空气中点燃纯净的氢气,产生火焰,上方罩一个干燥的烧杯,观察到 , 写出该反应的化学方程式。
②在如图所示电解器玻璃管中加满水,通电一段时间后,a管中产生3 mL气体时,b管中产生的气体体积约为mL。
③用电解水的方法制取1 g氢气。理论上至少需要水的质量是。
A.2 g B.6 g C.8 g D.9 g
④图1切断电源,用燃着的木条分别在玻璃管尖嘴口检验电解产生的气体,观察到(填“a”或“b”)管中气体使木条燃烧更旺,另一管中气体可燃。
⑤利用分解和合成探究水的组成的过程,对形成研究物质组成的思路与方法具有重要意义。下列说法不正确的是。
A.图1中,管a、管b产生气体的体积比为2:1
B.图2中,观察到干燥烧杯内出现水雾,可知水中一定含有氢元素
C.两个化学变化过程中,分子、原子种类均发生改变
D.本探究得出的结论是水由氢、氧元素组成
-
8、学习小组进行了如图一系列实验,请回答下列问题。
 (1)、实验一:铁丝燃烧实验。该反应的符号表达式为 , 集气瓶中水的作用是。(2)、实验二:红磷熄灭后,集气瓶冷却至室温,打开止水夹,水能倒吸入集气瓶的原因是。(3)、实验三:分子运动实验。分别用套有单孔橡胶塞的两支胶头滴管吸入约1mL浓氨水,立即塞入试管(试管中上部的内壁固定有滴有酚酞溶液的棉花),并将B试管放置在盛有热水的烧杯中,同时挤压胶头滴管,观察到的现象是;由此得出结论:温度越高,分子运动越快。
(1)、实验一:铁丝燃烧实验。该反应的符号表达式为 , 集气瓶中水的作用是。(2)、实验二:红磷熄灭后,集气瓶冷却至室温,打开止水夹,水能倒吸入集气瓶的原因是。(3)、实验三:分子运动实验。分别用套有单孔橡胶塞的两支胶头滴管吸入约1mL浓氨水,立即塞入试管(试管中上部的内壁固定有滴有酚酞溶液的棉花),并将B试管放置在盛有热水的烧杯中,同时挤压胶头滴管,观察到的现象是;由此得出结论:温度越高,分子运动越快。 -
9、秦岭东西绵延约1600公里,山区面积40万平方公里,素有“国家中央公园”之称。请用化学知识回答下列问题∶(1)、每当深冬时节,冰雪与秦岭会绘制一幅绝美画卷——秦岭雾凇。能形成雨、雪等自然现象,证明空气中含有(填物质名称)。(2)、秦岭山脚下的陕西翠香猕猴桃驰名中外。猕猴桃中含有丰富的“钙、钾、锌、硒”,这里的“钙、钾、锌、硒”是指(填“原子”“分子”或“元素”)。(3)、秦岭的著名景区——牛背梁国家森林公园含有丰富的负氧离子()是国家标准的35倍,堪称“天然氧吧”。一个与分子比较,不同的是(填“质子数”或“电子数”)。(4)、华山是秦岭北部的支脉,缆车游览华山可观华山之险峻。缆车上方的缆绳(高碳钢丝绳)强度高,柔韧性强,主要利用高碳钢丝绳的(填“物理”或“化学”)性质。
-
10、我国著名科学家、中国科学院院士张青莲教授主持测定了铟、锑、铕等几种元素相对原子质量的新值。铕是一种稀土元素,在元素周期表中的部分信息如图所示,下列说法正确的是
 A、一个铕原子的质量为151.96g B、铕属于非金属元素 C、铕原子的中子数为63 D、铕原子的质子数为63
A、一个铕原子的质量为151.96g B、铕属于非金属元素 C、铕原子的中子数为63 D、铕原子的质子数为63 -
11、在地震灾害后的防疫工作中,当地人用二氧化氯(ClO2)作消毒剂。ClO2是—种橙绿色、有刺激性气味的气体,11℃以下为红色液体,易溶于水,见光易分解。下列描述属于二氧化氯化学性质的是A、橙绿色 B、有刺激性气味 C、见光易分解 D、易溶于水
-
12、酒的陈化过程发生缓慢氧化。在此过程中,消耗了空气中的A、氮气 B、二氧化碳 C、水蒸气 D、氧气
-
13、如图所示实验操作正确的是A、
 B、
B、 C、
C、 D、
D、
-
14、我们生活在物质的世界里,而物质在不断地变化。以下不属于化学变化的是A、食物腐烂 B、冰雪融化 C、大米酿酒 D、纸张燃烧
-
15、
化学兴趣小组同学进行“氧气制取”系列实验研讨活动。
【实验一】实验室制氧气

(1)实验室以高锰酸钾为原料来制取氧气,选择A为发生装置,还需要补充________(填实验用品名称),发生反应的文字表达式为________;用装置E收集时导管伸入集气瓶中的时机是________;若用F收集氧气,检验氧气收集满的方法是________。
(2)实验室可用图中装置制取某气体M,则下列相关推理一定正确的是________(选填字母)。
A. 制取气体M的试剂中有液体 B. M气体在水中的溶解能力小 C. M气体不与水反应 D. M气体密度小于空气 (3)小组同学在进行高锰酸钾制氧气的实验,为了实验安全,你认为与本实验相关的提醒图标应该有________。

A. ①②④ B. ①②③ C. ②③④ D. ①③④ 【实验二】家庭制氧气
(4)利用过氧化氢分解产生氧气的原理,小玲自制了一个家庭简易制氧机如图。

①利用可以上下抽拉的线绳,可以实现二氧化锰与过氧化氢溶液的接触与分离,这样设计的优点是________(写一点),发生反应的文字表达式为________,二氧化锰在此反应中的作用是________;
②若想利用B装置监测产生氧气的速度,小组同学将B装置改进的措施是________(选填字母)。
a.将a导管加长并伸入水面以下
b.将b导管加长并伸入水面以下
c.将a和b导管同时加长并伸入水面以下
(5)市售的家用制氧机内部结构如图所示,其制氧原理为:制氧剂过碳酸钠固体和二氧化锰加入水中,过碳酸钠先分解,生成的过氧化氢再分解产生氧气(水的加入量越多,反应物浓度就越小)。


①图中加湿过滤仓中水的作用为________(写一点);
②温度和反应物浓度是影响反应速率的重要因素,在使用规定量制氧剂的情况下,为了保证合适的供氧速率,制氧机反应仓上夏季和冬季的水位线设置不同,请结合实际情况分析水位线一应为________(选填“冬季水位线”或“夏季水位线”)。
-
16、化学科学十分重视实证和理性思维。在课堂学习中,通过选用典型物质进行实验,来探究物质的有关性质。如图所示是探究氧气化学性质的实验,请回答:
 (1)、实验一:木炭在图②中燃烧与在图①中燃烧剧烈程度(选填“不同”或“相同”)。图③的实验目的是。(2)、实验二:图⑤的实验过程中没有观察到明显的火星四射现象,可能的原因是;集气瓶中预留少量水或细沙的目的是。
(1)、实验一:木炭在图②中燃烧与在图①中燃烧剧烈程度(选填“不同”或“相同”)。图③的实验目的是。(2)、实验二:图⑤的实验过程中没有观察到明显的火星四射现象,可能的原因是;集气瓶中预留少量水或细沙的目的是。 -
17、化学是一门以实验为基础的科学,请回答下列有关问题:(1)、从图1中选择相关的仪器,将仪器名称填写在相应的空格里。

①燃烧硫粉时用于盛放硫粉的仪器是:;
②下面仪器中需要垫陶土网可以进行加热的仪器是:。
(2)、某同学在进行物质的称量和液体的量取操作,如图所示:
①图2中所表示的食盐的质量为g。若在称量食盐的过程中,天平的指针向左偏转,下列做法正确的是(选填字母)。
A.移动游码 B.增加砝码 C.移走适量食盐 D.继续添加食盐
②图3中所表示的液体的体积是;若读数时仰视,则量取液体的实际体积(选填“偏大”或“偏小”)。
(3)、用如图4所示方法检查装置的气密性。
若装置的气密性良好,松开手一段时间后,导管口出现的现象是(选填“甲”“乙”或“丙”)。
-
18、从微观角度来认识物质的构成和化学反应的本质,以及从微观的角度来分析实验现象,都是学习化学的重要方法。(1)、已知氦原子是一种含2个质子和1个中子的原子,下列模型能表示氦原子的是________(选填字母)。A、
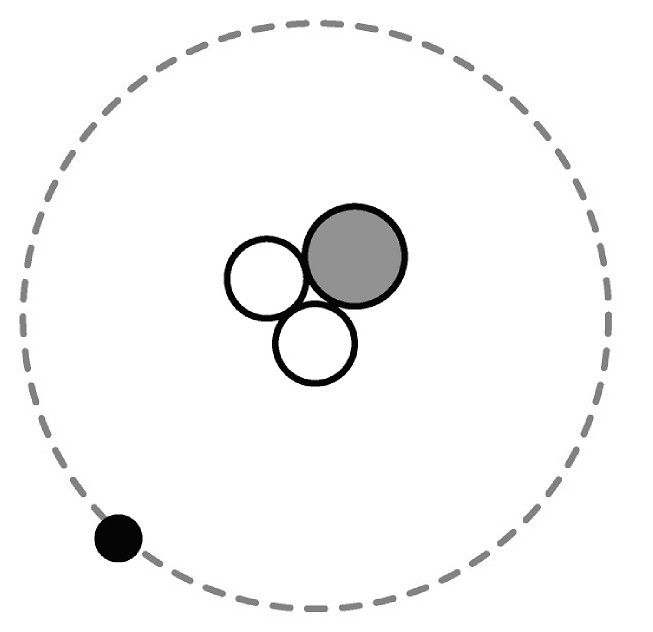 B、
B、 C、
C、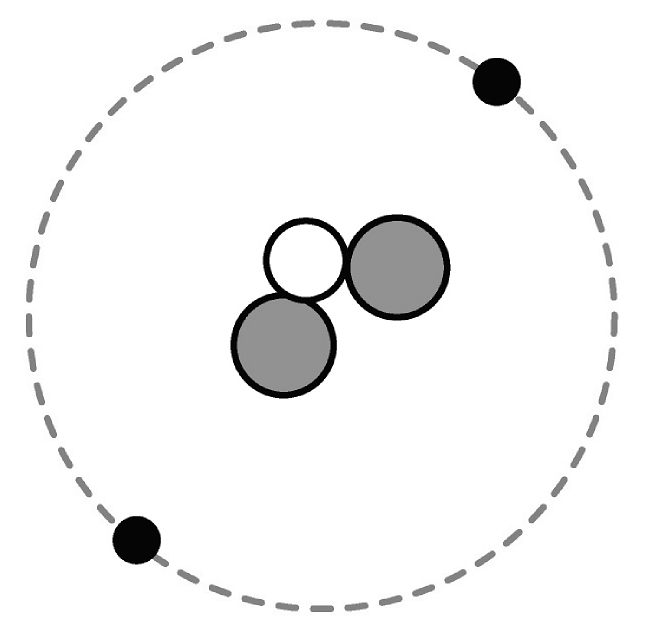 D、
D、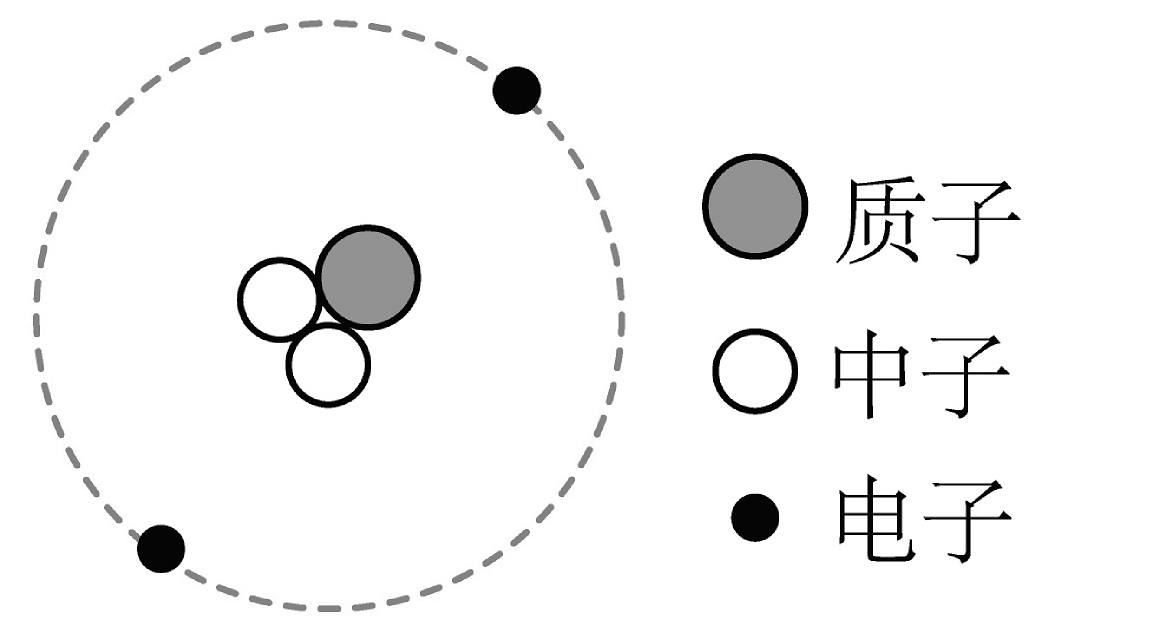 (2)、下图是某些气体的微观示意图,图中“
(2)、下图是某些气体的微观示意图,图中“ ”和“
”和“ ”分别表示不同的原子。
”分别表示不同的原子。
其中表示混合物的有(选填序号,后同),可以表示氮气的是。
(3)、用“ ”和“
”和“ ”分别表示氧原子和汞原子,下图是氧化汞在加热条件下发生反应的微观模拟图。请结合该图示回答问题。
”分别表示氧原子和汞原子,下图是氧化汞在加热条件下发生反应的微观模拟图。请结合该图示回答问题。
在微观粒子:氧化汞分子、氧分子、氧原子、汞原子中,发生改变的粒子是 , 生成的氧气是由构成的,氧化汞加热分解的过程中的最小的粒子是。
(4)、根据下列原子结构示意图,回答问题:
①A粒子的化学性质与图中(选填字母)粒子的化学性质相似;
②C粒子是(选填“原子”“阴离子”或“阳离子”),其化学符号为;
③若D是原子,则X= , 那么以上四种粒子中,已达相对稳定结构的是(选填字母)。
-
19、空气是一种宝贵的资源。我国成功发射高分五号卫星,它是世界首颗实现对大气和陆地综合观测的全谱段高光谱卫星,可通过对大气污染气体、温室气体等物理要素的监测,动态反映我国空气质量状况。(1)、跨学科研究小组同学使用“空气质量监测站”对空气污染物进行采样和测量,下列属于空气污染物的是________(选填字母)。A、臭氧 B、一氧化碳 C、 D、(2)、小明提出课本上学过的一个化学反应生成的气体是空气污染物,请写出该反应的文字表达式。(3)、工业制取氧气主要有下列步骤。
将经过除尘、除二氧化碳、除水的空气进行下列操作:

a.根据图示步骤,分析可知,工业制氧气属于(选填“物理变化”或“化学变化”);
b.从步骤②可以得出氮气的沸点比氧气的沸点(选填“高”或“低”);
c.储存在蓝色钢瓶里的“工业液氧”是(选填“纯净物”或“混合物”);
d.从微观角度解释氧气能被压缩在钢瓶中的原因是。
-
20、下列变化属于氧化反应但不属于化合反应的是A、镁条在空气中燃烧 B、蜡烛在空气中燃烧 C、植物的光合作用 D、加热暗紫色固体高锰酸钾