相关试卷
- 广东省茂名市2025-2026学年九年级上学期11月期中化学试题
- 广东省广州市白云区钟落潭2025-2026学年九年级上学期11月期中联考化学试题
- 海南省2025年中考化学试题
- 人教版化学九年级下册随堂练习第十单元课题2 《常见的酸和碱》(提升卷)
- 人教版化学九年级下册随堂练习第十单元课题2 《常见的酸和碱》(基础卷)
- 人教版化学九年级下册随堂练习第十单元课题1 《溶液的酸碱性》(提升卷)
- 人教版化学九年级下册随堂练习第十单元课题1 《溶液的酸碱性》(基础卷)
- 人教版化学九年级下册随堂练习第九单元课题3 《溶质的质量分数》(提升卷)
- 人教版化学九年级下册随堂练习第九单元课题3 《溶质的质量分数》(基础卷)
- 人教版化学九年级下册随堂练习第九单元课题2 《溶解度》(提升卷)
-
1、
某兴趣小组同学发现向过氧化氢溶液加入氧化铜( , 不溶于水)粉末后,瞬间产生大量气泡。小组同学对此进行探究。
【提出问题】该反应中和过氧化氢溶液分别起什么作用?
【作出猜想】猜想一:与过氧化氢溶液反应,产生气体。
猜想二:自身反应,产生气体,过氧化氢溶液做催化剂加速反应的进行。
猜想三:过氧化氢溶液自身反应,产生气体,做催化剂加速反应进行。
【进行实验】
(1)以上实验不完整,请将实验Ⅲ的实验过程补充完整:
实验
实验过程
实验现象
解释与结论
Ⅰ

带火星的木条均不复燃
常温下,过氧化氢溶液和氧化铜两者自身均不反应或反应较慢。
Ⅱ

带火星的木条复燃。
发生化学反应,产生大量氧气。
Ⅲ
待实验Ⅱ反应结束后, , 并重复此操作。
带火星的木条不复燃
过氧化氢溶液不是催化剂,猜想二错误。
Ⅳ
重复实验Ⅱ,待反应结束后,重新加入过氧化氢溶液,伸入带火星的木条,重复此操作。
带火星的木条均复燃
猜想三正确
(2)小明认为实验Ⅳ仍然不能证明猜想三正确,还需增加一个实验验证反应前后的不变,由此小组同学继续实验,才能得出“猜想三正确、猜想一错误”的结论。
【拓展延伸】小组同学继续对氧化铜和二氧化锰的催化效果进行对比探究。实验装置如图1所示。

按下表添加试剂,然后打开分液漏斗活塞,采集数据,得到图2所示的装置内压强–时间图像。
实验
抽滤瓶
抽滤瓶中盛放物质
分液漏斗盛放物质
1
①
无任何试剂
20mL4%的溶液
2
②
___________g粉末
20mL4%的溶液
3
③
0.2g粉末
20mL4%的溶液
(3)请补充以上表格中,实验2抽滤瓶中盛放物质g粉末。
(4)对比实验2和3,分析图2可得出的结论是。
(5)之后兴趣小组同学对催化剂展开了激烈的讨论并阐述自己的观点,以下观点正确的是。
a.二氧化锰是催化剂 b.催化剂在化学反应前后的质量和性质均不发生改变
c.催化剂就是加快某物质反应速率的物质 d.氧化铜可能是其他物质反应的催化剂
-
2、实验室常用到高锰酸钾固体和过氧化氢溶液来制取氧气,以下装置是制氧所需的化学实验仪器,请根据下列问题,利用所学化学知识作出回答:
 (1)、请指出A中装置名称:b:。(2)、用过氧化氢溶液和二氧化锰来制取较干燥的氧气时,可选发生装置和收集装置是(填序号)。(3)、用E装置收集氧气的依据是 , 检验其氧气是否集满的方法是。(4)、请写出实验室利用A装置制备氧气的文字表达式:。(5)、选用A与C制氧,最后两步实验操作①熄灭酒精灯②撤出导管,其顺序依次是(填序号)。
(1)、请指出A中装置名称:b:。(2)、用过氧化氢溶液和二氧化锰来制取较干燥的氧气时,可选发生装置和收集装置是(填序号)。(3)、用E装置收集氧气的依据是 , 检验其氧气是否集满的方法是。(4)、请写出实验室利用A装置制备氧气的文字表达式:。(5)、选用A与C制氧,最后两步实验操作①熄灭酒精灯②撤出导管,其顺序依次是(填序号)。 -
3、如图所示是工业上制取液氧的流程图,请回答下列问题。
 (1)、蒸发液态空气可分离出氧气和氮气,其原理是利用液氮和液氧的不同。(2)、氮气常用作灯泡填充气,是因为氮气的。(3)、氧气能供给呼吸,若使用如图装置给病人输氧,(填“a”或“b”)与蓝色钢瓶相连。
(1)、蒸发液态空气可分离出氧气和氮气,其原理是利用液氮和液氧的不同。(2)、氮气常用作灯泡填充气,是因为氮气的。(3)、氧气能供给呼吸,若使用如图装置给病人输氧,(填“a”或“b”)与蓝色钢瓶相连。
-
4、阅读以下材料,并回答下列问题:
利用氩氦刀治疗肿瘤
氩氦刀不是一般意义上的手术刀,而是一种低温冷冻微创治疗肿瘤的设备,其治疗过程利用氩气降温和氨气升温,因此被称为氩氦刀。大多数气体遭遇节流后温度将下降,如氩气和氧气。而某些气体,例如氢气和氮气,温度反而上升。
氩氮刀的制冷和加热原理是:当高压气体经针尖突然释放,进入较大空间时,随着压强突然降低,气体会使局部温度迅速降低或升高。氢气在针尖急速释放,可在几十秒内冷冻病变组织,使其温度降至-140℃至-160℃维持15min,关闭氩气,启动氮气;氦气在针尖急速释放,将使病变组织快速升温解冻,从而消除肿瘤。降温和升温的速度以及冷冻区域的大小与形状都可以进行精确设定和控制,而且氢氮刀没有化疗和放疗带来的副作用。
 (1)、氩氦刀的真空绝缘层能承受工作压力四倍的气压,说明该材料有很好的性能。(2)、氩和氦气都属于稀有气体,请写出稀有气体的另一种用途(写一点即可)。(3)、氩氦刀治疗肿瘤的优点之一是。
(1)、氩氦刀的真空绝缘层能承受工作压力四倍的气压,说明该材料有很好的性能。(2)、氩和氦气都属于稀有气体,请写出稀有气体的另一种用途(写一点即可)。(3)、氩氦刀治疗肿瘤的优点之一是。 -
5、为了探究分子运动现象和开展“测定空气里氧气含量”的探究活动,兴趣小组进行了以下实验。
 (1)、图1是按课本进行的实验,一段时间后,A烧杯中的酚酞溶液由无色变红色,由此说明分子具有的性质是。(2)、图2与图1相比,优点(写一条即可)。(3)、图3实验结束后,集气瓶中剩余气体具有的化学性质是。同学们利用如图3装置多次实验,水面均未上升到刻度“1”,原因可能是(写一点即可)。
(1)、图1是按课本进行的实验,一段时间后,A烧杯中的酚酞溶液由无色变红色,由此说明分子具有的性质是。(2)、图2与图1相比,优点(写一条即可)。(3)、图3实验结束后,集气瓶中剩余气体具有的化学性质是。同学们利用如图3装置多次实验,水面均未上升到刻度“1”,原因可能是(写一点即可)。 -
6、如图是探究氧气化学性质的实验。
 (1)、A中可观察到实验现象是:;B中水的作用是。(2)、请写出C装置中的文字表达式:。(3)、若C实验失败,可能的原因是(填序号)。
(1)、A中可观察到实验现象是:;B中水的作用是。(2)、请写出C装置中的文字表达式:。(3)、若C实验失败,可能的原因是(填序号)。①未打磨生锈的铁丝 ②铁丝在集气瓶中自上而下缓慢伸入
③铁丝绕在火柴上,火柴点燃后迅速伸入集气瓶 ④实验前集气瓶敞口放置了一段时间
-
7、某家快递公司在卸载时造成危险化学品氟乙酸甲酯()泄漏导致9人中毒。现收集到有关氟乙酸甲酯的信息:①氟乙酸甲酯是无色透明液体,②沸点为104.5℃;③可溶于酒精,不溶于水;④易燃,在空气中消耗氧气燃烧生成氟化氢、二氧化碳和水;⑤剧毒,有腐蚀性,刺激眼睛、呼吸系统和皮肤;⑥氟乙酸甲酯在燃料、医药、农药等领域有广泛的用途,是制造抗肿瘤药物和抗菌药物的原料。(1)、根据上述内容可归纳出氟乙酸甲酯的物理性质有(填序号)。(2)、按照我国国家邮政局规定氟乙酸甲酯等这类物品不得邮递,通过阅读上述资料,分析其原因为(至少答两点);应避免与人体直接接触,接触时正确处理的方法是。
-
8、兴趣小组用图甲所示装置探究不同催化剂对过氧化氢分解的催化效果。取大小相同的新鲜土豆块和新鲜猪肝块作催化剂,分别加入10mL相同浓度的过氧化氢稀溶液后,用传感器测量装置中气压的变化,如图乙中曲线a、b所示。下列说法正确的是
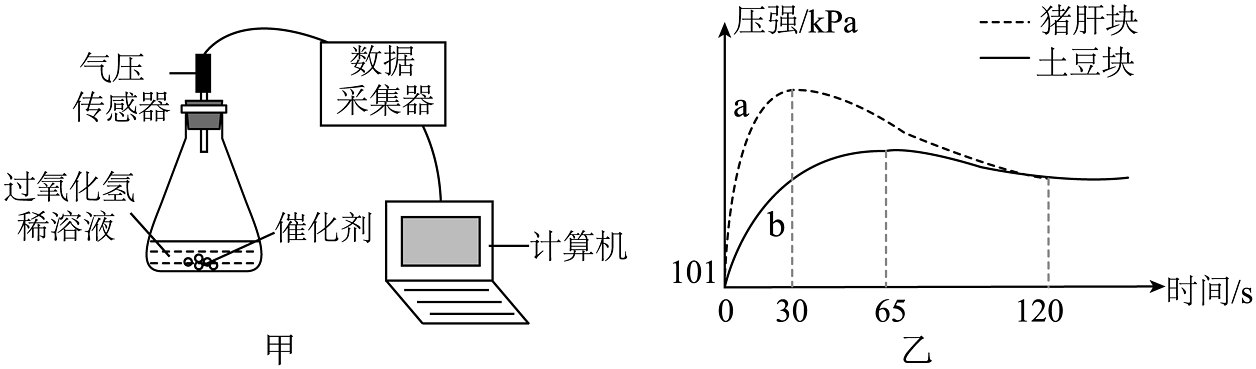 A、两种催化剂中催化效率更高的是土豆块 B、后期压强减小说明过氧化氢分解时会放出热量 C、加猪肝块催化的过氧化氢完全反应所用的时间大约是120s D、30s时曲线a的压强高于65s时曲线b,说明加猪肝块比加土豆块催化其完全反应产生氧气更多
A、两种催化剂中催化效率更高的是土豆块 B、后期压强减小说明过氧化氢分解时会放出热量 C、加猪肝块催化的过氧化氢完全反应所用的时间大约是120s D、30s时曲线a的压强高于65s时曲线b,说明加猪肝块比加土豆块催化其完全反应产生氧气更多 -
9、利用如图装置进行“硫燃烧”的实验,步骤Ⅰ:向弯形具支试管中鼓入空气,同时用酒精灯给硫粉加热至燃烧;步骤Ⅱ:停止鼓入空气,分别用酒精灯给高锰酸钾和硫粉加热。关于该实验说法不正确的是
 A、步骤Ⅰ中硫粉在空气中燃烧发出微弱的淡蓝色火焰 B、高锰酸钾的作用是提供氧气 C、气球的主要作用是收集二氧化硫,防止污染空气 D、步骤Ⅰ和步骤Ⅱ中硫粉燃烧生成的产物不同
A、步骤Ⅰ中硫粉在空气中燃烧发出微弱的淡蓝色火焰 B、高锰酸钾的作用是提供氧气 C、气球的主要作用是收集二氧化硫,防止污染空气 D、步骤Ⅰ和步骤Ⅱ中硫粉燃烧生成的产物不同 -
10、下列基本实验操作中,正确的是A、添加酒精
 B、给液体加热
B、给液体加热 C、废液处理
C、废液处理 D、放置洗净的试管
D、放置洗净的试管
-
11、硫在氧气中燃烧的实验中,在集气瓶中放一些水的目的是。
-
12、根据下图回答问题。
 (1)、图1所示元素对应的原子结构示意图是图2中的(选填序号,下同)。(2)、图2中,属于同种元素的是;具有相对稳定结构的是;C所表示的粒子的核外电子数是个。(3)、图2中的B所示粒子是(选填“原子”,“阳离子”或“阴离子”)。
(1)、图1所示元素对应的原子结构示意图是图2中的(选填序号,下同)。(2)、图2中,属于同种元素的是;具有相对稳定结构的是;C所表示的粒子的核外电子数是个。(3)、图2中的B所示粒子是(选填“原子”,“阳离子”或“阴离子”)。 -
13、根据图像,完成下列问题
 (1)、倾倒液体时,细口瓶贴标签的一面要朝向 , 瓶塞要在桌面上。(2)、用酒精灯加热时,试管口不能对着任何人,用酒精灯灯焰的(选填“外焰”“内焰”或“焰心”)对准试剂所在部位加热。(3)、图1是检查装置气密性的方法:连接好仪器后,先将导管的一端浸入水中,再用手紧握试管,若观察到导管口 , 松开手后,导管中有水柱上升,说明装置不漏气。(4)、图2所示是用量筒量取一定体积液体的操作,则所取液体的实际体积与读数相比会(填“偏大”“偏小”或“相等”)。
(1)、倾倒液体时,细口瓶贴标签的一面要朝向 , 瓶塞要在桌面上。(2)、用酒精灯加热时,试管口不能对着任何人,用酒精灯灯焰的(选填“外焰”“内焰”或“焰心”)对准试剂所在部位加热。(3)、图1是检查装置气密性的方法:连接好仪器后,先将导管的一端浸入水中,再用手紧握试管,若观察到导管口 , 松开手后,导管中有水柱上升,说明装置不漏气。(4)、图2所示是用量筒量取一定体积液体的操作,则所取液体的实际体积与读数相比会(填“偏大”“偏小”或“相等”)。 -
14、写出下列反应的文字表达式(1)、硫与氧气反应;(2)、磷与氧气反应;(3)、铁丝与氧气反应;(4)、高锰酸钾制氧气;(5)、过氧化氢制氧气。
-
15、在横线上写出对应仪器的名称
 ;
; ;
; ;
; ;
; 。
。 -
16、用下列观点①分子间有间隔 ②分子在不断运动 ③温度越高,分子运动速度越快 ④分子数目增多,解释有关现象,在对应位置填写正确序号。(1)、湿衣服变干;(2)、品红在热水中比在冷水中扩散快;(3)、篮球充气鼓起;(4)、水变成水蒸气。
-
17、写出与下列元素相对应的元素符号
氢;镁;铁;磷;氧。
-
18、下列关于氧气的说法错误的是A、氧气能支持燃烧,具有可燃性 B、氧气不易溶于水 C、氧气的密度略大于空气 D、氧气能供给呼吸,常用于医疗急救
-
19、下列各图中“○”“●”分别表示不同元素的原子,则其中表示纯净物的是A、
 B、
B、 C、
C、 D、
D、
-
20、下列物质中,含有氧分子的是A、空气 B、二氧化锰 C、四氧化三铁 D、二氧化碳