相关试卷
- 河北省保定市2025-2026学年高三上学期11月期中化学试题
- 江苏省苏州市吴江区震泽中学2025-2026学年高二上学期9月月考化学试题
- 江苏省如皋中学2025-2026学年高三上学期测试(一)化学试题
- 四川省泸州市泸县第五中学2025-2026学年高一上学期10月月考 化学试题
- 广西壮族自治区来宾市多校2025-2026学年高二上学期11月期中联考 化学试题
- 江苏省苏州市吴江区汾湖高级中学2025-2026学年高二上学期9月月考化学试题
- 北京市第八十中学2025-2026学年高三上学期9月月考化学试题
- 贵州省铜仁市思南中学2025-2026学年高三上学期10月月考 化学试题
- 江苏省苏州市园区苏州大学附属中学2025-2026学年高一上学期10月月考化学试题
- 广西来宾市2025-2026学年高一上学期9月月考 化学试题
-
1、
I.按要求完成下列填空。
(1)俗称________。
(2)写出甘油的结构简式________。
II.中学常见的四种元素A、D、E、W,原子序数依次增大,A的原子最外层电子数是次外层的2倍,D的氧化物属于两性氧化物,位于同周期,的原子最外层电子数之和为是人体必需的微量元素,缺乏W会导致贫血症状。
(3)A在元素周期表中的位置是________。
(4)D、E最高价氧化物对应的水化物相互反应的离子方程式________。
(5)下列说法不正确的是_______(填字母序号)。
A. D的最高价氧化物对应水化物的碱性弱于 B. A形成的氢化物中只含有极性键 C. 配制的溶液通常需加些单质 D. 工业上用与E的氢化物的浓溶液来制备E单质 (6)W的单质可用于处理酸性废水中的 , 使其转换为 , 同时生成有磁性的W的氧化物X,再进行后续处理。上述反应的离子方程式为________。
-
2、下列实验方案设计、现象和结论均正确的是
实验方案
实验现象
实验结论
A
把通入含酚酞的氢氧化钠溶液
红色褪去
具有漂白性
B

左边棉球变为橙色,右边棉球变为蓝色
非金属性:
C
取溶液,滴加溶液,充分反应后,滴加KSCN溶液
溶液变红
与反应是可逆的
D
向溶液中加入一小块钠
产生无色气泡,溶液底部有蓝色沉淀生成
Na不能从溶液置换出铜
A、A B、B C、C D、D -
3、下列对图示的解释不正确的是


A.该装置可比较硫、碳、硅三种元素的非金属性强弱
B.b时刻导电能力增强,溶液中含较多的Ba2+和OH-


C.NaCl固体在水中形成水合离子
D.可能是HClO分解使溶液pH降低
A、A B、B C、C D、D -
4、某有机物结构简式如图所示,关于该有机物,下列叙述不正确的是
 A、该化合物能发生加成、还原、氧化、取代和加聚反应 B、该有机物能使酸性高锰酸钾和溴水褪色,且原理不相同 C、1 mol该有机化合物能消耗2 molNaOH D、1 mol该有机物分别与足量的钠、碳酸氢钠反应生成气体的物质的量不相同
A、该化合物能发生加成、还原、氧化、取代和加聚反应 B、该有机物能使酸性高锰酸钾和溴水褪色,且原理不相同 C、1 mol该有机化合物能消耗2 molNaOH D、1 mol该有机物分别与足量的钠、碳酸氢钠反应生成气体的物质的量不相同 -
5、标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下[已知和的相对能量为0],下列说法不正确的是
 A、 B、历程II中,ClO是中间产物 C、相同条件下,该反应的总反应速率:历程历程II D、可计算键能为
A、 B、历程II中,ClO是中间产物 C、相同条件下,该反应的总反应速率:历程历程II D、可计算键能为 -
6、某温度下,在2 L恒容密闭容器中投入一定量的 , 发生反应: , 时生成C的物质的量为0.8 mol(反应进程如图所示)。下列说法中正确的是
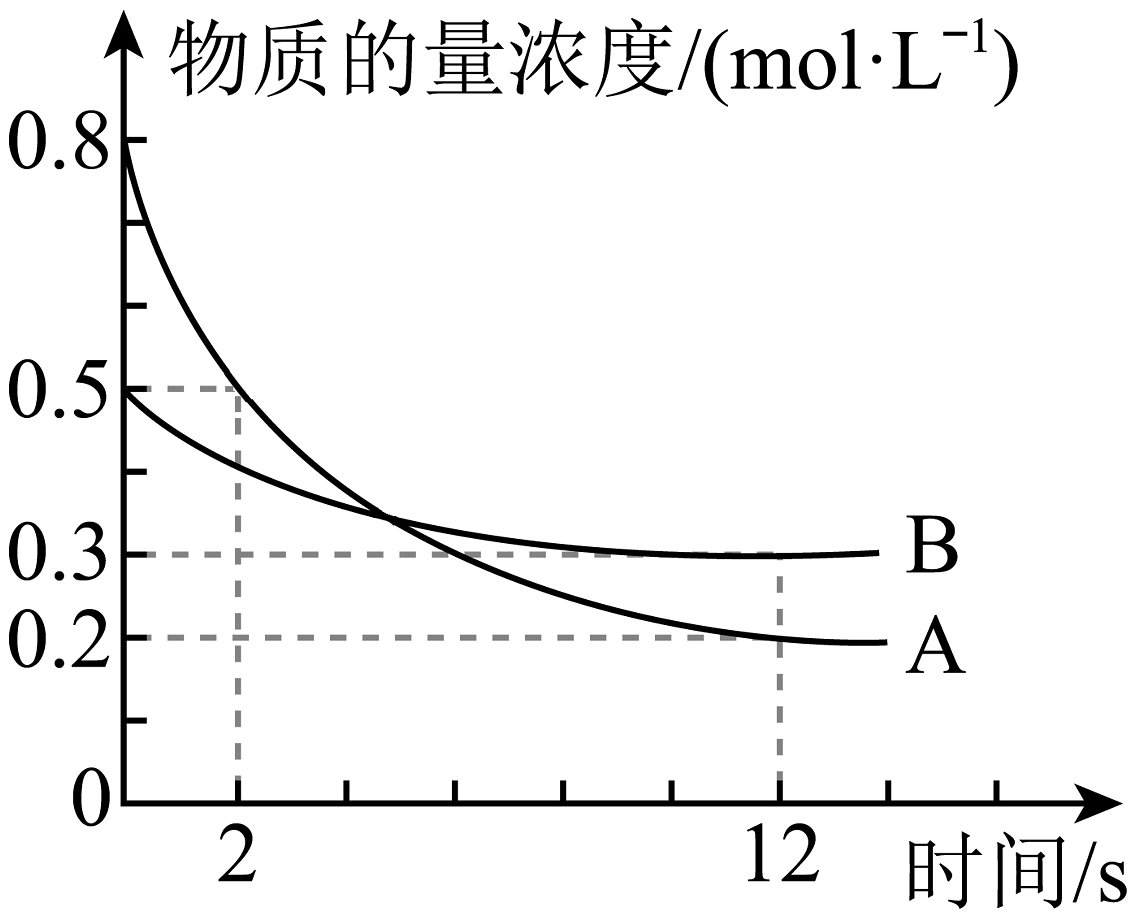 A、2 s时B的转化率为 B、内,D的平均反应速率为 C、化学计量系数之比 , 且 D、图中两曲线相交时,A的消耗速率大于A的生成速率
A、2 s时B的转化率为 B、内,D的平均反应速率为 C、化学计量系数之比 , 且 D、图中两曲线相交时,A的消耗速率大于A的生成速率 -
7、已知对应的反应中已省略,且];下列说法正确的是
 A、 B、的值是的燃烧热 C、 D、稳定性:正丁烷>异丁烷
A、 B、的值是的燃烧热 C、 D、稳定性:正丁烷>异丁烷 -
8、下列热化学方程式,不正确的是A、4g固体硫完全燃烧生成 , 放出37kJ热量: B、与在某密闭容器中反应放出73kJ热量,则反应的热化学方程式为: C、甲烷的标准燃烧热为 , 则甲烷燃烧的热化学方程式可表示为: D、强酸强碱的中和热为 , 则
-
9、纸电池由电极、电解液和隔离膜组成(如下图所示),电极和电解液均“嵌”在纸中。某学生根据纸电池的结构示意图,利用氯化钠、蒸馏水和滤纸制备了电解液和隔离膜,用铜片与锌片制作了一个简易电池,用电流表测试指针发生偏转(总反应为)。下列说法不正确的是
 A、该原电池电解液是NaCl溶液 B、纸电池减小电板间距离,可增大电流 C、电子从锌片经电解液流向铜片 D、Zn片为负极,正极电极反应为O2+4e-+2H2O=4OH-
A、该原电池电解液是NaCl溶液 B、纸电池减小电板间距离,可增大电流 C、电子从锌片经电解液流向铜片 D、Zn片为负极,正极电极反应为O2+4e-+2H2O=4OH- -
10、在某澄清透明的酸性溶液中,能大量共存的离子组是A、 B、 C、 D、
-
11、已知:某些化学键的键能数据如表所示(注:键能为气态分子完全解离成气态原子所吸收的能量。)
化学键
键能/()
436
243
431
255
339
下列说法正确的是
A、同温同压下,反应在光照和点燃条件下的不同 B、该反应过程中反应物断键吸收的能量大于生成物成键放出的能量 C、 D、分解吸收的热量比分解吸收的热量多,所以比稳定 -
12、下列方程式中,不正确的是A、一水合氨的电离: B、工业制取漂白粉: C、用溶液腐蚀铜箔制造印刷电路板: D、铝制品不能储存氢氧化钠溶液:
-
13、下列说法不正确的是A、在医疗上可作为“钡餐” B、医学上常用于杀菌消毒的物质是75%乙醇溶液 C、铵盐是农业上常用的化肥,如硫酸铵、碳酸氢铵、硝酸铵等 D、胆矾可以和石灰乳混合制成一种常用的农药——波尔多液
-
14、下列化学用语正确的是A、HClO的结构式: B、的电子式:
 C、结构示意图:
C、结构示意图: D、用电子式表示HCl形成过程:
D、用电子式表示HCl形成过程:
-
15、可降解聚合物P的合成路线如下

已知:

(1)A的含氧官能团名称是。
(2)羧酸a的电离方程是。
(3)B→C的化学方程式是。
(4)化合物D苯环上的一氯代物有2种,D的结构简式是。
(5)E→F中反应①和②的反应类型分别是。
(6)F的结构简式是。
(7)聚合物P的结构简式是。
-
16、有一混合溶液,溶质只可能提供以下离子中的若干种:、、、、、、。现取三份该混合溶液进行如下实验:
实验①:向第一份混合溶液中加入溶液,有沉淀产生;
实验②:向第二份混合溶液中加入足量溶液,加热,收集到(标准状况)气体;
实验③:向第三份混合溶液中加入足量溶液,得到干燥沉淀 , 经足量稀盐酸洗涤、干燥后,沉淀质量为。
根据上述实验,回答以下问题:
(1)、由实验①推断该混合溶液中(填“一定”或“不一定”)含有。(2)、由实验②推断该混合溶液中含有(填离子符号),其物质的量浓度为 , 有关的离子反应方程式为。(3)、综合上述实验不存在的阳离子是(填离子符号,下同),该混合溶液中(填“一定”或“不一定”)含有 , 若一定存在有 , 则的物质的量浓度取值范围是。(4)、写出实验③中加稀盐酸洗涤时发生反应的离子方程式:。 -
17、实验室利用废旧电池的铜帽(主要成分为Cu、Zn)制备CuSO4·5H2O的部分实验步骤如图:

下列说法不正确的是
A、“溶解Ⅰ”中,为加快溶解速率,可将铜帽粉碎 B、“滤液Ⅰ”中,溶质的主要成分为ZnSO4 C、“溶解Ⅱ”过程中,有大量的气体产生 D、“操作Ⅰ”是将溶液直接加热蒸干得到CuSO4·5H2O晶体 -
18、下列离子方程式书写正确的是A、铝片放入过量氢氧化钠溶液中, B、向溶液中加入足量溶液: C、向溶液中滴入少量溶液: D、将过氧化钠加入水中:
-
19、用下列装置进行分离提纯,主要利用的性质与物质溶解性无关的是
A
B
C
D




从海水中获得蒸馏水
获取苯甲酸晶体
去除粗盐中的泥沙
用CCl4提取碘水中的I2
A、A B、B C、C D、D -
20、下列实验的现象与对应解释不正确的是
选项
操作
现象
解释
A
将少量粉末加热
有液滴和气体产生
易分解
B
常温下将片放入浓硝酸中
无明显变化
Al与浓硝酸不反应
C
分别将一小块放入无水乙醇和水中
钠与水反应更剧烈
水分子中的氢原子比乙醇羟基中的氢原子活泼
D
将铝箔在酒精灯火焰上灼烧
铝箔熔化但不滴落
氧化铝的熔点高于铝
A、A B、B C、C D、D