-
1、全钒液流电池是一种以钒为活性物质呈循环流动液态的氧化还原电池,其充电时工作原理如图所示。下列说法正确的是( )
 A、充电时,电极a与电源的正极相连,发生还原反应 B、放电时总反应为 C、充电一段时间后,右侧电解液的pH降低 D、放电时,电路中转移1mole- , 则有1molH+由右侧移向左侧
A、充电时,电极a与电源的正极相连,发生还原反应 B、放电时总反应为 C、充电一段时间后,右侧电解液的pH降低 D、放电时,电路中转移1mole- , 则有1molH+由右侧移向左侧 -
2、向2L恒容密闭容器中加入 , 发生反应 , 实验测得N的物质的量在不同温度下随时间的变化如图所示,下列有关说法中正确的是( )
 A、该反应的 B、温度下,0~2min内,v(M)=0.3mol·L-1·min-1 C、温度下,达到平衡后,R的体积分数大于30% D、温度下,2min后,再充入0.4molR和0.4molM,平衡逆向移动
A、该反应的 B、温度下,0~2min内,v(M)=0.3mol·L-1·min-1 C、温度下,达到平衡后,R的体积分数大于30% D、温度下,2min后,再充入0.4molR和0.4molM,平衡逆向移动 -
3、W、X、Y、Z为原子序数依次增大的短周期主族元素,X和Z同主族,基态W原子和Y原子的价层电子数相同,W与X的质子数之和为16。由W、X、Y三种元素组成的一种可应用于阻燃材料和生物材料的化合物M的结构如图所示。下列说法正确的是( )
 A、简单离子半径:Z>Y>W>X B、最简单氢化物的稳定性:W>X>Y C、氧化物对应的水化物的酸性:W>Y>Z D、WX3和YZ3的空间结构均为三角锥形
A、简单离子半径:Z>Y>W>X B、最简单氢化物的稳定性:W>X>Y C、氧化物对应的水化物的酸性:W>Y>Z D、WX3和YZ3的空间结构均为三角锥形 -
4、下列实验操作正确且能达到目的的是( )




A.除去碱式滴定管中的气泡
B.测定稀盐酸与稀氢氧化钠溶液反应的反应热
C.直接加热Na2SO3溶液制取Na2SO3晶体
D.在Fe片上镀铜
A、A B、B C、C D、D -
5、人工合成氨是重要的固氮方式,设NA为阿伏加德罗常数的值,下列说法正确的是( )A、标准状况下,22.4LN2中含有的π键数为2NA B、1mol基态N原子含有的价层电子数为3NA C、常温常压下,17gNH3中含有的非极性共价键数为3NA D、1molN2与足量H2充分反应,生成的NH3分子数为2NA
-
6、味精能增加食品的鲜味,是一种常用的增味剂,其化学名称为谷氨酸钠(结构如图所示),下列有关谷氨酸钠的说法正确的是( )
 A、所有原子均满足8电子结构 B、所有碳原子均采用sp3杂化 C、既可形成分子间氢键又可形成分子内氢键 D、常温下,可溶于水是因为存在C—H极性共价键
A、所有原子均满足8电子结构 B、所有碳原子均采用sp3杂化 C、既可形成分子间氢键又可形成分子内氢键 D、常温下,可溶于水是因为存在C—H极性共价键 -
7、在2L的恒容密闭容器中同时进行下列两个可逆反应:①;②。下列叙述不能说明容器内的反应达到平衡状态的是( )A、容器内压强不再发生变化 B、容器内气体的密度不再发生变化 C、CH3OH的体积分数不再发生变化 D、单位时间内,消耗的CO与生成的O2的物质的量之比为1∶1
-
8、已知有3种基态元素原子的核外电子排布式:①②③ , 下列说法错误的是( )A、①与②可组成空间结构为正四面体形的化合物 B、电负性:②>①>③ C、第一电离能:①>③>② D、三种元素均位于p区
-
9、化学与生产、生活密切相关,下列说法正确的是( )A、Na2CO3溶液可用来去除锅炉水垢中的CaSO4 B、工业上燃烧煤时,加入少量石灰石可减少温室气体的排放 C、工业上通常采用在400~500℃下合成氨是因为该反应是吸热反应 D、氢氧化钡晶体与氯化铵的反应理论上可设计成原电池
-
10、下列化学用语使用正确的是( )A、中子数为17的P原子为 B、水的空间结构为
 C、H2O2的电子式为
C、H2O2的电子式为 D、基态S原子的价层电子轨道表示式为
D、基态S原子的价层电子轨道表示式为
-
11、抗坏血酸(结构如图所示)是水果罐头中常用的抗氧化剂,下列说法正确的是( )
 A、基态氧原子的未成对电子数为3 B、抗坏血酸分子中不存在手性碳原子 C、抗坏血酸分子中含有极性键和非极性键 D、碳原子中,2p、3p能级中的轨道数依次增多
A、基态氧原子的未成对电子数为3 B、抗坏血酸分子中不存在手性碳原子 C、抗坏血酸分子中含有极性键和非极性键 D、碳原子中,2p、3p能级中的轨道数依次增多 -
12、下列过程中,的是( )A、碳酸氢钠分解 B、氧化钙溶于水 C、石灰石分解 D、稀盐酸与NaHCO3反应
-
13、保护甲午海战致远舰,控制海水腐蚀至关重要。我国水下考古队员们潜入海底,把30公斤重的锌块固定在致远舰残存的铁甲表面。下列说法错误的是( )
 A、致远舰在海水中主要发生电化学腐蚀 B、时间久了,锌块质量会越来越小 C、该法利用了牺牲阳极法的原理 D、将锌块换成铜块也能达到相同目的
A、致远舰在海水中主要发生电化学腐蚀 B、时间久了,锌块质量会越来越小 C、该法利用了牺牲阳极法的原理 D、将锌块换成铜块也能达到相同目的 -
14、ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2 , 成为自来水的消毒剂。已知ClO2是一种易溶于水的气体,实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应:2NaClO2+Cl2=2ClO2+2NaCl,下图是实验室用于制备和收集一定量纯净的ClO2的装置(某些夹持装置和垫持用品已省略),其中E用于除去ClO2中的未反应的Cl2。
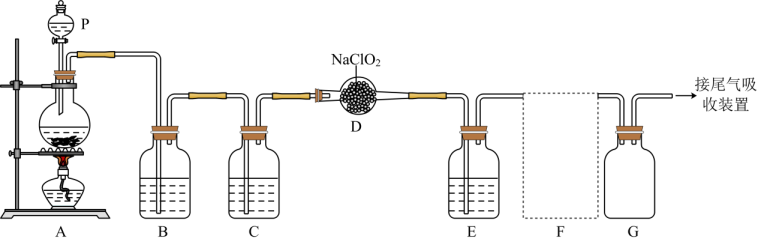 (1)、仪器P的名称是。(2)、写出装置A中烧瓶内发生反应的离子方程式:。(3)、B装置中所盛试剂是。(4)、F为ClO2收集装置,应选用的装置是(填序号),其中与E装置导管相连的导管口是(填接口字母)。
(1)、仪器P的名称是。(2)、写出装置A中烧瓶内发生反应的离子方程式:。(3)、B装置中所盛试剂是。(4)、F为ClO2收集装置,应选用的装置是(填序号),其中与E装置导管相连的导管口是(填接口字母)。 (5)、ClO2的另一种制备方法是用氯酸钠(NaClO3)与浓盐酸反应,同时生成Cl2。
(5)、ClO2的另一种制备方法是用氯酸钠(NaClO3)与浓盐酸反应,同时生成Cl2。①请写出该反应的化学方程式: , 每消耗319.5gNaClO3 , 生成L氯气(标况下)。(M(NaClO3)=106.5)。
②浓盐酸在该反应中表现出来的性质是(填序号)。
A. 只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
-
15、某磁铁矿石A的主要成分是磁性氧化铁(Fe3O4),还含少量的Al2O3、Cu2O。某工厂利用此矿石进行有关物质的回收利用,其中F为常见的补铁剂,工艺流程如图(已知Cu2O不溶于水和碱,但溶于强酸:Cu2O+2H+=Cu+Cu2++H2O)。根据流程回答下列问题:
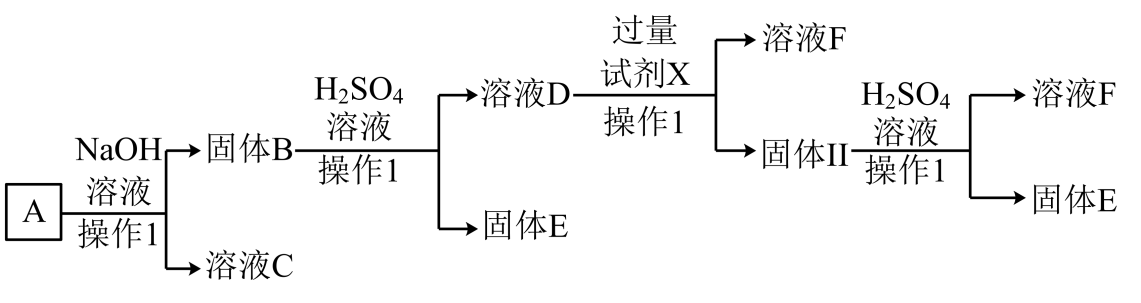 (1)、溶液C的溶质主要是 , 铝离子的结构示意图为。(2)、溶液D与过量试剂X反应的离子方程式是、。(3)、在溶液F中滴加NaOH溶液的现象是。(4)、操作1的名称为。(5)、已知E为红色固体,写出证明E中无Cu2O的方法:(写出实验操作与现象)。
(1)、溶液C的溶质主要是 , 铝离子的结构示意图为。(2)、溶液D与过量试剂X反应的离子方程式是、。(3)、在溶液F中滴加NaOH溶液的现象是。(4)、操作1的名称为。(5)、已知E为红色固体,写出证明E中无Cu2O的方法:(写出实验操作与现象)。 -
16、下列编号代表元素周期表中的一部分元素,用化学用语回答下列问题:
 (1)、碳元素在周期表中的位置为 , 它的最高价氧化物的电子式为。(2)、①④形成的化合物的化学键类型为 , ③⑧形成的化合物的电子式为 ,
(1)、碳元素在周期表中的位置为 , 它的最高价氧化物的电子式为。(2)、①④形成的化合物的化学键类型为 , ③⑧形成的化合物的电子式为 ,④形成的单质的结构式为。
(3)、②⑥的最高价氧化物的水化物发生反应的离子方程式为。(4)、⑧⑨简单氢化物的稳定性较强的是(写简单氢化物的化学式),⑤单质的氧化性比⑦的强,请从原子结构的角度解释其原因:。(5)、现拟用如下装置,证明元素的非金属性强弱:S>C,请选用合适的试剂完成实验。
实验试剂
甲:;乙:;丙(均填试剂的化学式)
可得出结论的实验现象
-
17、学以致用是学习化学的动力和源泉,掌握化学知识有助于我们更好地认识世界。回答下列问题:(1)、云、雾属于胶体,鉴别胶体和溶液的方法是 , 胶体和溶液的本质区别是。(2)、生铁是(填“混合物”或“化合物”)。通常合金的熔点(填“高于”或“低于”)其组成单质的熔点。(3)、ClO2是一种新型含氯消毒剂,已经用于自来水消毒。实验室可通过以下反应制得:。产生1molClO2时,转移电子的物质的量为mol;该反应中的还原剂是(填化学式)。(4)、在标准状况下,由CO2和CO组成的混合气体的密度是H2的19倍,则两者体积比V(CO2):V(CO)=。(5)、Ba(OH)2溶液中滴入浓度相等的NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。从开始到a点总的离子方程式是 , 从a点到b点反应的离子方程式是 , 解释b点之后导电能力上升的原因:。

-
18、某工厂的工业废水中含有大量的和较多的。为减少污染并变废为宝,工厂计划从该废水中回收金属铜,并制备 , 流程如下:

下列说法正确的是( )
A、甲为铁粉,乙为溶液 B、操作1和操作2均用到漏斗、烧杯和玻璃棒,且固体2为铜 C、往溶液1与溶液2中加入反应生成NO,欲制备1.5mol , 理论上至少需要2mol D、为检验中是否含有 , 加入盐酸溶解,再加入过量NaOH溶液,观察沉淀颜色变化 -
19、某同学欲配制100mL 溶液。以下操作①~④是其配制过程及示意图,关于该配制过程,下列说法正确的是( )
 A、操作①中,称取2.5g胆矾晶体,并于烧杯中加水溶解 B、操作②中,容量瓶使用前需用自来水、蒸馏水洗涤,干燥后才可用 C、操作③为定容,若仰视,将导致所配溶液浓度偏高 D、操作④摇匀后静置,发现液面低于刻度线,继续加水至凹液面与刻度线相切
A、操作①中,称取2.5g胆矾晶体,并于烧杯中加水溶解 B、操作②中,容量瓶使用前需用自来水、蒸馏水洗涤,干燥后才可用 C、操作③为定容,若仰视,将导致所配溶液浓度偏高 D、操作④摇匀后静置,发现液面低于刻度线,继续加水至凹液面与刻度线相切 -
20、以不同类别物质间的转化为线索,认识钠及其化合物。
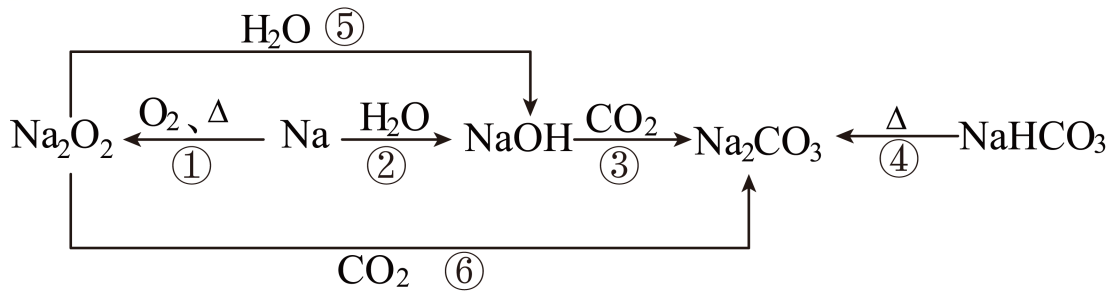
下列分析不正确的是( )
A、反应③表明CO2具有酸性氧化物的性质 B、反应④说明NaHCO3的热稳定性强于Na2CO3 C、反应⑤、⑥可用于潜水艇中氧气的供给 D、上述转化中发生的反应有分解反应、化合反应、置换反应