-
1、室温下,下列各组离子在指定溶液中可能大量共存的是( )A、水电离出的的溶液中:、、、 B、加入铝粉能放出氢气的溶液中:、、 C、透明的溶液中:、、、 D、溶液:、、、
-
2、二氧化氯泡腾片是常用的鱼缸消毒剂,也可用于除居室甲醛,其反应方程式可表示为: , 下列说法不正确的是( )A、甲醛具有还原性 B、二氧化氯是氧化剂,还原产物为 C、反应生成 , 则转移4mol电子 D、若将二氧化氯改为次氯酸钠,消耗等量甲醛所需与的物质的量之比为
-
3、下列设计正确且能实现实验目的的是( )
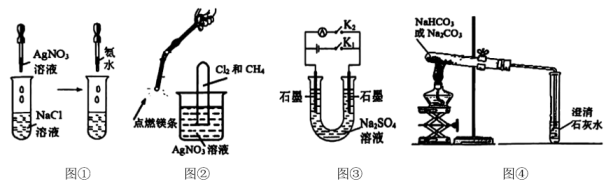 A、图①,验证可溶于氨水 B、图②,验证氯气和甲烷反应生成了 C、图③,闭合一段时间,再打开闭合可制得简易燃料电池,左侧石墨为电池负极 D、图④,分别加热不能证明分解温度高于
A、图①,验证可溶于氨水 B、图②,验证氯气和甲烷反应生成了 C、图③,闭合一段时间,再打开闭合可制得简易燃料电池,左侧石墨为电池负极 D、图④,分别加热不能证明分解温度高于 -
4、物质的性质决定用途,下列两者对应关系不正确的是( )A、二氧化硫具有漂白性,食品中添加适量的SO2有防腐和抗氧化作用 B、氯化铁溶液有氧化性,可用于蚀刻不锈钢广告牌上的图形 C、生铁硬度大,抗压性强,可用于铸造机器底座 D、新型陶瓷碳化硅(SiC)硬度很大,可用作砂纸和砂轮的磨料
-
5、碳酸钠和碳酸氢钠在生产生活中有广泛的应用.下列有关说法不合理的是( )A、通过化合反应可由碳酸钠制得碳酸氢钠 B、可用碳酸钠溶液处理锅炉水垢中的硫酸钙: C、向浓度均为和溶液中分别滴加浓的溶液,只有碳酸钠溶液产生白色沉淀 D、碳酸钠溶液和碳酸氢钠溶液都显碱性,均可用作食用碱
-
6、下列化学用语表示合理的是( )A、氮的基态原子的价电子排布图:
 B、异戊二烯的键线式为:
B、异戊二烯的键线式为: C、乙醛分子空间填充模型为:
C、乙醛分子空间填充模型为: D、中键的电子云轮廓图:
D、中键的电子云轮廓图:
-
7、下列常见物质中,不属于碱性氧化物的是( )A、 B、 C、 D、
-
8、高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.其生产工艺流程如下:

请回答下列问题:
(1)、写出向KOH溶液中通入足量Cl2发生反应的离子方程式 .(2)、在溶液I中加入KOH固体的目的是____(填编号).A、为下一步反应提供碱性的环境 B、使KClO3转化为KClO C、与溶液I中过量的Cl2继续反应,生成更多的KClO D、KOH固体溶解时会放出较多的热量,有利于提高反应速率(3)、从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3 , KCl,则反应③中发生的离子反应方程式为 . 每制得59.4克K2FeO4 , 理论上消耗氧化剂的物质的量为 mol.(4)、高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式: + H2O= Fe(OH)3(胶体)+O2↑+OH﹣ . -
9、二氧化碳加氢制甲醇和甲烷重整对碳资源利用具有重要的战略意义。回答下列问题:
Ⅰ.CO2加氢选择合成甲醇的主要反应如下:
①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH1(298K)
②CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2(298K)
③CO(g)+2H2(g)⇌CH3OH(g)ΔH3(298K)
 (1)、在一定温度下,由最稳定单质生成1mol某物质的焓变叫做该物质的标准摩尔生成焓,如表为298K时几种物质的标准摩尔生成焓(ΔfHmθ)。
(1)、在一定温度下,由最稳定单质生成1mol某物质的焓变叫做该物质的标准摩尔生成焓,如表为298K时几种物质的标准摩尔生成焓(ΔfHmθ)。物质
H2(g)
O2(g)
CO(g)
CO2(g)
H2O(g)
CH3OH(g)
ΔfHmθ(kJ•mol﹣1)
0
0
﹣110.5
﹣393.5
﹣241.8
﹣201.2
有利于反应①自发进行的条件是 (填“高温”或“低温”),ΔH2(298K)=kJ•mol﹣1 , 有利于提高甲醇平衡产率的措施有 (至少回答2条)。
(2)、反应②的反应速率v=v正﹣v逆=k正c(CO2)c(H2)﹣k逆cm (CO)cn (H2O),其中k正、k逆分别为正、逆反应速率常数。该反应的平衡常数K= , 则m= , 升高温度时lgk正﹣lgk逆(填“增大”、“减小”或“不变”)。(3)、Ⅱ.甲烷重整工艺主要包括甲烷水蒸气重整制氢、甲烷部分氧化重整制氢、甲烷二氧化碳重整制氢、甲烷三重整制氢等。甲烷三重整制氢的逆反应3H2(g)+CO(g)⇌CH4(g)+H2O(g)。若将H2与CO按物质的量之比3:1加入反应装置,在不同条件下达到平衡时甲烷的物质的量分数为x(CH4),在t=250℃条件下x(CH4)与p的关系、在p=5×105Pa条件下x(CH4)与t的关系如图a所示。当CO的平衡转化率为时,反应条件可能是 ;图a中能表示相同状态下、相同平衡状态的点是 。210℃时,甲烷三重整制氢反应的在该温度下,反应的标准平衡常数Kθ=[已知:分压=总压×该组分物质的量分数,对于反应dD(g)+eE(g)⇌gG(g)+hH(g),Kθ=
 , 其中pθ=100kPa,PG、PH、PD、PE为各组分的平衡分压]。甲烷三重整制氢工业一般将反应温度设置为750~920℃,将反应压力设置为2~3MPa,并向转化炉内通入空气或氧气,通入空气或氧气的目的是 。(4)、同时进行甲烷与二氧化碳的重整反应制备合成气是当前的研究热点,反应为④CH4+CO2═2CO+2H2 , 该反应的Arrhenius经验公式实验数据如图b所示,已知Arrhenius经验公式Rlnk=﹣+C(Ea为活化能,k为速率常数,R和C为常数)。反应④的逆反应活化能为 kJ•mol﹣1。(用含“x1、y1、x2、y2”的式子表示)
, 其中pθ=100kPa,PG、PH、PD、PE为各组分的平衡分压]。甲烷三重整制氢工业一般将反应温度设置为750~920℃,将反应压力设置为2~3MPa,并向转化炉内通入空气或氧气,通入空气或氧气的目的是 。(4)、同时进行甲烷与二氧化碳的重整反应制备合成气是当前的研究热点,反应为④CH4+CO2═2CO+2H2 , 该反应的Arrhenius经验公式实验数据如图b所示,已知Arrhenius经验公式Rlnk=﹣+C(Ea为活化能,k为速率常数,R和C为常数)。反应④的逆反应活化能为 kJ•mol﹣1。(用含“x1、y1、x2、y2”的式子表示) -
10、含氮废水进入水体中对环境造成的污染越来越严重.(1)、(一)某校环保小组的同学认为可以用金属铝将水中的NO3﹣还原成N2 , 从而消除氮污染.
配平以下有关的离子反应方程式:NO3﹣+Al+H2O→N2↑+Al(OH)3+OH(2)、以上反应中失电子的物质是 , 还原产物是 , 每生成1mol还原产物,转移的电子数目为 .(3)、现需除去1m3含氮0.3mol的废水中的NO3﹣ (设氮元素都以NO3﹣的形式存在),则至少需要消耗金属铝的物质的量为 .(4)、(二)2015年8月12日天津海瑞公司危险品爆炸导致NaCN泄漏,对周边的环境造成极大的威胁.NaCN遇水就会产生剧毒物质HCN,请写出其离子方程式
(5)、天津此次事故中是用双氧水来处理泄漏的NaCN,处理后产生有刺激性气味的氨气与NaHCO3 , 请写出该反应的化学方程式(6)、此次事故中(填“能”或“不能”)用酸性高锰酸钾来处理泄漏的NaCN.请用文字结合方程式解释 . -
11、卤素可形成许多结构和性质特殊的化合物。回答下列问题:(1)、470K时,F2与Cl2反应生成ClF。常温常压下,ClF为无色气体,固态ClF的晶体类型为 , ClF水解反应的产物为 (填化学式)。(2)、ClO2中心原子为Cl,Cl2O中心原子为O,二者均为V形结构,但ClO2中存在大π键(
 )。ClO2中Cl原子的轨道杂化方式 ;O﹣Cl﹣O键角 Cl﹣O﹣Cl键角(填“>”“<”或“=”)。比较ClO2与Cl2O中Cl﹣O键的键长并说明原因 。 (3)、一定条件下,CuCl2、K和F2反应生成KCl和化合物X。已知X属于四方品系,晶胞结构如图所示(晶胞参数a=b≠c,α=β=γ=90°),其中Cu化合价为+2。上述反应中K和F2的物质的量之比为 。与Cu原子距离最近的F原子的数目为 。若该化合物的密度为ρg•cm﹣3 , 则阿伏加德罗常数的值NA=(用含ρ、a、c的代数式表示)。
)。ClO2中Cl原子的轨道杂化方式 ;O﹣Cl﹣O键角 Cl﹣O﹣Cl键角(填“>”“<”或“=”)。比较ClO2与Cl2O中Cl﹣O键的键长并说明原因 。 (3)、一定条件下,CuCl2、K和F2反应生成KCl和化合物X。已知X属于四方品系,晶胞结构如图所示(晶胞参数a=b≠c,α=β=γ=90°),其中Cu化合价为+2。上述反应中K和F2的物质的量之比为 。与Cu原子距离最近的F原子的数目为 。若该化合物的密度为ρg•cm﹣3 , 则阿伏加德罗常数的值NA=(用含ρ、a、c的代数式表示)。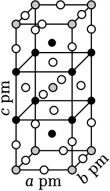
-
12、下列实验现象描述正确的是( )A、碘水中加入少量裂化汽油振荡,静置后上层颜色变浅,下层颜色变为紫红色 B、红热的铜丝在氯气中燃烧,产生了棕黄色的雾 C、电解氯化钠饱和溶液,将阳极气体产物通入碘化钾淀粉溶液中,溶液变蓝 D、溴化钠溶液中加入少量新制的氯水振荡,再加入少量四氯化碳溶液振荡,静置后上层颜色变浅,下层颜色变为橙红色
-
13、一定条件下,化合物E和TFAA合成H的反应路径如图1。已知反应初始E的浓度为0.10mol•L﹣1 , TFAA的浓度为0.08mol•L﹣1 , 部分物种的浓度随时间的变化关系如图2所示,忽略反应过程中的体积变化。下列说法错误的是( )
 A、t1时刻,体系中E的浓度为0.02mol•L﹣1 B、t2时刻,体系中无E存在 C、t3时刻,F、G、H的浓度和为0.10mol•L﹣1 D、t3时刻,G的转化率为80%
A、t1时刻,体系中E的浓度为0.02mol•L﹣1 B、t2时刻,体系中无E存在 C、t3时刻,F、G、H的浓度和为0.10mol•L﹣1 D、t3时刻,G的转化率为80% -
14、通过集成甲烷催化重整与熔融碳酸盐燃料电池,可实现低碳产氢,原理示意图如图。下列说法错误的是( )
 A、燃料电池中
A、燃料电池中 既是电极反应物又可用于导电
B、电极a、b上所消耗气体的物质的量之比为3:2
C、电池工作时,电流由电极a经用电器流向电极b
D、若a极产物中n(CO2):n(H2O)=9:1,H2分离膜中H2吸收率约为91.7%
既是电极反应物又可用于导电
B、电极a、b上所消耗气体的物质的量之比为3:2
C、电池工作时,电流由电极a经用电器流向电极b
D、若a极产物中n(CO2):n(H2O)=9:1,H2分离膜中H2吸收率约为91.7%
-
15、某同学用下列装置制备并检验Cl2的性质.

下列说法正确的是( )
A、Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗完 B、Ⅱ图中:生成蓝色的烟 C、Ⅲ图中:量筒中发生了加成反应 D、Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 -
16、解释下列反应原理的离子方程式正确的是( )A、用明矾作净水剂:Al3++3H2O═Al(OH)3↓+3H+ B、用小苏打治疗胃酸过多:CO32﹣+2H+═CO2↑+H2O C、用氯化铁溶液腐蚀印刷线路板上的铜:Fe3++Cu═Fe2++Cu2+ D、含等物质的量的KHCO3和Ba(OH)2溶液混合:HCO3﹣+Ba2++OH﹣═BaCO3↓+H2O
-
17、已知下述三个实验均能发生化学反应.下列判断正确的是( )
①
②
③
将铁钉放入硫酸铜溶液中
向硫酸亚铁溶液中滴入几滴浓硝酸
将铜丝放入氯化铁溶液中
A、上述实验证明氧化性:Fe3+>Fe2+>Cu2+ B、实验①中铁钉只作还原剂 C、实验②中Fe2+既显氧化性又显还原性 D、实验③中发生的是置换反应 -
18、盐泥是氯碱工业的废渣,主要成分为Mg(OH)2、CaCO3(含少量的FeO、Fe2O3、Al2O3及SiO2)。实验室中利用盐泥制备无水MgSO4的流程如图:

已知:硫酸钙微溶于水,溶解度随温度的升高而降低。
下列说法正确的是( )
A、“废渣Ⅰ”的主要成分为SiO2 B、调pH≈5是为了促进Al3+、Fe3+、Fe2+水解 C、步骤④分离“废渣Ⅱ”时需要趁热过滤 D、步骤⑤需要加热至有大量晶体析出时才能停止加热 -
19、冠醚能与阳离子作用,12﹣冠﹣4与Li+作用而不与K+作用;18﹣冠﹣6与K+作用,但不与Li+或Na+作用。下列说法错误的是( )
 A、冠醚与阳离子作用跟环的大小有关 B、超分子中O原子与K+间存在离子键 C、12﹣冠﹣4中C和O的杂化方式相同 D、18﹣冠﹣6可将KCN带入溴乙烷中
A、冠醚与阳离子作用跟环的大小有关 B、超分子中O原子与K+间存在离子键 C、12﹣冠﹣4中C和O的杂化方式相同 D、18﹣冠﹣6可将KCN带入溴乙烷中 -
20、普鲁士蓝的晶体结构如图所示(K+未表示出来,图中所示结构为晶胞的)。下列说法错误的是( )
 A、C、N的杂化方式均为sp杂化 B、一个晶胞中有2个Fe2+ C、每个Fe3+周围有6个Fe2+ D、该晶体的密度为×1021g•cm﹣3
A、C、N的杂化方式均为sp杂化 B、一个晶胞中有2个Fe2+ C、每个Fe3+周围有6个Fe2+ D、该晶体的密度为×1021g•cm﹣3