-
1、空气中含量的控制和资源利用具有重要意义。(1)、利用高炉炼铁尾气中的制取有机物的过程如下:

相同条件下,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率随电解电压的变化如图1所示:

图1
, 选择性。
“电解”在质子交换膜电解池中进行,生成的电极反应式为 , 当电解电压为时,生成和的选择性之比为。
(2)、利用铟氧化物催化制取的可能机理如图2所示,无催化活性,形成氧空位后具有较强催化活性,将固定比例的混合气体以不同流速通过装有催化剂的反应管,选择性、转化率随气体流速变化曲线如图3所示,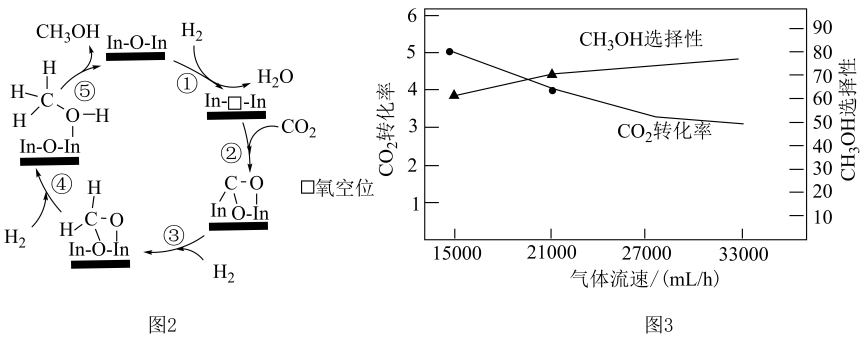
①图2中的反应每生成放出的热量,其热化学方程式为。
②若原料气中比例过低、过高均会减弱催化剂活性,原因是。
③制取时,同时发生反应 , 气体流速分别为和 , 相同时间内生成的质量,前者后者(选填“>”、“="或“<”);保持气体流速不变,反应管内温度从升高到 , 测得出口处和的物质的量均减小,可能的原因是。
-
2、以方铅矿(主要成分 , 含少量)和软锰矿(主要成分)为原料制备电池材料和 , 过程可表示为

已知:①
②
(1)、时,“协同浸取”生成和的离子方程式为;“协同浸取”时加入可避免生成沉积在矿石表面,其原因是。(2)、“沉降分铅”的目的是将滤液中的沉降为沉淀。沉降反应的平衡常数。(3)、络合萃取剂全氟聚醚-二(甲基吡啶)胺通过氮原子与形成配位键的方式萃取铅。已知氮原子的电子云密度越大配位能力越强,全氟聚醚-二(甲基吡啶)胺中氮原子和含氟基团相连使得配位能力下降,若在氮原子和含氟基团间引入基团配位能力会增强,其原因分别是。(4)、制备。(难溶于水的黑色晶体)可通过空气氧化制得,制备时溶液的温度和对的产率影响如图所示。请补充完整由净化后的含的滤液制备较纯净的的实验方案:取一定量的含的滤液于三颈烧瓶中, , 真空40干燥得产品。(必须使用的试剂:空气、蒸馏水、氨水、稀硝酸、溶液。)
-
3、化合物H是治疗胃癌的小分子靶向抗肿瘤药物,其合成路线如下:
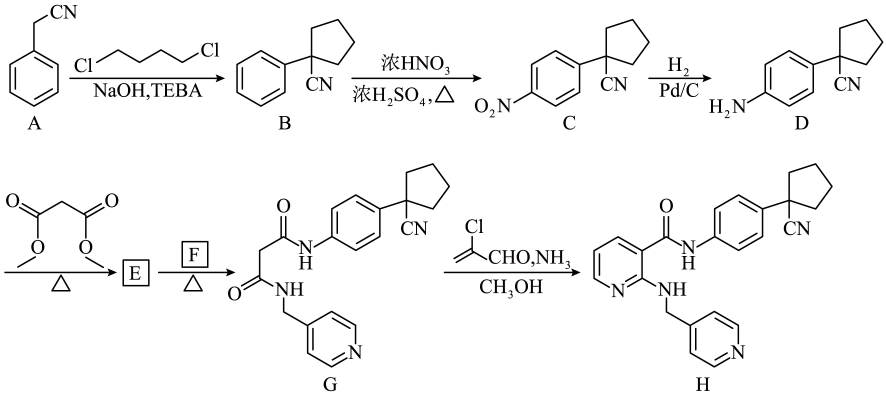 (1)、A分子中碳原子的杂化轨道类型有种。(2)、写出同时满足下列条件的C的一种同分异构体的结构简式:。
(1)、A分子中碳原子的杂化轨道类型有种。(2)、写出同时满足下列条件的C的一种同分异构体的结构简式:。①苯环上有4个取代基,能与溶液发生显色反应;
②核磁共振氢谱图中有3个峰。
(3)、的反应中均有生成,则的结构简式为。(4)、的反应中有一种与互为同分异构体的副产物生成,其结构简式为。(5)、写出以 、
、 、
、 和为原料,制备
和为原料,制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。 -
4、广泛用于冶金、化工行业,可制取多种含钒化合物。(1)、实验室制备氧钒(Ⅳ)碱式碳酸铵晶体,过程如下:

“还原”步骤中生成 , 反应的化学方程式为;若不加 , HCl也能还原生成和 , 分析反应中不生成的原因。
(2)、对制得的晶体进行含钒量的测定:称取样品,经过系列处理后将钒(Ⅳ)完全氧化,定容为溶液;量取溶液,加入指示剂,用的标准溶液滴定至终点,滴定过程中反应为;平行滴定4次,消耗标准溶液的体积分别为 , 则样品中钒元素的质量分数为(写出计算过程,结果保留两位小数)。(3)、时,将氧钒碱式碳酸铵晶体与反应制备共价晶体 , 一段时间后,固体质量不再变化,经检测仍有氧钒碱式碳酸铵剩余,可能的原因是。(4)、可溶于强酸强碱,不同、不同钒元素浓度时,价存在形态如题图所示:
①将溶解在烧碱溶液中,剩余溶液的 , 反应的离子方程式为。
②具有对称结构,其结构式可表示为。
-
5、二甲醚和水蒸气制氢气可作为燃料电池的氢能源,发生的主要反应如下:
反应Ⅰ
反应Ⅱ
反应Ⅲ
在恒压下,将一定比例的二甲醚和水蒸气混合后,以一定流速通过装有催化剂的反应器,反应相同时间测得的实际转化率、实际选择性与平衡选择性随温度的变化如图所示.的选择性 . 下列说法不正确的是( )
 A、曲线表示实际转化率随温度的变化 B、时,反应Ⅱ的速率大于反应Ⅲ的速率 C、适当增加 , 有利于提高的产率 D、一定温度下,若增大压强,的平衡产量不变
A、曲线表示实际转化率随温度的变化 B、时,反应Ⅱ的速率大于反应Ⅲ的速率 C、适当增加 , 有利于提高的产率 D、一定温度下,若增大压强,的平衡产量不变 -
6、室温下,体系中各含碳微粒的物质的量分数与的关系如图1所示.在的体系中,研究在不同时的可能产物,与的关系如图2所示,曲线Ⅰ的离子浓度关系符合 , 曲线Ⅱ的离子浓度关系符合。

下列说法正确的是( )
A、由点可求得 B、的体系中: C、点的体系中,发生反应 D、点的体系中, -
7、利用碳氮化反应 , 可将转化为 , 再进一步还原得到金属钛,下列说法正确的是( )A、碳氯化反应在高温下不能自发进行 B、加压、降温均可增大生成的速率 C、反应中每消耗 , 转移电子的数目约为 D、将与粉碎并混合均匀后反应可提高的平衡转化率
-
8、室温下,下列实验探究方案能够边到探究目的的是( )
选项
探究方案
探究目的
A
将溴丁烷与的乙醇溶液混合后加热,生成的气体通入的溶液中,观察现象
溴丁烷能否发生消去反应生成烯烃
B
将气体通入紫色石蕊溶液中,观察溶液颜色变化
是否具有漂白性
C
向饱和溶液中通入足量气体,观察现象
比较与在水中溶解度的大小
D
向溶液中滴加淀粉,再通入气体,观察现象
比较与氧化性的强弱
A、A B、B C、C D、D -
9、药物沃塞洛托的重要中间体的合成路线如图所示.下列说法不正确的是( )

A 最多能与反应
A、分子中所有原子有可能共平面 B、的分子组成相差 C、用红外光谱可确证存在不同的官能团 -
10、在指定条件下,下列选项所示的物质间转化能实现的是( )A、 B、 C、 D、
-
11、下列物质的结构、性质、用途具有对应关系的是( )A、浓硫酸具有脱水性,可用于干燥 B、具有强氧化性,可用作火箭助燃剂 C、冰晶石微溶于水,可用作电解铝工业的助熔剂 D、分子之间形成氢键,的热稳定性比的高
-
12、下列化学反应表示不正确的是( )A、与水反应: B、与溶液反应: C、萤石与浓硫酸共热制取HF: D、工业上,可通过电解的无水溶液(含和离子)制取 , 制时在阴极放电:
-
13、氟是已知元素中电负性最大、单质氧化性最强的元素,与稀有气体形成的分子是非极性分子,与其他卤素形成的卤素互化物(如)具有与相似的化学性质,与氮形成的可与反应生成(结构式:)。自然界中,含氯矿石有萤石、冰晶石等,萤石可与浓硫酸共热制取气体。工业上,可通过电解的无水溶液(含和离子)制取。下列有关说法正确的( )A、的空间结构为Ⅴ形 B、与互为同素异形体 C、键角: D、存在顺反异构现象
-
14、工业上利用反应制备 , 下列说法不正确的是( )A、沸点: B、离子半径: C、碱性: D、第一电离能:
-
15、实验室制取并收集 , 下列实验装置和操作不能达到实验目的的是( )
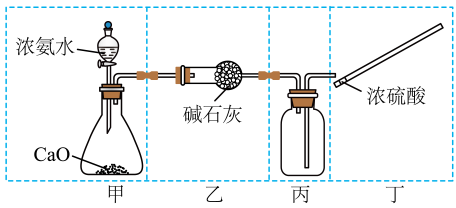 A、用装置甲制取 B、用装置乙干燥 C、用装置丙收集 D、用操作丁检验是否已收集满
A、用装置甲制取 B、用装置乙干燥 C、用装置丙收集 D、用操作丁检验是否已收集满 -
16、利用反应可制备化工试剂 . 下列说法正确的是( )A、的电子式为 B、基态原子的价电子排布图为
 C、为共价化合物
D、的VSEPR模型为平面三角形
C、为共价化合物
D、的VSEPR模型为平面三角形
-
17、C919是我国首款具有自主知识产权的干线飞机,其使用的材料中属于无机非金属材料的是( )A、铝合金机身 B、芳纶纤维舱门 C、玻璃纤维雷达罩 D、合成橡胶轮胎
-
18、天然气、石油钻探过程会释放出CO2、H2S等气体。某种将CO2和H2S共活化的工艺涉及如下反应:
①
②
③
④
回答下列问题:
(1)、已知:298K时,18g气态水转化为液态水释放出44kJ的能量;H2S(g)的标准摩尔燃烧焓(△H)为-586kJ·mol-1。则COS(g)的标准摩尔燃烧焓(△H)为kJ·mol-1 , 反应②在(填“高温”“低温”或“任意温度”)下能自发进行。(2)、一定条件下,向起始压强为200kPa的恒容密闭容器中通入等物质的量的CO2(g)和H2S(g)混合气体,发生上述反应,25min时,测得体系总压强为210kPa,S2(g)的平均反应速率为kPa·min-1。达到平衡时,测得体系总压强为230kPa, , 此时H2S(g)的平衡转化率为 , 反应②的标准平衡常数(已知:分压=总压×该组分物质的量分数,对于反应 , , 其中 , 、、、为各组分的平衡分压)。(3)、将等物质的量的CO2(g)和H2S(g)混合气体充入恒压密闭容器中,发生上述反应,反应物的平衡转化率、COS或H2O的选择性与温度关系如图所示。COS的选择性的选择性。
①表示“COS的选择性”的曲线是(填“曲线a”或“曲线b”);
②温度低于500℃时,H2S的转化率与CO2的相等,原因是。
-
19、青蒿素(Artemisinin)作为一种广谱的抗疟药物,其应用十分广泛,以下是青蒿素的一种全合成路线。

已知:
Ⅰ.

Ⅱ.

Ⅲ.

Ⅳ.

V.R,R1 , R2 , R3 , R4=H或烷基。
回答下列问题:
(1)、A中含氧官能团的名称为 , 青蒿素的分子式为。(2)、化合物 有多种同分异构体,写出满足以下条件的同分异构体结构简式。
有多种同分异构体,写出满足以下条件的同分异构体结构简式。①能与银氨溶液发生反应;②核磁共振氢谱中共含有三组吸收峰。
(3)、化合物C的结构简式为。(4)、由F生成G的反应类型为 , 稍过量K2CO3时,由G生成H的反应方程式为。(5)、参照以上合成路线,设计 为原料合成
为原料合成 的合成路线(无机试剂任选)。
的合成路线(无机试剂任选)。 -
20、是一种易溶于热水,微溶于冷水,难溶于乙醇的紫红色晶体,可利用下图装置制备。
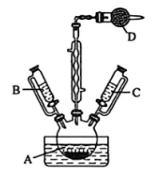
已知:①Co2+在溶液中较稳定,具有较强还原性;为深红色晶体;
② , 。
具体实验步骤如下:
I.在锥形瓶中,将12.5gNH4Cl溶于50mL水中,加热至沸,加入25.0g研细的CoCl2·6H2O晶体,溶解得到混合溶液;
Ⅱ.将上述混合液倒入仪器A中,用冰水浴冷却,利用仪器B分批次加入75mL试剂X,并充分搅拌,无沉淀析出;
Ⅲ.再利用仪器C逐滴加入20mL试剂Y,水浴加热至50~60℃,不断搅拌溶液,直到气泡终止放出,溶液变为深红色;
Ⅳ.再换另一个仪器C慢慢注入75mL浓盐酸,50~60℃水浴加热20min,再用冰水浴冷却至室温,便有大量紫红色晶体析出,最后转移至布氏漏斗中减压过滤;
V.依次用不同试剂洗涤晶体,再将晶体转移至烘箱中干燥1小时,最终得到mg产品。
回答下列问题:
(1)、研细CoCl2·6H2O晶体的仪器名称为 , 仪器D中的试剂为。(2)、步骤Ⅱ、步骤Ⅲ中使用试剂X和试剂Y分别为、(填标号),步骤Ⅱ中75mL试剂X需分批次滴加的目的是①浓氨水②NaOH溶液③KMnO4溶液④30%双氧水
(3)、写出步骤Ⅲ中发生反应的离子方程式。(4)、步骤V中使用的洗涤试剂有冰水、乙醇、冷的盐酸,洗涤剂使用的先后顺序是冰水、。(5)、最终获得产品会含少量杂质或 , 产品组成可表示为 , 通过测定z值可进一步测定产品纯度,进行如下实验:实验I:称取一定质量的产品溶解后,加入几滴K2CrO4溶液作指示剂,用cmol·L-1AgNO3标准溶液滴定达终点时,消耗。
实验Ⅱ:另取相同质量的产品,加入稍过量cmol·L-1AgNO3标准溶液,加热至沸使钴配合物分解,加入硝基苯静置、分层,将白色沉淀完全包裹,再加入几滴溶液作指示剂,用cmol·L-1KSCN标准溶液滴定剩余的AgNO3 , 达终点时消耗。
计算(用、和表示);若实验Ⅱ中加入硝基苯的量太少,会导致y值(填“偏大”、“偏小”或“不变”)。