-
1、工业上常用软锰矿(主要成分为MnO2 , 含少量Fe2O3、Al2O3、SiO2)和Li2CO3合成电极材料LiMn2O4并回收净水剂明矾,其工艺流程如图所示。
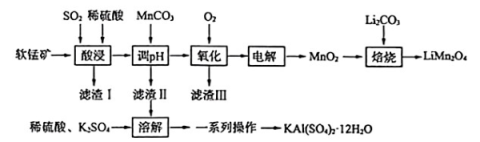
已知:①Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化;
②当溶液中某离子浓度时,可认为该离子沉淀完全;常温下,几种沉淀的如下表所示:
③lg5=0.7。
回答下列问题:
(1)、“酸浸”时,通入稍过量SO2的目的是 , 一定温度下,软锰矿与不同浓度的硫酸反应60min时结果如下表所示:c(H2SO4)/mol·L-1
1.0
5.0
10.0
16.0
18.0
Mn浸出率/%
25
78
95
85
55
Al浸出率/%
35
90
83
5
0
则“酸浸”时,选择c(H2SO4)为mol·L-1。
(2)、加入MnCO3“调pH”时,若c(Mn2+)=1.0mol·L-1 , 其他金属阳离子浓度为0.001mol·L-1 , 则调pH的范围为 , 若“滤渣Ⅲ”主要成分为FeOOH,则“氧化”操作中主反应的离子方程式为。(3)、“焙烧”操作中,为了提高Li2CO,利用率,加入稍过量的MnO2 , 加热至600℃~750℃便制得LiMn2O4 , 则反应的化学方程式为 , 整个流程中,可以循环使用的物质有。(4)、获取明矾的“一系列操作”是。 -
2、含氮物质在工业上应用非常广泛。将单质钡(Ba)、铼(Re)以一定比例混合,于特制容器中加热,依次通入N2、O2可制得某黑色晶体。该晶体晶胞如图所示,含有多个由Ba(+2)、Re(+4)、O(-2)和N(-3)组成的八面体与平面三角形,括号中为其化合价。
回答下列问题:
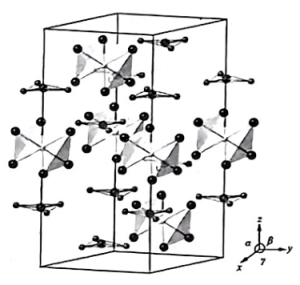 (1)、基态Ba原子的简化电子排布式为[ ] , N、O、Ba简单氢化物的沸点由高到低的顺序为(填化学式)。(2)、中N原子的杂化方式为 , 下列离子或分子与互为等电子体的是(填标号)。
(1)、基态Ba原子的简化电子排布式为[ ] , N、O、Ba简单氢化物的沸点由高到低的顺序为(填化学式)。(2)、中N原子的杂化方式为 , 下列离子或分子与互为等电子体的是(填标号)。a. b. c.SO3 d.
(3)、苯胺(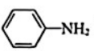 )中N原子与苯环形成p-π共轭,
)中N原子与苯环形成p-π共轭,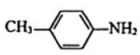 、
、 、
、 的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。 (4)、该晶体中含有的八面体和平面三角形的个数比为 , 晶体的化学式为。(5)、晶胞参数为apm、apm、cpm, , , 该晶体的密度为g·cm-1(写出表达式)。
的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。 (4)、该晶体中含有的八面体和平面三角形的个数比为 , 晶体的化学式为。(5)、晶胞参数为apm、apm、cpm, , , 该晶体的密度为g·cm-1(写出表达式)。 -
3、常温下,水溶液中H2A、HA-、A2-、HB、B-的分布系数[如]随POH变化曲线如图1所示,溶液中与关系如图2所示。用0.1mol·L-1H2A溶液滴定20.00mL0.1mol·L-1BaB2溶液,若混合后溶液体积变化忽略不计,下列说法错误的是( )
图1
 图2
图2 A、常温下,H2A的 B、当滴入5.00mLH2A溶液时, C、当滴入20.00mLH2A溶液时,此时溶液的pH约为5.1 D、当溶液的pOH=7时,
A、常温下,H2A的 B、当滴入5.00mLH2A溶液时, C、当滴入20.00mLH2A溶液时,此时溶液的pH约为5.1 D、当溶液的pOH=7时, -
4、苯乙烯是合成树脂、离子交换树脂及合成橡胶等的重要单体,常用如下反应来制备:
 .在T1℃、10MPa反应条件下,向甲、乙、丙三个容器中分别通入n(乙苯):n(N2)为1:1、1:4、1:9的混合气体,发生上述反应,测得乙苯转化率随时间变化如表所示。
.在T1℃、10MPa反应条件下,向甲、乙、丙三个容器中分别通入n(乙苯):n(N2)为1:1、1:4、1:9的混合气体,发生上述反应,测得乙苯转化率随时间变化如表所示。10min
20min
30min
40min
50min
甲
20.5%
39.0%
54.5%
60.0%
60.0%
乙
23.5%
44.5%
61.0%
66.8%
x
丙
25.0%
45.5%
63.8%
74.0%
80.0%
下列说法正确的是( )
A、20min内,乙苯的平均反应速率从大到小的顺序是丙>乙>甲 B、若其他条件不变,把容器甲改为恒容容器,则平衡转化率变小 C、T1℃时,该反应的 D、50min时,容器丙中的反应已达到平衡状态 -
5、中科大科研团队打通了从CO2和N2电合成氨基酸的关键路径,以硫酸和硫酸钾的混合液为电解液,阴极采用Pb-Cu复合电极,其反应机理如图甲所示,N2和CO2反应历程如图乙所示。
图甲
 图乙
图乙
下列说法正确的是( )
A、乙二酸转化的电极反应式为 B、为了提高该装置的工作效率,原料中CO2与N2的物质的量之比为4:1 C、反应过程中,阴极溶液pH始终增大 D、若用惰性电极作阳极,当装置的工作效率最佳时,阳极生成的气体与阴极消耗的气体物质的量之比为3:10 -
6、利用如图所示装置探究铁上电镀铜的实验。

序号
电解液
实验结果
ⅰ
50mL0.1mol·L-1CuSO4溶液和50mL蒸馏水
阴极表面有红色固体析出,还有少量气体产生,经测定阴极区坡的电解液中有Fe2+
ⅱ
50mL0.1mol·L-1CuSO4溶液和50mL稀硫酸
阴极表面刚开始产生无色气体,一段时间后有红色固体析出,气体量减少,经测定阴极区域的电解液中有Fe2+ , 当覆盖一层红色固体后,电极表面仍然有气体生成
ⅲ
50mL0.1mol·L-1CuSO4溶液和50mL过量的浓氨水
阴极表面有致密红色固体,未观察到气体产生,经测定阴极区域的电解液中无Fe元素
已知: , 忽略NH3的挥发。下列说法正确的是( )
A、根据实验ⅰ、ⅱ可知,在一定条件下,H+优先于Cu2+放电 B、实验ⅱ中,Cu覆盖在铁电极表面或溶液中减小均可能是气体量减少的原因 C、实验ⅲ中工作一段时间后,需要定期更换铜电极和补充浓氨水 D、结合上述实验可知,当电解液pH增大时,有利于得到致密、细腻的镀层 -
7、可利用如下反应合成某新型有机太阳能电池材料的中间体。下列说法正确的是( )
 A、可用邻羟基苯甲醛和溴水在铁粉催化下合成X B、X分子可形成分子内氢键和分子间氢键 C、1molY最多可消耗3molNaOH D、类比上述反应,
A、可用邻羟基苯甲醛和溴水在铁粉催化下合成X B、X分子可形成分子内氢键和分子间氢键 C、1molY最多可消耗3molNaOH D、类比上述反应, 和
和 可生成
可生成
-
8、我国科学家发现,利用如下装置可以将邻苯二醌类物质转化为邻苯二酚类物质,已知双极膜(膜a、膜b)中间层中的H2O可解离为H+和OH-。下列说法错误的是( )
 A、电极电势:M<N B、M极电极反应式为 C、工作一段时间后,装置中需要定期补充H2SO4和NaOH D、制取0.2mol邻苯二酚类物质时,理论上有0.8molOH-透过膜a
A、电极电势:M<N B、M极电极反应式为 C、工作一段时间后,装置中需要定期补充H2SO4和NaOH D、制取0.2mol邻苯二酚类物质时,理论上有0.8molOH-透过膜a -
9、X、Y、Z、W是原子序数依次递增的前20号元素,X与Y位于不同的周期,基态X原子核外s能级上的电子总数与p能级上电子总数相等,基态Y原子价电子中不同自旋状态的电子数之比为1:2,X、W的质子数之和等于Y、Z的质子数之和,Y、Z、W原子的最外层电子数之和等于X原子的核外电子数。下列说法错误的是( )A、ZX2为非极性分子 B、Y的氧化物属于两性氧化物 C、原子半径:W>Z D、同周期中基态原子第一电离能大于X的有3种
-
10、中国科学院理化所发现利用Pd-CdS可使PLA(
 )转化为丙酮酸(
)转化为丙酮酸( )的速率显著提高,并且优异的稳定性确保了Pd—CdS可以维持100h的反应性能,其反应机理如图所示,Pd-CdS在光照条件下产生带正电空穴(用h+表示,可捕获电子)和电子。下列说法错误的是( )
)的速率显著提高,并且优异的稳定性确保了Pd—CdS可以维持100h的反应性能,其反应机理如图所示,Pd-CdS在光照条件下产生带正电空穴(用h+表示,可捕获电子)和电子。下列说法错误的是( ) A、Pd-CdS可作乳酸制备丙酮酸的催化剂 B、在相同条件下,适当增加光的强度有利于加快反应速率 C、整个过程中,氧化产物与还原产物的物质的量之比为1:1 D、当180gPLA完全转化成丙酮酸时,理论上Pd-CdS中至少产生4molh+
A、Pd-CdS可作乳酸制备丙酮酸的催化剂 B、在相同条件下,适当增加光的强度有利于加快反应速率 C、整个过程中,氧化产物与还原产物的物质的量之比为1:1 D、当180gPLA完全转化成丙酮酸时,理论上Pd-CdS中至少产生4molh+ -
11、关于非金属含氧酸及其盐的性质,下列说法正确的是( )A、Cu与浓硝酸反应比与稀硝酸反应快,所以实验室通常用浓硝酸洗涤附着在试管内壁上的银镜 B、加热浓硫酸与NaCl固体的混合物可制备HCl,说明浓硫酸酸性强于HCl C、将CO2通入Ba(NO3):溶液无明显现象,则将SO2通入Ba(NO3)2溶液也无明显现象 D、向NaClO溶液中滴加酚酞试剂,先变红后褪色,证明NaClO在溶液中发生了水解反应
-
12、用下列实验装置和方法进行相应实验,能达到实验目的的是( )
 A、可用装置①测量反应产生气体的体积 B、可用装置②分离NH4Cl和NaCl C、可用装置③除去甲烷中混有的乙烯 D、可用装置④证明氯化银溶解度大于硫化银
A、可用装置①测量反应产生气体的体积 B、可用装置②分离NH4Cl和NaCl C、可用装置③除去甲烷中混有的乙烯 D、可用装置④证明氯化银溶解度大于硫化银 -
13、有机化合物M和N是合成英菲替尼的中间体,其结构如图所示。下列说法错误的是( )
 A、M分子中含有两种官能团 B、除氢原子外,M分子中其他原子可能共平面 C、1molN分子最多能与4molH2发生还原反应 D、N分子中的碳原子和氮原子均有2种杂化方式
A、M分子中含有两种官能团 B、除氢原子外,M分子中其他原子可能共平面 C、1molN分子最多能与4molH2发生还原反应 D、N分子中的碳原子和氮原子均有2种杂化方式 -
14、含有未成对电子的物质具有顺磁性。下列物质一定具有顺磁性的是( )A、 B、TiCl4 C、 D、
-
15、酸性高锰酸钾氧化H2O2的离子方程式为。与该反应有关的说法正确的是( )A、H2O2的球棍模型为
 B、O2的电子式为:
C、基态Mn2+价电子的轨道表示式为
B、O2的电子式为:
C、基态Mn2+价电子的轨道表示式为 D、标准状况下收集到56LO2时,最多消耗
D、标准状况下收集到56LO2时,最多消耗
-
16、实验室中,下列事故处理方法错误的是( )A、苯酚不慎沾到皮肤上,先用抹布擦拭,再用65℃水冲洗 B、若不慎打破水银温度计,应立即开窗通风并用硫磺粉末覆盖 C、金属钾燃烧起火,用干砂灭火 D、乙酸乙酯燃烧起火,用灭火毯(或湿抹布)灭火
-
17、高中生应德智体美劳全面发展。下列劳动项目与所述的化学知识没有关联的是( )
劳动项目
化学知识
A
烹饪活动:向沸汤中加入蛋液做蛋花汤
加热使蛋白质变性
B
烘焙活动:碳酸钠可以用来调节面团的酸度
Na2CO3能与酸反应
C
家务活动:擦干已洗净铁锅表面的水,以防生锈
铁与水蒸气反应生成Fe3O4
D
学农活动:施肥时铵态氮肥和草木灰不能同时使用
与在一定条件反应
A、A B、B C、C D、D -
18、钒铬还原渣是钠化提钒过程的固体废弃物,其中钒是钒铬还原渣中最有价值的元素,其主要成分为、及少量的。一种初步分离钒铬还原渣中钒铬并获得的工艺流程如下图。

已知:①“酸浸”后转化为;
②常温下,的近似为;
③有关物质的溶解度()如下表所示。
温度/℃
20
40
60
80
100
183.6
215.1
269.2
376.4
415.0
19.5
48.8
45.3
43.7
42.5
回答下列问题:
(1)、写出“滤渣”的一种用途 , “氧化”生成 , 反应中氧化剂与还原剂的物质的量之比为。(2)、常温下,若“含净化液”中 , 则“水解沉钒”调pH的范围是2.5~。(3)、“溶液1”中含 , 加入后发生的化学反应方程式为。(4)、“溶液2调pH”所发生反应的离子方程式。(5)、“多步操作”包括蒸发浓缩、、冷却结晶、过滤、洗涤等步骤。(6)、研究温度对与的氧化-水解沉钒率的影响,得到如图所示结果。钒铬还原渣酸浸液初始温度在90℃左右,降低温度能耗增加。由图可知,分别采用、进行“氧化”时,应选择的适宜温度是、 , 在“氧化”工序中不采用氧化的原因是(写出一点即可)。
-
19、乙烯是一种重要的基本化工原料,乙烯的产量可以衡量一个国家的石油化工发展水平,研究工业制取乙烯有重要的意义。(1)、Ⅰ.工业用和在一定条件下合成乙烯:
已知:①
②
(2)、在刚性密闭容器中充入体积比为的和 , 在一定条件下模拟工业合成乙烯,不同温度对的平衡转化率和催化剂催化效率的影响如图所示,下列说法不正确的是____(填字母)。 A、平衡常数: B、消耗的速率:可能小于 C、为了提高的平衡转化率,选择温度越低越好 D、M点时的压强一定小于N点时的压强(3)、Ⅱ.工业用甲烷催化法制取乙烯: , T℃时,向3L的恒容反应器中充入 , 仅发生上述反应,反应过程中的物质的量随时间变化如图所示:
A、平衡常数: B、消耗的速率:可能小于 C、为了提高的平衡转化率,选择温度越低越好 D、M点时的压强一定小于N点时的压强(3)、Ⅱ.工业用甲烷催化法制取乙烯: , T℃时,向3L的恒容反应器中充入 , 仅发生上述反应,反应过程中的物质的量随时间变化如图所示:
实验测得 , , 、为速率常数,只与温度有关,T℃时,平衡时容器内的物质的量为 , 则与的比值为(用含a的代数式表示);若将温度降低,速率常数减少的倍数:(填“>”、“=”或“<”)
(4)、Ⅲ.乙烷裂解制乙烯:T℃时,将乙烷与氦气体积比混合后,通入一密闭容器中发生反应。平衡时容器压强为 , 若乙烷的平衡转化率为80%,反应的平衡常数kPa(用分压表示,分压=总压×物质的量分数)。
(5)、Ⅳ.电解法还原二氧化碳制乙烯原理如图所示(AB表示直流电源)。
阴极电极反应式为。
-
20、一种银铟矿主要成分为、、、、、、、等物质,从该矿获得稀有金属的工艺流程如图所示:

该工艺条件下,金属离子开始沉淀和完全沉淀的pH如表:
金属离子
开始沉淀的pH
2.2
2.1
2.6
4.6
6.24
7.1
完全沉淀()的pH
3.2
3.4
4.3
6.6
8.24
9.1
(1)、“浸出”过程中金、银、铜分别转化为、、进入溶液,同时生成硫,写出发生反应的离子方程式。(2)、高温水蒸气除铁利用了易水解的性质,写出该反应的化学方程式。(3)、“二次还原”得到的滤渣主要成分(填化学式)。(4)、“二次中和”得到的滤渣除少量外,主要成分还有(填化学式)。(5)、“分铅锌”步骤中,维持饱和水溶液的浓度为0.01mol/L,为使沉淀完全(沉淀完全是指离子浓度小于或等于),需控制溶液的pH不小于。已知:;;;
(6)、一种铜铟硒晶体(化学式为)的晶胞结构如图所示,晶胞中和未标明,用A或者B代替。推断是(填“A”或“B”),晶体中一个周围与它最近且等距离的A粒子的个数为。
