-
1、下列化学用语表示正确的是( )A、键的电子云形状:
 B、固体HF中的链状结构:
B、固体HF中的链状结构: C、二聚中的杂化方式:
D、石墨的层状结构:
C、二聚中的杂化方式:
D、石墨的层状结构:
-
2、湖北盐业历史悠久,早在唐代已有零星的产盐记载。下列说法错误的是( )A、既可做调味品也可做防腐剂 B、焰色试验可用于区分和 C、电解食盐水的产物可用于生产漂粉精 D、医疗上生理盐水是含0.9%的溶液
-
3、氙及其化合物在工业生产中有重要用途。(1)、1962年,化学家巴特利特合成了氙的第一个化合物 , 其在熔化时电离出和。Xe和混合制得的反应可以表示如下:

已知:①在标准状态下将1mol离子型晶体(如NaCl)拆散为1mol气态阳离子()和1mol气态阴离子()所需要的能量叫做晶格能,的晶格能为。
②Xe的第一电离能为。
③ 。
根据以上信息,计算反应 。
(2)、不久,在三个不同实验室里又分别合成了、、三种简单化合物。其中一种化合物的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,表示阿伏加德罗常数的值。则该化合物的化学式为 , 中心原子的价层电子对数为 , 晶体密度为。 (3)、一定条件下,向恒容密闭容器中充入Xe和混合气体,反应体系中存在的平衡及相应部分数据如下表所示。
(3)、一定条件下,向恒容密闭容器中充入Xe和混合气体,反应体系中存在的平衡及相应部分数据如下表所示。已知:分压=总压×该组分物质的量分数;
对于反应
其中 , 、、、为各组分的平衡分压。
标准压强平衡常数
反应平衡
反应I:
360
反应II:
反应III:
①0(填“>”或“<”)。为提高平衡混合物中的含量,应投料比(填“增大”或“减小”)。
②673K时充人23.77molXe和 , 达平衡时容器内总压强 , 各产物的物质的量如下表所示:
化学式
物质的量/mol
3.60
19.80
0.36
则平衡转化率(保留三位有效数字),。
-
4、颠茄酮是合成麻醉剂阿托品的重要原料。20世纪初,化学家维尔施泰特通过十余步反应合成颠茄酮,但总产率仅有0.75%,部分合成步骤如下:

十几年后,化学家罗宾逊改进了合成思路,仅用3步反应便完成合成,总产率达90%。主要合成步骤如下:
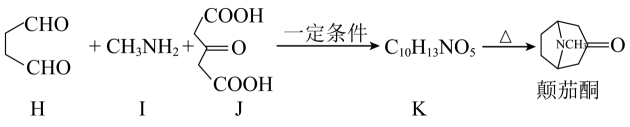
已知:

回答下列问题:
(1)、I的名称为;J的官能团名称为。(2)、C→D、G→颠茄酮的反应类型分别为、。(3)、B→C转化的第①步反应中,B的碳碳键断裂(填“σ”或“π”)。第②步反应方程式为。(4)、颠茄酮的分子式为。K的结构简式为。(5)、写出一种同时满足以下条件的颠茄酮的同分异构体的结构简式。①属于酰胺类物质
②核磁共振氢谱有三组峰,且峰面积之比为9:2:2
③能使溴的四氯化碳溶液褪色
-
5、我国科研人员合成出了尺寸可调、品质高的CdE(E=S,Se,Te)量子点,并发展成为如今镉基量子点合成的通用方法。(1)、基态S原子的价电子排布式为。CdSe量子点直径尺寸在8~12nm,所以CdSe量子点常被称为(填分散系名称)量子点。(2)、在一定条件下可由和Se反应生成 , 再由与反应制得CdSe颗粒,制备流程和生成的实验装置如图所示:

①仪器a的名称是。
②与配位剂L形成配合物的化学方程式为。
③研究表明,CdSe的生成分两步,其中第二步是与反应生成CdSe,则在碱性条件下发生的第一步反应的离子方程式为。
④某化学小组通过实验探究了60℃下,其他条件相同时,反应时间、配位剂浓度分别对纳米颗粒平均粒径的影响,结果如图1、图2所示。

根据以上实验结果预测,若要在60℃下得到平均粒径3.0nm的颗粒,最适宜的方法是。
(3)、配位剂L是一种组成人体内蛋白质的氨基酸,其质谱图如图所示,分子中含硫质量分数为26.45%且巯基(-SH)与β-碳原子直接相连,则配位剂L的结构简式为。实验室中,还可以用(填现代仪器分析法名称)获得其化学键或官能团的信息。
-
6、镍基合金是一种适宜于制造涡轮喷气发动机叶片的重要材料。某工厂用红土镍矿(主要成分为NiO,还含有FeO、、、MgO等)制取金属镍和高效催化剂黄铵铁矾 , 工艺流程如下:

已知:①在本工艺条件下,、不能氧化。
②常温下, , 。
(1)、提高红土镍矿“酸浸”浸取率的措施是(任写一种)。(2)、滤渣的主要成分为 , 其重要用途为(任写一种)。(3)、“氧化”时反应的离子方程式为。“沉铁”时反应的离子方程式为。(4)、“沉镁”前加入MgO将溶液pH调节至5.5~6.0的原因是。若调节pH后的溶液中 , 则至少需要加入molNaF 固体“沉镁”,使1L“沉镁”后的溶液中(忽略体积的变化)。(5)、工业上可用如图所示的装置电解溶液制备Ni和较浓的硫酸,则该电解池的阳极反应式为。
-
7、乙二胺四乙酸(简称EDTA,可用表示)在化学分析中常用于络合滴定,还广泛用作掩蔽剂。水溶液中,EDTA常以、、、、、和等7种形式存在。常温下,EDTA溶液中上述7种微粒的分布分数[如]与溶液pH关系如下左图所示,右图表示EDTA与某金属离子形成的螯合物的结构。下列说法错误的是( )
 A、曲线d代表 B、pH=0.9时有 C、交点Q处 D、金属离子的
A、曲线d代表 B、pH=0.9时有 C、交点Q处 D、金属离子的 -
8、一种新型原电池的工作原理如图所示,其中电极材料均为石墨,阴离子交换膜只允许通过,工作时两极室均无气体生成。下列说法错误的是( )
 A、电极a为负极 B、工作时乙室溶液pH减小 C、该电池的总反应为 D、每转移时甲室质量增加48g
A、电极a为负极 B、工作时乙室溶液pH减小 C、该电池的总反应为 D、每转移时甲室质量增加48g -
9、由实验操作和现象,能得出相应结论的是( )
选项
实验操作
现象
结论
A
向溴水中加入苯,振荡后静置
分层,水层颜色变浅
与苯发生加成反应
B
溴乙烷与NaOH的乙醇溶液共热,将产生的气体直接通入酸性高锰酸钾溶液中
溶液紫红色褪去
反应有乙烯生成
C
向试管中加入1mL10%蔗糖溶液,再加入过量10%溶液后加热煮沸。经冷却后加入新制备的并加热
没有砖红色沉淀产生
蔗糖不属于还原糖
D
向盛有2mL0.1mol/LNaCl溶液的试管中滴加2滴溶液,振荡后再向其中滴加4滴0.1mol/LKI溶液
先出现白色沉淀,后出现黄色沉淀
相同温度下
A、A B、B C、C D、D -
10、已知溶剂分子结合的能力会影响酸给出的能力,某温度下部分酸在冰醋酸中的如下表所示,下列说法错误的是( )
分子式
HCl
4.87
7.24(一级)
8.9
9.4
A、在冰醋酸中的电离方程式: B、在冰醋酸中酸性: C、结合的能力: D、相同温度下醋酸在液氨中的大于其在水中的 -
11、氧化性酸的铵盐受热分解过程中铵被氧化,产物中有大量气体,因此受热往往会发生爆炸。硝酸铵在不同温度下受热分解的产物如下表所示。下列说法正确的是( )
温度
分解产物
反应I
185~200℃
、
反应II
高于230℃
、、
反应III
高于400℃
、、
A、和的VSEPR模型名称均为四面体形 B、三个反应中,均有 C、反应I和II中,转移时生成等物质的量的气体 D、反应II和III中,均仅为氧化产物 -
12、为实现碳达峰,可以将进行碳捕集、利用与封存。科学研究发现,羟基季铵盐离子液体可以高效催化与环氧化合物合成环状碳酸酯的反应,某课题组经研究提出用离子液体三乙基羟乙基溴化铵催化此反应的机理如图所示。下列说法错误的是( )
 A、三乙基羟乙基溴化铵的催化活性可能优于无羟基结构的四乙基溴化铵 B、该过程有极性键的断裂与形成 C、若-R为 , 则
A、三乙基羟乙基溴化铵的催化活性可能优于无羟基结构的四乙基溴化铵 B、该过程有极性键的断裂与形成 C、若-R为 , 则 分子中有2个手性碳原子
D、该过程的总反应式可表示为
分子中有2个手性碳原子
D、该过程的总反应式可表示为
-
13、某液晶分子结构如图所示,X、Y、Z、W为原子序数依次增大的短周期非金属元素,基态X原子的电子只有一种自旋取向,基态W原子核外s能级上的电子总数与p能级上的电子总数相等,Y与W的质子数之和等于Z的质子数的2倍。下列说法错误的是( )
 A、电负性:W>Z>Y B、第一电离能:Z>W>Y C、常见单质分子键能:X>W>Z D、简单氢化物沸点:W>Z>Y
A、电负性:W>Z>Y B、第一电离能:Z>W>Y C、常见单质分子键能:X>W>Z D、简单氢化物沸点:W>Z>Y -
14、物质结构决定物质性质。下列结构因素不能解释相应物质性质的是( )
选项
物质性质
结构因素
A
乙醇与钠的反应没有水与钠的反应剧烈
氢氧键极性
B
对羟基苯甲酸的沸点高于邻羟基苯甲酸
氢键类型
C
干冰因易升华而用作制冷剂
共价键强弱
D
水晶柱面上的固态石蜡在不同方向熔化的快慢不同
原子有序排列
A、A B、B C、C D、D -
15、下列比较中前者大于后者的是( )A、由镁原子核形成的微粒电离一个电子所需最低能量:与 B、基态氟原子:未成对电子数与成对电子数 C、H-O-H键角:与 D、分子的极性:与HCN
-
16、桂皮中含有的肉桂醛是一种食用香料,工业上可通过如下反应制备肉桂醛:

设为阿伏加德罗常数的值。下列说法正确的是( )
A、0.5mol 分子中含有的σ键数目为
B、标准状况下,含有的π键数目为
C、1mol
分子中含有的σ键数目为
B、标准状况下,含有的π键数目为
C、1mol 中杂化的碳原子数为
D、1L0.1mol/LNaOH溶液中含有的氧原子数目为
中杂化的碳原子数为
D、1L0.1mol/LNaOH溶液中含有的氧原子数目为
-
17、腺嘌呤核苷酸是生产核酸类药物的中间体,其分子结构如图所示。下列有关说法正确的是( )
 A、能发生消去反应和加成反应 B、所有中心原子均采取杂化 C、水解生成的碱基的分子式为 D、水解生成的戊糖的核磁共振氢谱有7组峰
A、能发生消去反应和加成反应 B、所有中心原子均采取杂化 C、水解生成的碱基的分子式为 D、水解生成的戊糖的核磁共振氢谱有7组峰 -
18、下列装置(部分加热、夹持等仪器未画出)可以用于相应实验的是( )


A.分离二氯甲烷和四氯甲烷
B.提纯含有少量氯化钠和泥沙的苯甲酸


C.用电石与水反应制取乙炔
D.比较乙酸、碳酸和苯酚的酸性强弱
A、A B、B C、C D、D -
19、下列表示相应化学反应的方程式正确的是( )A、表示铅酸蓄电池充电时的阴极反应式: B、表示丙烷燃烧热的热化学方程式: C、表示乙醇被酸性重铬酸钾溶液氧化的离子方程式: D、表示合成锦纶66的有机反应式:nH2N(CH2)6NH2+nHOOC(CH2)4COOH
 +(2n-1)H2O
+(2n-1)H2O
-
20、乙炔是最简单的炔烃,常用氧炔焰来焊接或切割金属。下列有关其化学用语表达错误的是( )A、电子式
 B、球棍模型
B、球棍模型 C、C原子杂化轨道电子云轮廓图
C、C原子杂化轨道电子云轮廓图 D、基态C原子价层电子排布图
D、基态C原子价层电子排布图