-
1、化合物ⅸ是一种烯丙胺类抗真菌药物,可用于皮肤浅部真菌感染的治疗,它的一种合成路线如下:
 (1)、根据化合物ⅰ的结构特征,分析预测其可能的化学性质,完成下表:
(1)、根据化合物ⅰ的结构特征,分析预测其可能的化学性质,完成下表:序号
反应试剂、条件
反应形成的有机产物的结构简式
反应类型
a
消去反应
b
加成反应
(2)、反应①中,化合物ⅰ与有机物x反应,生成化合物ⅱ,原子利用率为100%,x的名称为。(3)、化合物iv中含氧官能团的名称是 , 反应③的类型是。(4)、关于反应⑤的说法中,不正确的有___________。A、反应过程中,有C-Cl键和C-N键断裂 B、反应过程中,有C-N键和H-Cl键的形成 C、反应物ⅶ中,所有原子可能处于同一平面上 D、生成物ⅶ具有碱性,能与稀盐酸发生反应(5)、化合物iii有多种同分异构体,其中含C=C-C=C结构,且核磁共振氢谱图上只有两组峰的结构简式为。(6)、以苯乙烯和乙醛为含碳原料,利用反应③的原理,通过四步反应合成结构简式如下的化合物y,基于你设计的合成路线,回答下列问题: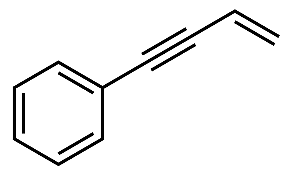
(a)从苯乙烯出发,第一步反应的化学方程式为。
(b)合成路线中涉及两步消去反应,最后一步通过消去反应得到产物的化学方程式为(注明反应条件)。
-
2、过氧化氢的水溶液适用于医用消毒、环境消毒和食品消毒。回答下列问题:(1)、的分子结构如图所示,两个氢原子犹如在半展开的书的两面上。过氧化氢属于(填“极性”或“非极性”)分子。
 (2)、根据的解离反应:、 , 、 , , 可判断为元弱酸,常温下,1的溶液的pH约为。(3)、趣味实验“大象牙膏”的实验原理是溶液在KI催化作用下分解,反应的机理表示如下:
(2)、根据的解离反应:、 , 、 , , 可判断为元弱酸,常温下,1的溶液的pH约为。(3)、趣味实验“大象牙膏”的实验原理是溶液在KI催化作用下分解,反应的机理表示如下:第一步: 慢反应
第二步: 快反应
①写出第一步反应的化学反应离子方程式:。
②在下图中画出有无KI两种情况的分解反应过程能量变化示意图:

③298K时,实验测得反应在不同浓度时的化学反应速率如表所示:
实验编号
1
2
3
4
5
0.100
0.200
0.300
0.100
0.100
0.470
0.470
c
0.940
1.410
0.00093
0.00186
0.00280
0.00187
0.00279
已知速率方程为 , 其中k为速率常数。
根据表中数据判断:a= , c=。
(4)、298K时,将10mL a mol/L溶液、10mL 2a mol/L溶液和10mL NaOH溶液混合(忽略溶液混合时的体积变化),发生反应 , 溶液中与反应时间(t)的关系如图所示。
①时时(填“大于”“小于”或“等于”)。
②若平衡时溶液的pH=12,则该反应的平衡常数K=(用含a和y的代数式表示)。
-
3、钒的用途十分广泛,有金属“维生素”之称。以含钒石煤(主要成分为、 , 杂质有、及Mg、Al、Mn等化合物)制备单质钒的工艺流程如图所示。

已知:
①该工艺条件下,溶液中金属离子开始沉淀时和完全沉淀时的pH如下表所示;
金属离子
开始沉淀时pH
1.9
7.0
3.0
8.1
完全沉淀时pH
3.2
9.0
4.7
10.1
② , , 远大于。回答下列问题:
(1)、基态V的价层电子排布式为。(2)、为了提高“焙烧”效率,可采取的措施有。(答出其中一条即可)(3)、“焙烧”时,、都转化为 , 写出转化为的化学方程式为。(4)、“水浸”加入调节溶液的pH为8.5,可完全除去的金属离子有 , 部分除去的金属离子有。“水浸”加入过量不能使完全转化为 , 用沉淀溶解平衡原理解释原因是。(一般情况下, , 化学上通常认为该反应进行完全了)。(5)、“离子交换”与“洗脱”可表示为 , 为强碱性阴离子交换树脂,为在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用。(6)、“沉钒”过程析出晶体,需要加入过量 , 目的是。(7)、钒的某种氧化物的晶胞结构如图所示,晶胞的长、宽、高分别是a pm、b pm、c pm,阿伏加德罗常数的值为 , 则该晶体的密度为(用含a、b、c、的代数式表示)。
-
4、铁的化合物在水溶液中呈现丰富的颜色,这与其水解平衡和配位平衡有关。(1)、下列为用氯化铁固体制备氢氧化铁胶体的相关实验,可以达到实验目的的是___________。
A
B
C
D
配制溶液
制备胶体
观察胶体的丁达尔效应
分离胶体与溶液



 A、A B、B C、C D、D(2)、实验室用溶液制备胶体的化学反应方程式为。(3)、实验小组为探究溶液对水解平衡的影响,在常温下设计了下列实验,通过测定透光率进行研究。
A、A B、B C、C D、D(2)、实验室用溶液制备胶体的化学反应方程式为。(3)、实验小组为探究溶液对水解平衡的影响,在常温下设计了下列实验,通过测定透光率进行研究。已知:①水解程度越大,颜色越深
②颜色越深,透光率越低
组别
溶液
蒸馏水
溶液
透光率
1
2
3
① , 。
②由 , 可证明:减小,的水解平衡逆向移动。(选填“>”“<”或“=”)
③分析实验结果: , 同学甲推测原因可能是:(较深的黄色),并做了如下实验:
组别
溶液
蒸馏水
试剂
透光率
4
试剂为 , 可由 , 证实同学甲的推测。
通过对比(填字母)的实验结果,证明对的水解平衡的影响。
A.组别4与组别1 B.组别4与组别2 C.组别4与组别3
(4)、为了探究的热效应,同学乙设计了下列四组实验方案:组别
温度
试剂
透光率
5
溶液
6
溶液
7
溶液
8
溶液
若实验结果为 , 则可证明:为吸热反应。
(5)、写出一种强酸弱碱盐(除)及其用途:。 -
5、已知高能锂离子电池的总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示(实验结束后,b中NaCl溶液浓度变大)。下列说法正确的是
 A、外电路中,电子由FeS极流向Li极 B、当电路中转移1mol e-时,b室离子数增加NA个 C、离子交换膜m为阴离子交换膜 D、若将图中n膜去掉,将b、c两室合并,则电解反应总方程式不会改变
A、外电路中,电子由FeS极流向Li极 B、当电路中转移1mol e-时,b室离子数增加NA个 C、离子交换膜m为阴离子交换膜 D、若将图中n膜去掉,将b、c两室合并,则电解反应总方程式不会改变 -
6、次磷酸(H3PO2)是一元酸,可用于金属的表面处理。已知常温下,NaH2PO2的水溶液呈碱性,下列说法错误的是A、0.01mol·L-1 H3PO2水溶液的pH>2 B、NaH2PO2的水溶液中:c(Na+)=c(H3PO2)+c(H2PO)+c(HPO)+c(PO) C、NaH2PO2在水溶液的电离方程式为:NaH2PO2=Na+ +H2PO D、NaH2PO2的水溶液加水稀释,减小
-
7、在盛有载氧体的恒容密闭容器中充入空气,发生反应:。平衡时的体积分数随反应温度变化的曲线如图所示。下列说法错误的是
 A、 B、该反应的平衡常数表达式为 C、在时加入催化剂,平衡时 D、达到平衡状态后,充入纯氧,再次达到平衡后,
A、 B、该反应的平衡常数表达式为 C、在时加入催化剂,平衡时 D、达到平衡状态后,充入纯氧,再次达到平衡后, -
8、化合物所含的5种元素均为短周期主族元素,、和为同周期元素,原子序数依次增加,的基态原子价层电子排布式为 , 的基态原子价层轨道半充满,是地壳中含量最多的元素,是有机分子的骨架元素,下列说法正确的是A、元素电负性: B、简单氢化物沸点: C、第一电离能: D、和的空间结构均为直线形
-
9、氯碱工业涉及、、NaOH、NaClO等物质。设为阿伏加德罗常数的值,下列说法正确的是A、1mol NaOH固体中的离子数目为2 B、1L 1mol/L的NaClO溶液中,的数目等于 C、标况下,22.4L的和混合气体,共价键数目为2 D、1mol 与足量NaOH溶液反应转移电子数为2
-
10、下列气体制备所选用的发生装置不正确的是
 A、①用乙醇与浓硫酸制取 B、②用铜丝与浓硝酸制取 C、③用二氧化锰与浓盐酸制取 D、④用电石与饱和食盐水制取
A、①用乙醇与浓硫酸制取 B、②用铜丝与浓硝酸制取 C、③用二氧化锰与浓盐酸制取 D、④用电石与饱和食盐水制取 -
11、下列关于生产生活的描述Ⅰ和Ⅱ均正确且有因果关系的是
选项
描述Ⅰ
描述Ⅱ
A
合成氨工业需要科研人员不断寻找高效的催化剂
催化剂可以提高平衡转化率
B
疫情防控环境卫生消杀常选用84消毒液
其主要成分NaClO具有强氧化性
C
铁质槽罐车可储运浓硝酸,但不能储运稀硝酸
稀硝酸比浓硝酸氧化性更强
D
用FeCl3溶液刻蚀电路板
Cu与FeCl3溶液发生了置换反应
A、A B、B C、C D、D -
12、水溶液中,过二硫酸盐与碘离子反应的离子方程式为: , 向溶液中加入含的溶液,反应机理如图所示。下列有关该反应的说法不正确的是
 A、反应①的速率比反应②的速率快 B、是该反应的催化剂,加入后反应体系更快达到平衡 C、向反应后的溶液小滴加淀粉溶液,溶液变蓝,再适当升温,蓝色变浅 D、反应②的离子方程式为
A、反应①的速率比反应②的速率快 B、是该反应的催化剂,加入后反应体系更快达到平衡 C、向反应后的溶液小滴加淀粉溶液,溶液变蓝,再适当升温,蓝色变浅 D、反应②的离子方程式为 -
13、银饰用久了表面会有一层而发黑,将银饰与Al片接触并加入NaCl溶液,可以除去银饰表面的 , 下列说法正确的是
 A、Al是正极 B、阴离子向银饰移动 C、电子由负极经NaCl溶液流向正极 D、表面发生反应:
A、Al是正极 B、阴离子向银饰移动 C、电子由负极经NaCl溶液流向正极 D、表面发生反应: -
14、诺氟沙星是一类常见的杀菌药物,其结构如图所示,下列说法正确的是
 A、分子中有五种含氧官能团 B、1mol该有机物可以和6mol 发生加成反应 C、可以发生消去反应和氧化反应 D、属于芳香烃衍生物
A、分子中有五种含氧官能团 B、1mol该有机物可以和6mol 发生加成反应 C、可以发生消去反应和氧化反应 D、属于芳香烃衍生物 -
15、某化学兴趣小组利用如图所示装置获取纯净的Cl2 , 其中不能达到实验目的的是




A.制备
B.纯化
C.收集
D.吸收尾气
A、A B、B C、C D、D -
16、人类文明的进化得益于化学的发展。下列有关历史事件描述中涉及的化学知识不正确的是
选项
历史事件描述
化学知识
A
石器时代:古人钻木取火
燃烧属于放热反应
B
青铜时代:用孔雀石[Cu2(OH)2CO3]炼制金属铜
Cu为还原产物
C
蒸汽时代:通过煤的干馏制取焦炭
煤的干馏属于物理变化
D
原子能时代:H、H可用于制造氢弹
H、H互为同位素
A、A B、B C、C D、D -
17、化学与生活息息相关。下列叙述错误的是A、热的碳酸钠溶液可用于去除餐具的油污 B、明矾和二氧化氯均可作净水剂,且净水原理相同 C、硫酸钡可用于胃肠X射线造影检查 D、电热水器用镁棒防止内胆腐蚀,采用的是牺牲阳极保护法
-
18、科技是第一生产力,我国科技工作者在诸多领域取得了新突破。下列说法错误的是A、我国在能源的开发利用方面走在了世界的前列,太阳能、风能和核能均属于新型能源 B、最近国产8英寸石墨烯晶圆实现了小批量生产,石墨烯属于新型有机高分子材料 C、我国研发的GaN功率芯片使手机充电实现了闪充,GaN属于新型无机非金属材料 D、我国万米“奋斗者”号载人潜水器外壳为钛合金材料,钛合金具有强度高、耐腐蚀等优点
-
19、将两种化合物一起溶于水得到一种无色透明溶液,溶液中含有下列离子中的某些离子:、、、、、、和 , 取该溶液进行如下实验:
Ⅰ.取少量溶液滴入紫色石蕊试液,溶液呈蓝色。
Ⅱ.取少许溶液滴入溶液,无白色沉淀产生。
Ⅲ.取少许溶液先滴加硝酸再加溶液,产生白色沉淀。
Ⅳ.再取少许原溶液滴入少量溶液,有白色沉淀产生。
(1)、根据以上现象判断,原溶液中肯定不存在的离子是;肯定存在的离子是。(2)、如溶液中各种离子的浓度相等,确定溶液中(填有或无) , 判断依据是。 -
20、图a、b、c分别为氯化钠在不同状态下的导电实验(X、Y均表示石墨电极,X与电源正极相连,Y与电源负极相连)微观示意图。下列说法正确的是
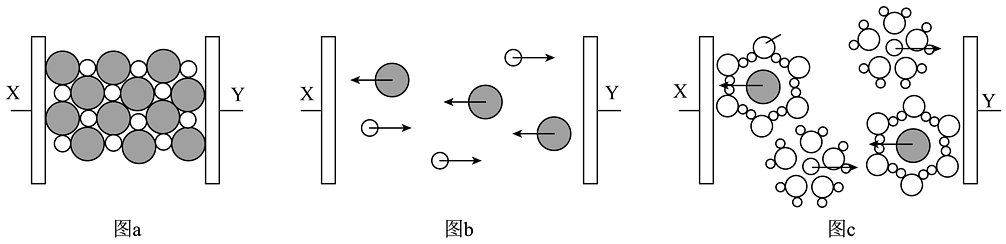 A、图b表示熔融状态下氯化钠的导电过程 B、氯化钠只有在通电条件下才能电离 C、图c中
A、图b表示熔融状态下氯化钠的导电过程 B、氯化钠只有在通电条件下才能电离 C、图c中 代表的是水合钠离子
D、氯化钠在不同状态下均能导电
代表的是水合钠离子
D、氯化钠在不同状态下均能导电