-
1、是无色澄清发烟液体沸点为 , 在潮湿空气中水解成和 , 遇生成氧氯化磷(),且氧氯化磷可用于农药、医药的制造及有机合成等。某校同学设计下列装置制取。

回答下列问题:
(1)、盛装浓盐酸的仪器名称为。(2)、装置盛放的试剂是;中进入冷凝管中的水从接口填字母进入,盛无水干燥管的作用是。(3)、实验开始前及整个过程中需通入 , 其目的是。(4)、装置中生成的离子方程式为;中白磷与反应生成三氯化磷的化学方程式为。 -
2、工业上用辉铜矿(主要成分Cu2S,含Fe3O4、SiO2杂质)为原料,生产硫酸铜晶体的工艺流程如下:

已知:①固体B为氧化物组成的混合物 ②[Cu(NH3)4]2+(aq)Cu2+(aq) + 4NH3(aq)
(1)、气体X是 , 高温下在过量空气中煅烧辉铜矿时,Cu2S发生反应的方程式为:。(2)、固体B酸溶时加入稀硫酸和H2O2 , 目的是 , 不用浓硫酸的原因是。(3)、鉴别溶液D中Fe3+完全除尽的方法是。滤液G的主要溶质是(填化学式)。(4)、由溶液E获得硫酸铜晶体的实验操作I的方法是蒸发浓缩、降温结晶、、烘干。(5)、用“间接碘量法”测定所制备的CuSO4·5H2O(不含能与I-反应的氧化性杂质)的纯度。取a g试样配成100 mL溶液,取25.00 mL该溶液,滴加KI溶液后有白色碘化物沉淀生成,滴加KI溶液至沉淀不再产生为止,然后用硫代硫酸钠标准溶液滴定生成的I2 , 发生反应的化学方程式为I2+2Na2S2O3===2NaI+Na2S4O6 , 消耗c mol·L-1Na2S2O3溶液的体积为V mL。①写出CuSO4与KI反应的离子方程式。
②计算试样中CuSO4·5H2O的纯度(用a、c、V表示)。
-
3、燃煤产生的烟气中含有较多的CO2、CO、SO2等影响环境的气体。如何综合利用这些气体一直是科研单位研究的热点。
(1)已知:
2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) ΔH1
CH3OCH3(g)+3H2O(g) ΔH1CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH2
CO2(g)+H2(g) ΔH22CO(g)+4H2(g)
 CH3OCH3(g)+H2O(g) ΔH3
CH3OCH3(g)+H2O(g) ΔH3用ΔH2、ΔH3表示ΔH1 , ΔH1=。
(2)针对CO2与H2反应转化为二甲醚(g)和H2O(g),研究发现,该反应中CO2的平衡转化率随反应温度、投料比[n(H2)/n(CO2)]的变化曲线如图:

①ΔH1(填写“>”或“<”)0。
②若其他条件不变,仅仅增大压强,则逆反应速率会(填写“增大”“减小”或“不变”,下同),平衡常数K会。
③在其他条件不变时,请在图中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图。

(3) 研究发现,催化剂可以促使烟气CO、SO2转化为CO2、S。反应原理为:
2CO(g)+SO2(g)⇌2CO2(g)+S(l) ΔH=-270 kJ·mol-1。
①其他条件相同,研究发现,分别选取Fe2O3、NiO、Cr2O3作上述反应的催化剂时,SO2的转化率随反应温度的变化如图,研究得出,应该选择Fe2O3作催化剂,主要原因可能是:。

②若在2 L恒容密闭容器中,将3 mol CO、1 mol SO2混合,在一定条件下引发反应,当SO2的平衡转化率为40%时,此时K=。
③向反应容器中再分别通入下列气体,可以使SO2转化率增大的是(填写编号)。
A.CO B.SO2 C.N2 D.H2S E.CO2
-
4、活性炭吸附法是工业提碘的主要方法之一。其流程如图:下列有关叙述正确的是( )
 A、反应①的离子方程式为2NO2-+2H2O+2I-=2NO↑+I2+4OH- B、实验室从反应②所得溶液提取碘可采用蒸馏法 C、流程中I2碘经过吸附,转化为I-、IO3-再转化为I2的过程是为了增大I2的浓度 D、反应②所得溶液呈紫色
A、反应①的离子方程式为2NO2-+2H2O+2I-=2NO↑+I2+4OH- B、实验室从反应②所得溶液提取碘可采用蒸馏法 C、流程中I2碘经过吸附,转化为I-、IO3-再转化为I2的过程是为了增大I2的浓度 D、反应②所得溶液呈紫色 -
5、下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )A、H2+CuO=Cu+H2O B、2Na2O2+2H2O=4NaOH+O2↑ C、H2+Cl2=2HCl D、2NaOH+Cl2=NaCl+NaClO+H2O
-
6、下列装置应用于实验室进行相关实验,能达到实验目的的是
 A、用装置甲在强光照条件下制取一氯甲烷 B、用装置乙分离乙酸乙酯和水 C、用装置丙蒸馏石油并收集60~150℃馏分 D、用装置丁制取并收集乙酸乙酯
A、用装置甲在强光照条件下制取一氯甲烷 B、用装置乙分离乙酸乙酯和水 C、用装置丙蒸馏石油并收集60~150℃馏分 D、用装置丁制取并收集乙酸乙酯 -
7、下列有关晶体的叙述中,正确的是
 A、氯化钠晶胞中含有4个NaCl分子 B、金刚石结构中最小的环上有6个碳原子 C、干冰晶体中,每个分子周围距离相等且最近的分子共有8个 D、金属Zn晶体中的晶胞如图所示,这种堆积方式称为体心立方堆积
A、氯化钠晶胞中含有4个NaCl分子 B、金刚石结构中最小的环上有6个碳原子 C、干冰晶体中,每个分子周围距离相等且最近的分子共有8个 D、金属Zn晶体中的晶胞如图所示,这种堆积方式称为体心立方堆积 -
8、下列说法正确的是:A、其它条件不变时,升高温度,可以提高反应物的活化分子百分数 B、其它条件不变时,增大反应物的浓度,可以提高反应物的活化分子百分数 C、保持温度不变,化学平衡正向移动时,化学平衡常数增大,逆向移动时则减小 D、其它条件不变时,加入高效催化剂,可以增大化学反应速率和反应物的转化率
-
9、LED系列产品是被看好的一类节能新产品,下图是一种氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是
 A、a处通入氢气,发生了还原反应:H2-2e-+2OH-=2H2O B、b处通入氧气,为电池的正极 C、该装置中只涉及两种形式的能量转化,电池中的KOH溶液也可用稀硫酸溶液代替 D、P-型半导体连接的是电池负极.
A、a处通入氢气,发生了还原反应:H2-2e-+2OH-=2H2O B、b处通入氧气,为电池的正极 C、该装置中只涉及两种形式的能量转化,电池中的KOH溶液也可用稀硫酸溶液代替 D、P-型半导体连接的是电池负极. -
10、短周期主族元素W、X、Y、Z 的原子序数依次增加。K、L、 M、N 均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是固体,乙是气体,K 是主要的大气污染物之一,0.05mol·L-1丙溶液的pH为1,上述物质的转化关系如下图所示。下列说法正确的是
 A、原子半径: W<X<Y<Z B、元素的非金属性: Y>Z>X C、原子最外层电子数: W<X<Y<Z D、K、L、M、N 四种物质中沸点最高的是N
A、原子半径: W<X<Y<Z B、元素的非金属性: Y>Z>X C、原子最外层电子数: W<X<Y<Z D、K、L、M、N 四种物质中沸点最高的是N -
11、下列离子方程式正确的是A、AlCl3溶液中加入足量的氨水:Al3++ 3OH- = Al(OH)3↓ B、将一小块金属钠投入到硫酸铜溶液中:2Na+Cu2+=Cu+2Na+ C、氢氧化钡溶液与硫酸反应:2H+ + SO42-+Ba2+ + 2OH-= BaSO4↓+2H2O D、将Cl2通入FeCl2溶液中:Fe2++Cl2=Fe3++2Cl-
-
12、工业上合成
 的反应为
的反应为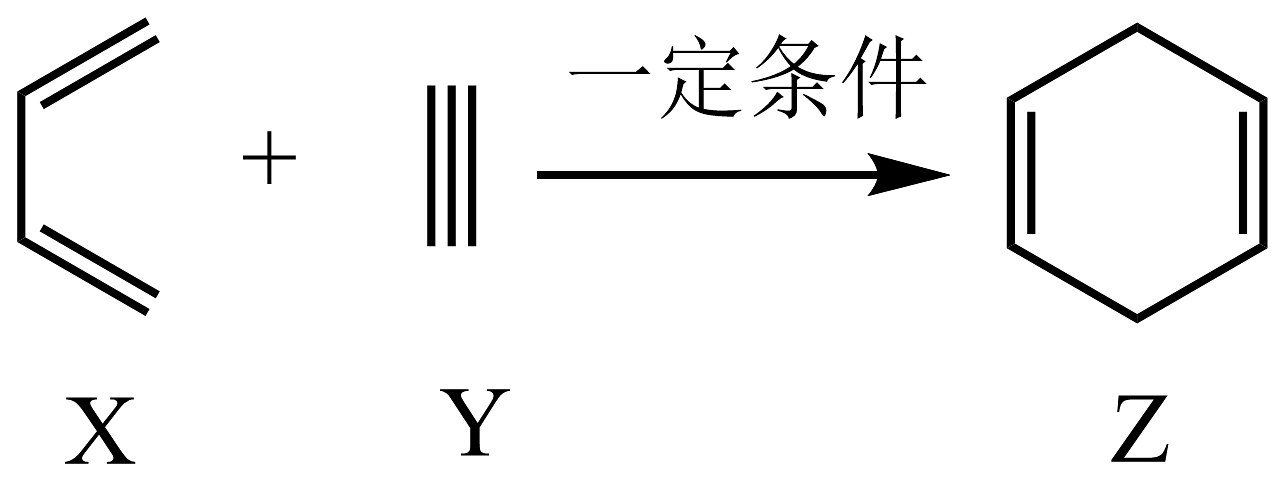 , 下列有关说法不正确的是 A、、、三种有机物均易发生加成反应 B、、、三种有机物分子中所有原子均有可能共平面 C、、、三种有机物使酸性高锰酸钾溶液褪色的原理相同 D、的二氯代物有种不考虑立体异构
, 下列有关说法不正确的是 A、、、三种有机物均易发生加成反应 B、、、三种有机物分子中所有原子均有可能共平面 C、、、三种有机物使酸性高锰酸钾溶液褪色的原理相同 D、的二氯代物有种不考虑立体异构 -
13、下列关于有机化合物的说法正确的是A、乙烯能使溴水和酸性高锰酸钾溶液褪色,且褪色原理相同 B、葡萄糖和果糖的分子式都是 , 二者互为同分异构体 C、不含其他杂质的油脂属于纯净物 D、石油裂解和油脂皂化都是化学变化,而石油的分馏和煤的干馏都是物理变化
-
14、下列反应属于氧化还原反应的是A、 B、 C、 D、
-
15、下列物质中,工业上常用电解法冶炼的是A、Fe B、Na C、Cu D、Ag
-
16、下列各项叙述中,正确的是A、、、的电负性随原子序数的增大而增大 B、价电子排布为的元素位于第周期第Ⅴ族,是区元素 C、和轨道形状均为哑铃形,能量也相等 D、原子的价电子表示式不符合洪特规则
-
17、能源可划分为一次能源和二次能源,直接来自于自然界的能源称为一次能源;需依靠其他能源的能量间接制取的能源称为二次能源。下列叙述正确的是( )A、水煤气是二次能源 B、水力是二次能源 C、天然气是二次能源 D、电能是一次能源
-
18、下列关于常见有机物的说法正确的是A、乙烯和苯都能和溴水发生化学反应而使溴水褪色 B、乙烷可使酸性高锰酸钾溶液褪色 C、糖类和蛋白质都是高分子化合物 D、乙酸和油脂都能与氢氧化钠溶液反应
-
19、干冰升华过程中,其焓变和熵变正确的是A、 , B、 , C、 , D、 ,
-
20、实验室用和浓盐酸反应生成后,按照净化、收集、性质检验及尾气处理的顺序进行实验。下列装置(“→”表示气流方向)不能达到实验目的的是
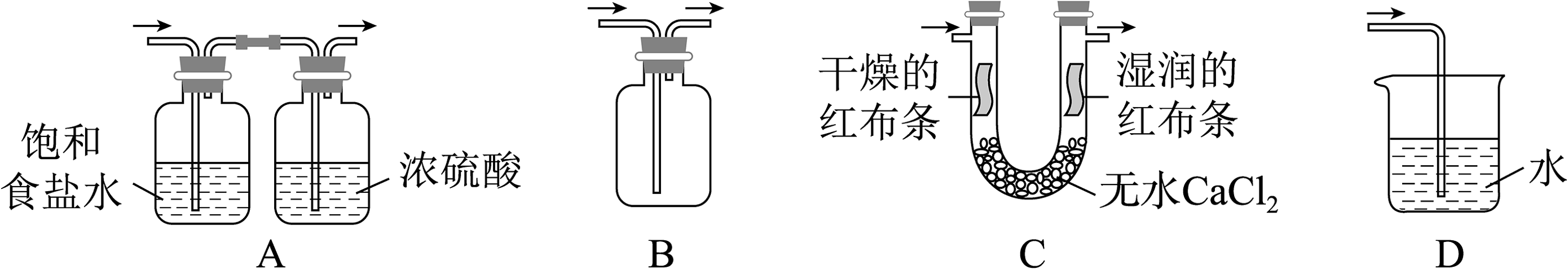 A、A B、B C、C D、D
A、A B、B C、C D、D