相关试卷
- 江苏省苏州市园区苏州大学附属中学2025-2026学年高一上学期10月月考化学试题
- 甘肃省多校2025-2026学年 高三上学期第一次联考考试 化学试卷
- 广东省金太阳2025-2026学年高三上学期8月开学联考化学试卷
- 广东省四校普通高中教学质量检测2025-2026学年高三上学期10月月考化学试题
- 江苏省部分高中2024-2025学年高一上学期期末迎考化学试题
- 江苏省盐城市七校联考2025-2026学年高三上学期期初考试化学试卷
- 广东省广州奥林匹克中学2025-2026学年高三上学期9月月考 化学试题
- 江苏省常州市金坛区第一中学2025-2026学年高三上学期开学化学试题
- 广东省清远市阳山县南阳中学2025-2026学年高一上学期第一次月考 化学试题
- 广州市2025-2026学年高三上学期 八月阶段训练化学试题
-
1、根据下列实验操作和实验现象,相应的解释或结论正确的是
选项
实验操作
实验现象
解释或结论
A
将红热木炭加入到浓硝酸中
有红棕色气体产生
木炭将浓硝酸还原
B
向溶液中滴加2滴溶液,振荡,再滴加4滴溶液
先产生白色沉淀,再变为黄色沉淀
AgI比AgCl更难溶于水
C
向溶液中滴加少量溶液
产生白色沉淀
与发生相互促进的水解反应
D
测定溶液的pH,空气中加热一段时间后冷却,再次测定pH
溶液pH变小
加热促进水解,增大,且增大,因此增大
A、A B、B C、C D、D -
2、在工业上,萤石是氟元素的主要来源,可用酸浸法从矿石中提取。将过量粉末置于水中得到悬浊液,再向其中通入气体,发生反应:。溶液中和和pH的关系可用曲线X或Y表示(溶液体积变化忽略不计)。下列说法正确的是
 A、 B、曲线X代表随pH的变化 C、水的电离程度:A>B>C D、B点溶液中的微粒浓度大小:
A、 B、曲线X代表随pH的变化 C、水的电离程度:A>B>C D、B点溶液中的微粒浓度大小: -
3、是极强的氧化剂,能与反应生成和。也能发生自耦电离: , 其分子结构如图。下列说法正确的是
 A、比更易发生自耦电离 B、离子空间构型为正四面体 C、与过量反应的产物还包括HCl D、与Fe反应生成和
A、比更易发生自耦电离 B、离子空间构型为正四面体 C、与过量反应的产物还包括HCl D、与Fe反应生成和 -
4、研究人员在熔融盐电解槽中合成氨。如图所示,该装置包括两个电解过程,和反应生成LiH和为电氢化过程,LiH和反应生成和为电氮化过程,两个过程没有同时发生,而是交替进行。下列说法不正确的是
 A、电氮化过程中可在阴极附近通 B、“Anode”连接电源的正极,发生氧化反应 C、电氢化过程中,消耗时,理论上转移1mol电子 D、上述电解过程也可在氨水中进行
A、电氮化过程中可在阴极附近通 B、“Anode”连接电源的正极,发生氧化反应 C、电氢化过程中,消耗时,理论上转移1mol电子 D、上述电解过程也可在氨水中进行 -
5、在容积恒为1L的密闭容器中通入一定量气体A,发生反应。生成红棕色B,假设温度不变,体系中各组分浓度随时间(t)的变化如下表。下列说法不正确的是
0
20
40
60
80
0.100
0.062
0.048
0.040
0.040
0
0.076
0.104
0.120
0.120
A、0~40s,A的平均反应速率为 B、80s时,再充入A,B各0.12mol,平衡正向移动 C、升高温度,反应的平衡常数增大 D、若压缩容器,达新平衡后,混合气颜色比原平衡时深 -
6、下列说法正确的是A、若分子的中心原子为杂化,则其空间结构一定是平面三角形 B、基态原子的4s能级中只有1个电子且位于d区的元素只有1种 C、形成氢键一定会使物质沸点升高 D、形成键的两个原子可以绕轴自由旋转
-
7、X、Y、Z、M和Q五种前四周期的主族元素,原子序数依次增大。X的单质是密度最小的气体,基态Y原子的核外电子有3种空间运动状态,基态Z原子在同周期中未成对电子数最多,M的单质是一种无色气体,Q的原子序数是Y、Z和M之和,Q存在于漂白粉中。下列说法不正确的是A、第一电离能: B、最高价氧化物对应水化物的酸性: C、分子间能形成氢键 D、和之间能发生氧化还原反应
-
8、下列反应方程式正确的是A、铜粉和硫粉混合加热: B、将少量通入NaClO溶液: C、向AgCl沉淀滴加氨水: D、铅酸电池放电时负极的反应式:
-
9、物质的物理,化学性质往往是由其组成和结构决定的,下列解释不合理的是
选项
物理、化学性质
组成和结构
A
一些合金的硬度比纯金属大
合金内原子层间的相互滑动变得困难
B
硅酸盐材料大多硬度高,难溶于水
硅酸盐中形成了特殊的硅氧四面体结构
C
臭氧在中的溶解度高于在水中溶解度
臭氧是非极性分子
D
阳极氧化处理的铝制品具有抗腐蚀性
铝表面形成致密的氧化膜而钝化
A、A B、B C、C D、D -
10、蓝铜矿与焦炭一起加热时发生反应:。下列说法正确的是A、蓝铜矿既是氧化剂,又是还原剂 B、既是氧化产物,又是还原产物 C、生成时,转移电子 D、反应体系中可能出现 , CO等副产物
-
11、下列物质的性质与用途的对应关系正确的是A、极易水解,可用来制备 B、具有还原性,可除去废水中的 C、水解显碱性,可用于治疗胃酸过多 D、C非金属性大于Si,焦炭高温还原石英砂得到粗硅
-
12、下列实验装置使用正确的是
 A、图①装置用于制取并收集 B、图②装置用于测量NaClO溶液的pH C、图③装置用于研究原电池的工作原理 D、图④装置用于标准NaOH溶液测定盐酸溶液的浓度
A、图①装置用于制取并收集 B、图②装置用于测量NaClO溶液的pH C、图③装置用于研究原电池的工作原理 D、图④装置用于标准NaOH溶液测定盐酸溶液的浓度 -
13、下列表示正确的是A、的VSEPR模型:
 B、丙烷分子的空间填充模型:
B、丙烷分子的空间填充模型: C、HClO的电子式:
C、HClO的电子式: D、基态Br原子的轨道表示式:
D、基态Br原子的轨道表示式:
-
14、铁是应用最广泛的金属,下列关于铁及其化合物说法正确的是A、还原铁粉可用作食品干燥剂 B、红热的铁与水蒸气反应生成四氧化三铁和氢气 C、接触法制硫酸时,煅烧黄铁矿以得到三氧化硫 D、浓硝酸与铁在常温下不能反应,所以可用铁质容器贮运浓硝酸
-
15、下列物质不属于碱性氧化物的是A、 B、 C、 D、FeO
-
16、一定量氢气在氯气中燃烧,所得混合物用100 mL3. 00 mol/L的NaOH溶液恰好完全吸收,检测到反应后溶液中有NaCl、NaClO和NaClO3。测得溶液中含有NaCl的物质的量0.250 mol,NaClO的物质的量为0.0300 mol。(1)、所得溶液中NaClO3的物质的量为。(2)、所得混合物中氯气与NaOH溶液反应的总离子方程式 。(3)、所用氯气和参加反应的氢气的物质的量之比n(Cl2) : n(H2) =。
-
17、某同学设计如下实验方案,以分离KCl和两种固体混合物,试回答一列问题:
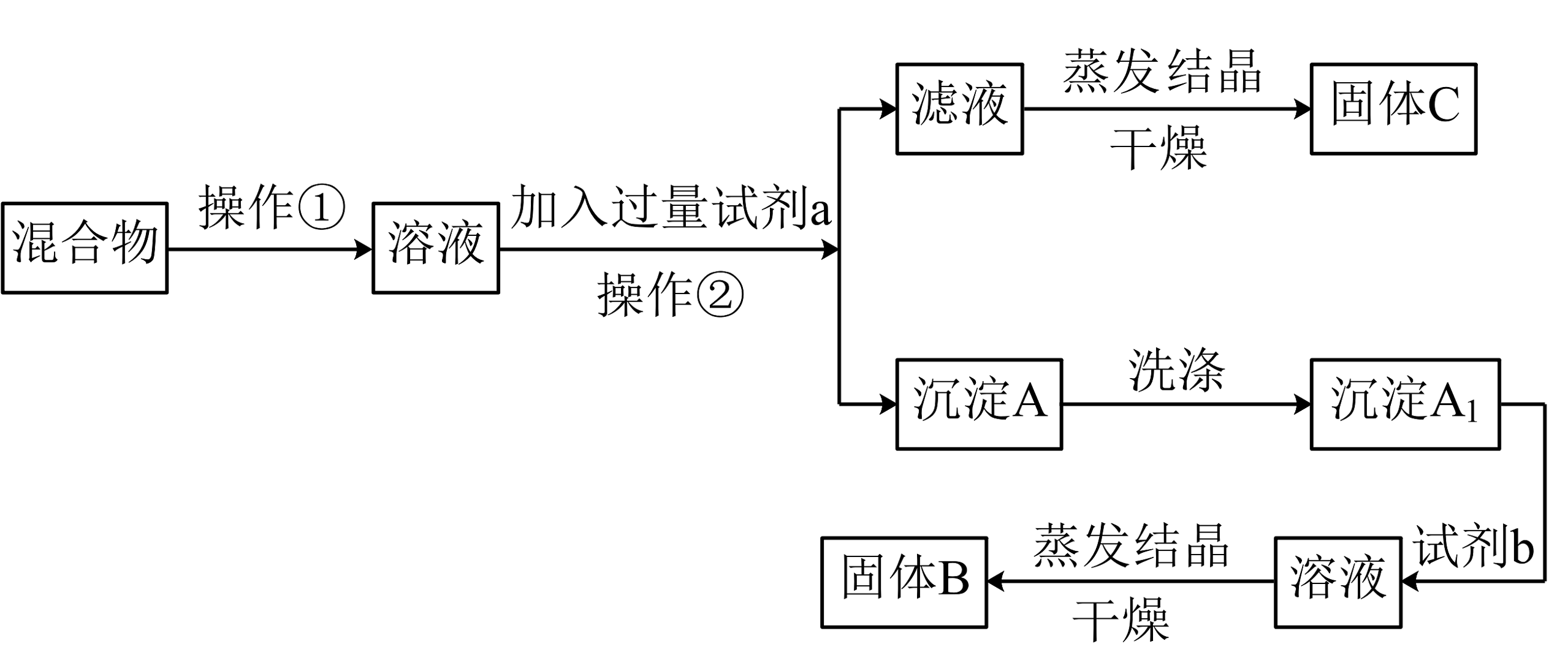
供选试剂:溶液、溶液、溶液、盐酸
(1)、试剂a是 , 操作②的名称是。(2)、该方案能否达到实验目的:(填“能”或“不能”)。若不能,应如何改进?(若能,此问不用回答)。(3)、加入试剂b所发生反应的离子方程式为。 -
18、以海水为原料,能够以低廉的成本获得氯气。除此之外,在实验室也可以多种方法制备氯气。某校化学实验兴趣小组的同学设计了如图所示的实验装置(必要的加持仪器已省略),利用如下装置制备氯气并验证氯气的某些性质。

请回答下列问题:
(1)、装置A中制取的离子方程式为。(2)、装置B中溶液出现浑浊,能否说明与溶液发生反应?请说明理由:。(3)、装置C可制取氯酸钾,化学方程式为:(浓) , 请用双线桥表示电子转移过程:。(4)、装置D中导管接错,若导致溶液进入装置E,则E中出现的现象为。此过程涉及反应的化学方程式是。(5)、氯气有剧毒,一旦泄露会对人民群众的生命安全造成重大威胁。工业生产中常用氨气检查输送氯气的管道是否有泄漏。若有泄漏,可以观察到有大量的白烟生成(为固体),同时会生成一种空气中含量最多的物质,试写出该反应的化学方程式:。 -
19、海洋是一个巨大的化学资源宝库,海水中NaCl含量在30g/L左右,是制碱工业理想的原料,我国化工专家侯德榜先生的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。某化学兴趣小组的同学在实验室中模拟“侯氏制碱法”,最终得到和的混合物。为测定其中的质量分数,进行了下列相关实验。其实验流程如下:
 (1)、该实验需要用到1.00mol/L的稀盐酸100mL,但实验室只有12.0mol/L的浓盐酸,则配制该稀盐酸需要浓盐酸mL(计算结果保留一位小数)。(2)、在该溶液的配制过程中,用到的玻璃仪器:量筒、烧杯、玻璃棒、、。(3)、配制稀盐酸时,下列操作会造成结果偏高的是________。A、配制溶液时,若加水超过容量瓶刻度,用胶头滴管将多余溶液吸出 B、容量瓶洗涤干净后,瓶内壁有少量水滴 C、未洗涤烧杯和玻璃棒 D、定容时俯视容量瓶的刻度线(4)、配制时,其正确的操作顺序是。
(1)、该实验需要用到1.00mol/L的稀盐酸100mL,但实验室只有12.0mol/L的浓盐酸,则配制该稀盐酸需要浓盐酸mL(计算结果保留一位小数)。(2)、在该溶液的配制过程中,用到的玻璃仪器:量筒、烧杯、玻璃棒、、。(3)、配制稀盐酸时,下列操作会造成结果偏高的是________。A、配制溶液时,若加水超过容量瓶刻度,用胶头滴管将多余溶液吸出 B、容量瓶洗涤干净后,瓶内壁有少量水滴 C、未洗涤烧杯和玻璃棒 D、定容时俯视容量瓶的刻度线(4)、配制时,其正确的操作顺序是。A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧、振荡、摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(5)、若实验中测得样品质量为5.92g,固体质量为5.85g,则碳酸钠的质量分数为(计算结果保留3位有效数字)。 -
20、海洋约占地球表面积的71%,浩瀚的大海美丽而富饶,其中水资源和其他化学资源具有巨大的开发潜力。海水中含有多种盐类,如①NaCl、②等。目前通过海水晒盐可制得食盐晶体和苦卤,食盐精制后可制成饱和③食盐水用以生产。④烧碱、⑤纯碱、⑥Na、⑦、⑧盐酸等。苦卤也是重要的化工原料,例如,将苦卤也是重要的化工原料,例如,将苦卤通入沉淀池,经⑨石灰乳沉淀、过滤、酸溶、浓缩、脱水、电解等工序可制得金属镁。或将苦卤用氯气氧化、热空气吹出、⑩吸收等一系列操作可以获得溴单质。海水淡化与化工生产、能源开发等相结合已经成为海水综合利用的重要方向。(1)、上述标有序号的物质中属于电解质的是(填序号,下同);属于非电解质的是;能导电的物质是。(2)、写出⑤溶于水的电离方程式:适量的④溶于装有50mL蒸馏水的烧杯中后,通入少量⑩,写出该过程对应的反应离子方程式:。(3)、离子交换法是海水淡化的主要方法之一。离子交换法获取淡水模拟图如图:

①海水中存在少量 , 检验存在的方法是。
②经过阳离子交换树脂后水中阳离子数目(填“增加”“不变”或“减少”)。