相关试卷
- 江苏省苏州市园区苏州大学附属中学2025-2026学年高一上学期10月月考化学试题
- 甘肃省多校2025-2026学年 高三上学期第一次联考考试 化学试卷
- 广东省金太阳2025-2026学年高三上学期8月开学联考化学试卷
- 广东省四校普通高中教学质量检测2025-2026学年高三上学期10月月考化学试题
- 江苏省部分高中2024-2025学年高一上学期期末迎考化学试题
- 江苏省盐城市七校联考2025-2026学年高三上学期期初考试化学试卷
- 广东省广州奥林匹克中学2025-2026学年高三上学期9月月考 化学试题
- 江苏省常州市金坛区第一中学2025-2026学年高三上学期开学化学试题
- 广东省清远市阳山县南阳中学2025-2026学年高一上学期第一次月考 化学试题
- 广州市2025-2026学年高三上学期 八月阶段训练化学试题
-
1、
甲烷及其衍生物在国民经济中有着重要的作用。
Ⅰ.可利用与制备“合成气”(CO、)
某温度下,在刚性密闭容器中充入、的物质的量之比为 , 起始总压为35kPa,使其发生及应:
(1)研究表明CO的生成速率 , 某时刻测得 , 则该时刻________。
(2)达到平衡后,测得CO的产率为50%,则该反应的平衡常数________。
(3)如该反应改为在恒容绝热容器中进行,反应达到平衡状态的标志是________(填字母)。
A.混合气体的总质量保持不变 B.、CO的浓度比为
C.容器内混合气体的压强保持不变 D.容器内混合气体的密度保持不变
E.容器内温度保持不变 F.
Ⅱ.工业上还可以用催化还原消除氮氧化物的污染
(4)已知: , 向体积为1L的刚性密闭容器中加入1.4mol和一定量NO在不同温度下发生该反应,的浓度变化如图所示,下列说法正确的是________(填序号)。
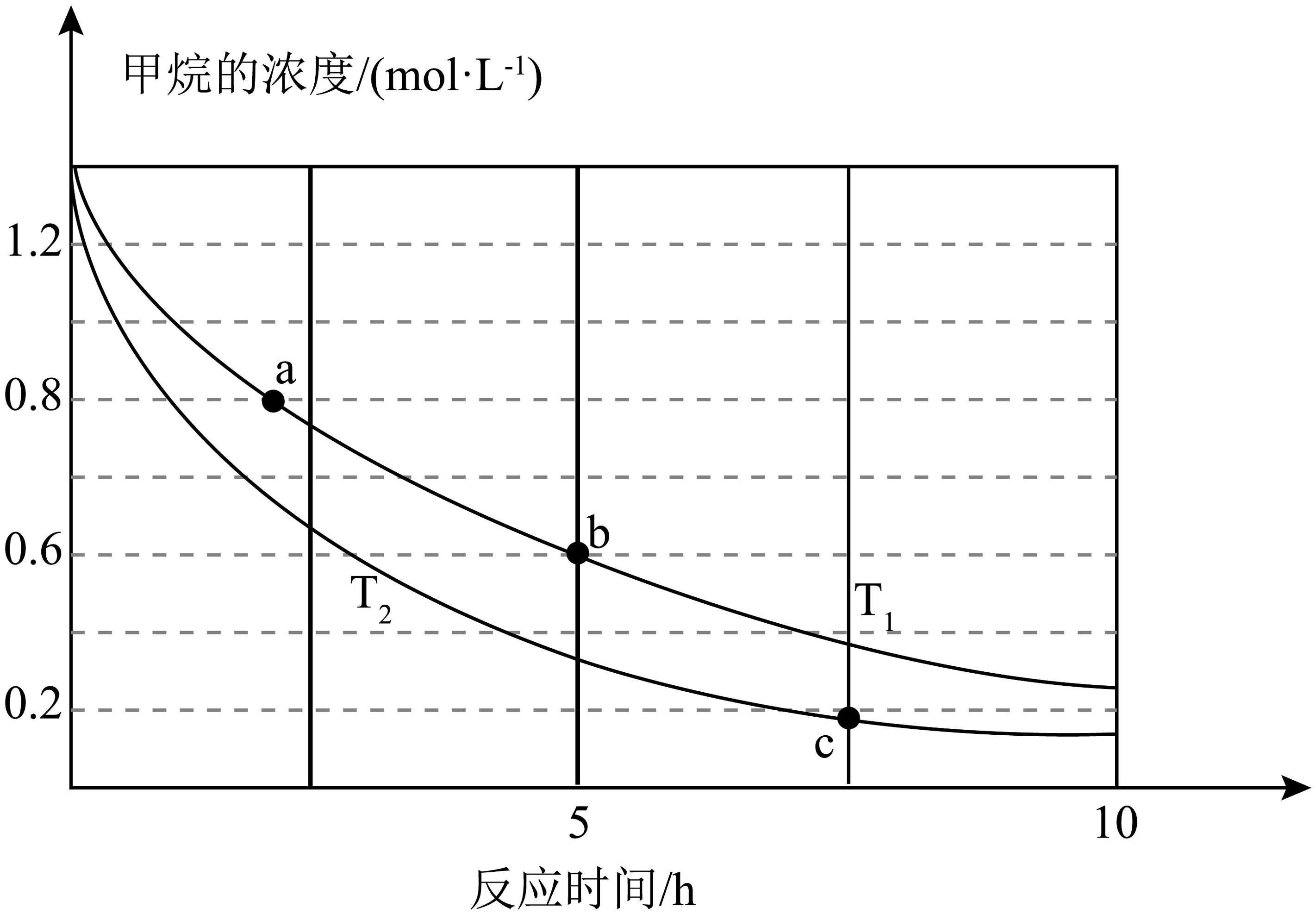
A. B. b点时氮气的浓度为1.6mol/L C. a点正反应速率大于b点的逆反应速率 D. a点的反应速率比c点的反应速率小 (5)查阅资料可知NO氧化反应历程分两步:(其中k为速率常数)
①(快)
②
一定温度下,反应达到平衡状态,请写出用、、、表示的平衡常数表达式________。
-
2、回答下列问题:(1)、已知一些化学键的键能数据如表所示:
化学键
C—H
C—F
H—F
F—F
键能
414
489
565
155
请根据键能数据写出和反应生成和的热化学方程式:。
(2)、25℃时,的NaOH溶液中由水电离出的 , 向其中加入的盐酸溶液直至过量,水的电离程度变化情况为。(3)、若在木卫六上某地,水的离子积常数 , 利用我们的地球经验,木卫六上该地的温度(填“大于”“小于”或“等于”)25℃。若用pH试纸测定该温度下纯水的pH,则试纸显色。(4)、某温度下 , 将的溶液与等物质的量浓度的溶液等体积混合,所得混合液的。(5)、常温下的电离平衡常数 , , 用NaOH溶液吸收得到的溶液,试计算溶液中。 -
3、温度为时,用的盐酸分别滴定的氨水和溶液(碱性:强于),溶液的与或的关系如图所示,。下列说法错误的是
 A、曲线I对应的是滴定的曲线 B、a点对应的溶液 C、b、e点溶液中水的电离程度: D、f点溶液中
A、曲线I对应的是滴定的曲线 B、a点对应的溶液 C、b、e点溶液中水的电离程度: D、f点溶液中 -
4、钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。
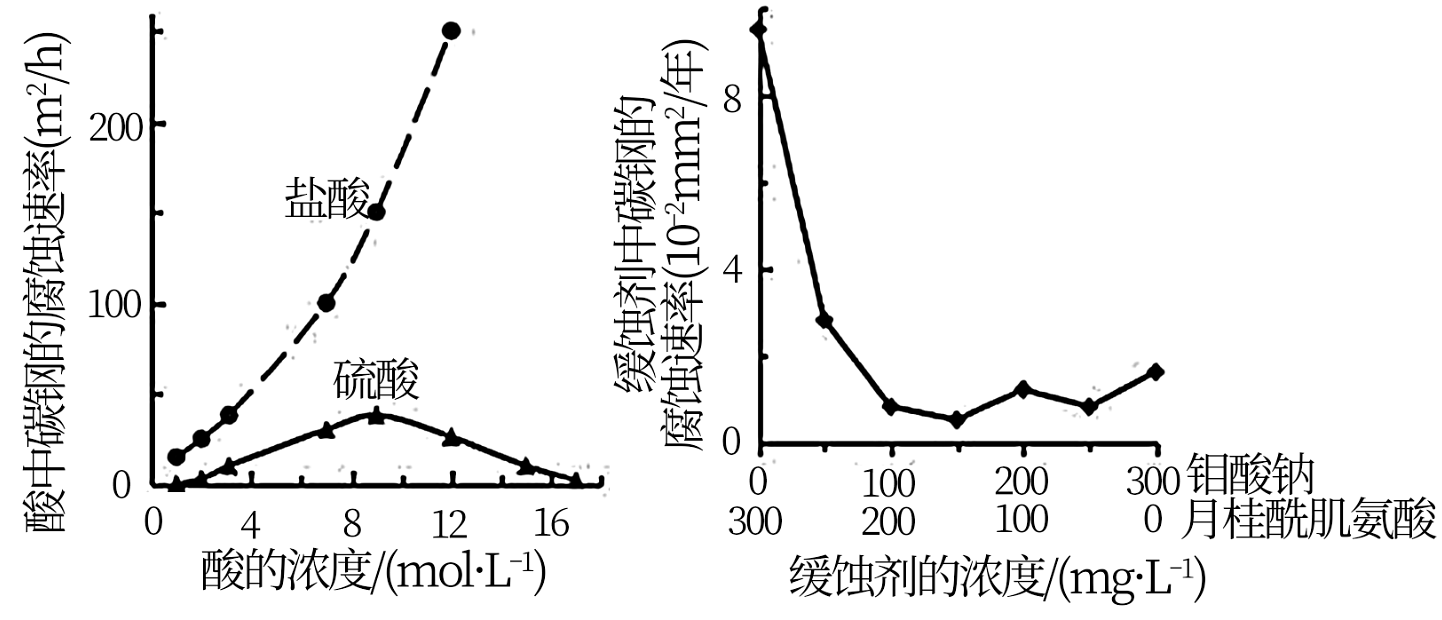
下列说法不正确的是
A、盐酸的浓度越大,腐蚀速率越快 B、钼酸钠和月桂酰肌氨酸的浓度相等时,缓蚀效果最好 C、碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正相关 D、对比盐酸和硫酸两条曲线,可知Cl-也会影响碳素钢的腐蚀速率 -
5、下列装置及设计不能达到实验目的的是
 A、测定中和反应的反应热 B、比较Fe3+和Cu2+对H2O2分解反应的催化效果 C、测定锌与稀硫酸反应生成氢气的速率 D、探究温度对化学平衡的影响
A、测定中和反应的反应热 B、比较Fe3+和Cu2+对H2O2分解反应的催化效果 C、测定锌与稀硫酸反应生成氢气的速率 D、探究温度对化学平衡的影响 -
6、如图,向1 L恒容密闭容器中充入2 mol NO和1 mol , 发生反应 kJ/mol,下列说法正确的是
 A、 , B、200℃时,0~10min内 C、12分钟时,200℃和T℃下该反应化学平衡常数恰好相等 D、若起始时向容器中充入4 mol NO和2 mol , 则200℃平衡后,NO的物质的量小于3.7 mol
A、 , B、200℃时,0~10min内 C、12分钟时,200℃和T℃下该反应化学平衡常数恰好相等 D、若起始时向容器中充入4 mol NO和2 mol , 则200℃平衡后,NO的物质的量小于3.7 mol -
7、已知电离常数: , , 。下列离子方程式书写正确的是A、饱和碳酸钠溶液中通入 B、氢氧化铁溶于氢碘酸(强酸): C、向中通入少量的气体: D、同浓度同体积的溶液与NaOH溶液混合:
-
8、某温度下,密闭容器中发生反应aX(g)bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积扩大到原来容积的两倍,当达到新平衡时,物质Y和Z的浓度均是原来的0.6倍。则下列叙述正确的是A、可逆反应的化学方程式的化学计量数:a<b+c B、扩大容器的容积时,v正增大,v逆减小 C、达到新平衡时,物质X的转化率减小 D、达到新平衡时,混合物中Z的质量分数减小
-
9、某化学兴趣小组的同学将溶液和溶液倒入淀粉和的混合溶液中,该实验的反应原理有①;②;③(橙红色)。观察到的现象为先产生橙红色沉淀,几秒钟后溶液颜色变为蓝色。下列说法错误的是A、反应①对反应②的进行有促进作用 B、该实验条件下,反应速率:③>② C、反应后混合液的pH减小 D、可以用溶液代替溶液进行上述实验
-
10、下列溶液一定呈中性的是A、pH=7的溶液 B、的溶液 C、由酸碱中和反应得到的溶液 D、非电解质溶于水得到的溶液
-
11、下列事实可用化学平衡移动原理解释的是A、在容器中充入一定量的与 , 达到平衡后压缩容器容积以增大压强,混合物颜色加深 B、实验室制备氢气时,选择纯度不高的粗锌与稀硫酸反应 C、将肝脏研磨液加入过氧化氢溶液,发现有气泡产生,加热后气泡产生速率减慢 D、实验室可用排饱和食盐水的方法收集氯气
-
12、对于常温下pH=3的醋酸溶液,下列说法正确的是A、加水稀释后,溶液中c(H+)和c(OH-)都减小 B、加水稀释到原体积的10倍后,溶液pH变为4 C、加入少量醋酸钠固体,溶液pH降低 D、与等体积pH=3的盐酸比较,醋酸跟足量锌粒反应产生的H2更多
-
13、下列关于化学反应与能量的说法正确的是A、已知正丁烷的燃烧热为 , 则表示正丁烷燃烧热的热化学方程式为 B、1mol甲烷气体和2mol氧气的总能量大于1mol二氧化碳气体和2mol液态水的总能量 C、热化学方程式书写时须注明反应的温度和压强,不注明时表明温度和压强分别是0℃和101kPa D、已知 , 则金刚石比石墨稳定
-
14、下列关于工业合成氨的叙述正确的是A、合成氨工业温度选择为450℃左右,主要是为了提高的平衡产率 B、使用催化剂和施加高压,都能提高反应速率,但对化学平衡无影响 C、将液化分离以及、循环使用均能提高合成氨反应速率和原料转化率 D、为了提高氢气的转化率,可适当增加氮气浓度
-
15、下列关于自发反应的说法正确的是A、反应产物的分子数比反应物多,则该反应 B、反应的 C、室温下不能自发进行,说明该反应的 D、非自发过程在任何条件下都不可能转变为自发过程
-
16、
明年是苯发现的两百周年,以苯为代表的芳香族化合物在各领域有广泛应用。
Ⅰ.苯乙烯()是重要的化工原料,工业上制苯乙烯的主流方法是乙苯()脱氢法,包括多种不同工艺路线,其主反应相同,最大区别是原料中添加的气体不同:传统乙苯脱氢(添加水蒸气稀释),氧化脱氢(添加),氧化脱氢(添加)。其中涉及的主要反应方程式如下:
ⅰ:(主反应)
ⅱ:(氧化脱氢还涉及的反应)
ⅲ:(氧化脱氢还涉及的反应)
请回答:
(1)氧化脱氢工艺中发生反应ⅳ:。
①________。
②反应ⅳ自发进行的条件是________。
(2)在恒温恒压条件下进行传统乙苯脱氢(反应ⅰ),可能发生2个副反应(活化能接近):
ⅴ:
ⅵ:
①以乙苯和水蒸气为原料,仅发生反应ⅰ、ⅴ、ⅵ,平衡时测得乙苯转化率为50%,芳香烃产物苯乙烯、苯、甲苯()的选择性S()分别为80%、10%、10%,反应ⅵ的平衡常数________(用分数表示)。
②下列说法正确的是________。
A.水蒸气温度较高,可为反应提供热量,且有利于减少催化剂表面的积碳
B.若其他条件不变,用等物质的量的替换水蒸气,可增大乙苯的平衡转化率
C.氧化脱氢法中苯乙烯易被过度氧化,使产品纯度降低
D.随着反应进行,和的增大程度相同
Ⅱ.重氮化反应是制备芳香族化合物的重要反应。若以Br为催化剂,作氧化剂,盐酸酸化(浓度恒定),反应方程式为:。在恒温密闭容器中反应,总反应的速率为v,反应历程中的三个基元反应如下,且基元反应ⅷ的。
ⅶ: (快速平衡)
ⅷ: (慢反应)
ⅸ: (快反应)
(3)下列说法正确的是__________。
A. 在反应过程中几乎不变 B. 其他条件不变,v与近似成正比 C. 增大 , v显著增大 D. 若且其他条件相同,和可能相等 (4)某反应条件下,反应过程中随时间t的变化如图。其他条件不变,增大初始 , 在图中画出随时间t变化的曲线________(注意曲线极值点的坐标)。

-
17、是制备金属钛的重要中间体,某兴趣小组利用如下装置在实验室制备(夹持装置略),反应方程式为:。已知信息:
物质
熔点
沸点
性质
136.4
极易水解成白色沉淀。高温时能与反应,与HCl不发生反应。能溶于有机溶剂。

请回答:
(1)、装置C的仪器名称是。仪器a相比普通的分液漏斗的优点是。(2)、装置B中冷凝水进口是(填“c”或“d”)。(3)、已知E为反应装置,B为收集装置,装置C和D中均盛有浓硫酸,完善线框中装置排序。_______________(4)、仪器b中的固体X可以是。A. B. C.
(5)、下列说法正确的是__________。A、加热E装置前,应先进行装置A中反应或打开k通一段时间 B、装置D中长导管起平衡气压和判断装置是否通畅的作用 C、装置D中的试剂也可改为饱和食盐水 D、该实验中存在的缺陷是没有进行CO的尾气处理(6)、测定所得的纯度:取粗产品加入烧瓶(),向安全漏斗中加入适量蒸馏水(装置如图),充分反应后,将烧瓶和漏斗中液体合并至锥形瓶,滴加几滴溶液作指示剂,用溶液滴定至终点,消耗滴定液20.00mL。计算所得产品纯度是。
-
18、丙烯酸乙酯天然存在于菠萝等水果中,是一种食品用合成香料,可以利用有机物A,丙烯等石油化工产品为原料进行合成。已知:有机物A的产量是衡量一个国家石油化工水平的标志,也是一种植物激素,能催熟水果。

请回答:
(1)、丙烯酸乙酯中的官能团名称是。(2)、化合物C的结构简式是。(3)、下列说法不正确的是__________。A、无机物M是一种无色无味液体 B、化合物C和丙烯酸乙酯互为同系物 C、化合物A、B都能使酸性溶液褪色 D、一定条件下,A与C反应也可得丙烯酸乙酯,该反应为取代反应(4)、写出B与C反应生成丙烯酸乙酯的化学方程式。(5)、久置的丙烯酸乙酯自身会发生聚合反应,所得聚合物具有较好的弹性,可用于生产织物和皮革处理剂。请写出上述聚合过程的化学方程式。(6)、已知化合物D是丙烯酸乙酯的同分异构体,且D中含有2个醛基(),写出化合物D的所有可能的结构简式。 -
19、常温常压下二氧化氯()是一种黄绿色气体,它具有漂白性,消毒能力较强,可替代传统的液氯作为饮用水消毒杀菌剂。实验室用以下方式制备:

请回答:
(1)、①步骤一电解的阴极反应方程式。②在水溶液中可水解成和另一种化合物,该化合物的结构式为。上述流程中在溶液中加入碱性溶液反应的离子方程式为(N在反应物和产物中的形态分别为和)。
(2)、纯易分解爆炸,故常与的烧碱溶液反应生成保存,需要时再通过溶于酸溶液反应获得 , 该反应刚开始十分缓慢,稍后一段时间产生气体急剧加快。下列说法正确的是__________。A、亚氯酸钠有强氧化性,在溶液中水解显酸性 B、和在碱性溶液中反应时,表现氧化性 C、制备时最好通入空气或进行稀释 D、两份相同溶液分别与等体积等pH的盐酸和硫酸反应,与盐酸反应可能更快(3)、设计实验验证溶液X中的金属阳离子与氯离子。 -
20、ⅢA族元素形成的化合物应用广泛。
已知:硼酸是一种弱酸()。请回答:
(1)、AlF在常温下稳定,基态离子的价电子排布式为。(2)、①镓位于元素周期表的区。②下列镓元素的微粒中,属于“激发态Ga原子”的是。
A. B. C. D.
(3)、下列说法不正确的是__________。A、第一电离能: B、、中硼原子的杂化方式均为 C、是非极性分子 D、推测溶于水显酸性(4)、铝离子电池一般用离子液体作电解质,某离子液体的结构如图。
①该化合物中阴离子的空间构型为。
②比较键角大小:阳离子中的(填“”,“”或“”)分子中的。
③传统的有机溶剂大多易挥发,而离子液体相对难挥发,原因是。